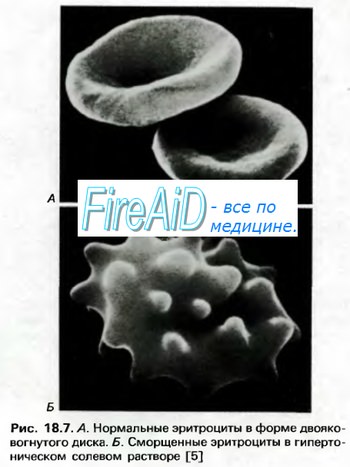
что переносит кислород в организме
Что переносит кислород в организме
Кровообращение выполняет одну из важнейших функций переноса кислорода от легких к тканям, а углекислого газа — от тканей к легким. Потребление кислорода клетками тканей может изменяться в значительных пределах, например при переходе от состояния покоя к физической нагрузке и наоборот. В связи с этим кровь должна обладать большими резервами, необходимыми для увеличения ее способности переносить кислород от легких к тканям, а углекислый газ в обратном направлении.
Транспорт кислорода.
При 37 С растворимость 02 в жидкости составляет 0,225 мл • л-1 • кПа-1 (0,03 мл/л/мм рт. ст.). В условиях нормального парциального давления кислорода в альвеолярном воздухе, т. е. 13,3 кПа или 100 мм рт.ст., 1 л плазмы крови может переносить только 3 мл 02, что недостаточно для жизнедеятельности организма в целом. В покое в организме человека за минуту потребляется примерно 250 мл кислорода. Чтобы тканям получить такое количество кислорода в физически растворенном состоянии, сердце должно перекачивать за минуту огромное количество крови. В эволюции живых существ проблема транспорта кислорода была более эффективно решена за счет обратимой химической реакции с гемоглобином эритроцитов. Кислород переносится кровью от легких к тканям организма молекулами гемоглобина, которые содержатся в эритроцитах.
Гемоглобин способен захватывать кислород из альвеолярного воздуха (соединение называется ок-сигемоглобином) и освобождать необходимое количество кислорода в тканях. Особенностью химической реакции кислорода с гемоглобином является то, что количество связанного кислорода ограничено количеством молекул гемоглобина в эритроцитах крови. Молекула гемоглобина имеет 4 места связывания с кислородом, которые взаимодействуют таким образом, что зависимость между парциальным давлением кислорода и количеством переносимого кислорода с кровью имеет S-образную форму, которая носит название кривой насыщения или диссоциации оксигемоглобина (рис. 10.18). При парциальном давлении кислорода 10 мм рт. ст. насыщение гемоглобина кислородом составляет примерно 10 %, а при Р02 30 мм рт. ст. — 50—60 %. При дальнейшем увеличении парциального давления кислорода от 40 мм рт. ст. до 60 мм рт. ст. происходит уменьшение крутизны кривой диссоциации оксигемоглобина и процент его насыщения кислородом возрастает в диапазоне от 70—75 до 90 % соответственно. Затем кривая диссоциации оксигемоглобина начинает занимать практически горизонтальное положение, поскольку увеличение парциального давления кислорода с 60 до 80 мм рт. ст. вызывает прирост насыщения гемоглобина кислородом на 6 %. В диапазоне от 80 до 100 мм рт. ст. процент образования оксигемоглобина составляет порядка 2. В результате кривая диссоциации оксигемоглобина переходит в горизонтальную линию и процент насыщения гемоглобина кислородом достигает предела, т. е. 100. Насыщение гемоглобина кислородом под влиянием Р02 характеризует своеобразный молекулярный «аппетит» этого соединения к кислороду.
Значительная крутизна кривой насыщения гемоглобина кислородом в диапазоне парциального давления от 20 до 40 мм рт. ст. способствует тому, что в ткани организма значительное количество кислорода может диффундировать из крови в условиях фадиента его парциального давления между кровью и клетками тканей (не менее 20 мм рт. ст.). Незначительный процент насыщения гемоглобина кислородом в диапазоне его парциального давления от 80 до 100 мм рт. ст. способствует тому, что человек без риска снижения насыщения артериальной крови кислородом может перемещаться в диапазоне высот над уровнем моря до 2000 м.
Общие запасы кислорода в организме обусловлены его количеством, находящимся в связанном состоянии с ионами Fe2+ в составе органических молекул гемоглобина эритроцитов и миоглобина мышечных клеток.
Один грамм гемоглобина связывает 1,34 мл 02. Поэтому в норме при концентрации гемоглобина 150 г/л каждые 100 мл крови могут переносить 20,0 мл 02.
Количество 02, которое может связаться с гемоглобином эритроцитов крови при насыщении 100 % его количества, называется кислородной емкостью гемоглобина. Другим показателем дыхательной функции крови является содержание 02 в крови (кислородная емкость крови), которое отражает его истинное количество, как связанного с гемоглобином, так и физически растворенного в плазме. Поскольку в норме артериальная кровь насыщена кислородом на 97 %, то в 100 мл артериальной крови содержится примерно 19,4 мл 02.
Механизмы гипоксии
Noreen R. Henig, David J. Pierson
Статья опубликована в журнале
Respiratory Care Clinics of North America
Volume 6, Number 4, December 2000
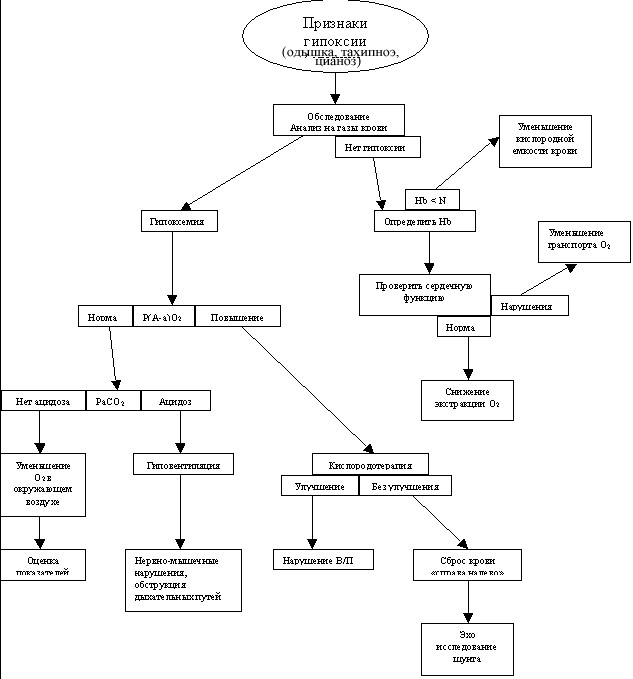
Четырьмя основными механизмами гипоксемии, которые необходимо запомнить каждому студенту медику являются низкий уровень кислорода, гиповентиляция, нарушение соотношения перфузии–вентиляции, сброс крови «справа налево». Если запомнить этот список и понять сами механизмы, то каждый может быстро и легко выявить причину гипоксии у пациента.
Человеческий организм является аэробным. Это значит, что все процессы клеточного метаболизма зависят от уровня молекул кислорода, которые поддерживают основные функции организма. Несмотря на то, что организму необходим кислород, клинически определить субоптимальные потребности очень тяжело и невозможно подсчитать. У пациентов с недостаточной оксигенацией могут наблюдаться цианоз, одышка, сердцебиение, потеря сознания, парестезии, усиление диуреза, гипотермия или боль. pH крови может быть понижен, а уровень лактата повышен в результате анаэробного метаболизма. Все или ни одного из этих признаков могут присутствовать, однако это дело лечащего врача подозревать гипоксию и выявлять ее причину.
В этой статье авторы обсуждают определение гипоксемии, обозревают анатомию легочной системы и этапы доставки кислорода и описывают четыре основные причины гипоксемии с примерами из практики. В заключении будет описан пятый механизм гипоксии, который у человека встречается очень редко. Вследствие того, что поместить кислород в кровоток человека это еще только полдела, авторы описали еще и механизм гипоксии тканей при адекватном обмене кислорода в легких.
Гипоксемия против гипоксии
Гипоксемия – это состояние, при котором парциальное давление кислорода в артериальной крови (РаО2) меньше нормального (менее 60 мм рт. ст.). Если пациент, дышит кислородом, но РаО2 у него ниже, чем ожидается, то необходимо исключить гипоксемию, даже если уровень РаО2 выше 60 мм рт. ст. Гипоксемия возникает вследствие непопадания кислорода в кровь. Гипоксия тканей возникает вследствие того, что клеткам не хватает кислорода для выполнения функции метаболизма. Хотя гипоксемия (слишком маленькое поступление кислорода в кровь) обычно является причиной гипоксии тканей, существуют другие состояния, которые прерывают поступление кислорода в кровь и приводят к гипоксии.
Для того чтобы понять обстоятельства, которые приводят к гипоксемии или гипоксии, необходимо представить путь, который проходят молекулы кислорода из воздуха в ткани, где они используются как топливо для клеток. Во время спонтанного дыхания мозг генерирует сигнал, который ведет к сокращению диафрагмы и расширению грудной клетки. При этом создается отрицательное давление в грудной полости, вследствие чего воздух проникает по дыхательным путям в альвеолы. Молекулы кислорода диффундируют через стенку альвеол в капилляры. В крови большинство кислорода переносится гемоглобином в эритроцитах, в то время как небольшой процент растворяется в плазме. Кровь перекачивается через легкие из правого желудочка сердца и после этого возвращается в левое предсердие и желудочек для того, чтобы оттуда разойтись по телу. По ходу того, как артерии разделяются на более мелкие капилляры, кислород освобождается из гемоглобина и поступает в ткани для питания клеток. Углекислый газ, который является продуктом клеточного метаболизма, диффундирует из тканей в капилляры и проходит по венозной системе в правое сердце. Кровь, насыщенная углекислым газом, проходит в легкие. Таким образом, углекислый газ может диффундировать через альвеолярно–капиллярный барьер, чтобы выйти из организма во время выдоха.
 |
| Рисунок 1. |
Таблица 1. Механизмы гипоксии
Гипоксемия с нормальным Р(А-а)О2
Гипоксемия с увеличением Р(А-а)О2
Гипоксия тканей без гипоксемии
Механизмы гипоксемии
Уменьшение кислорода в окружающем воздухе
Неадекватный транспорт кислорода
Если кислород попал в кровь и связался с гемоглобином, то доставка кислорода к тканям начинает зависеть от сердечного выброса. Отношение сердечного выброса (Qt) и транспорта кислорода (DO2) показано в таблице 2. Уменьшение сердечного выброса может привести к внутренней сердечной дисфункции или внешним сердечным нарушениям. В результате уменьшения или нарушения сердечного выброса развивается гипоксия тканей.
Внутренняя сердечная дисфункция
Первичные заболевания сердца зачастую возникают вследствие патологии коронарных сосудов и ишемической кардиомиопатии. Однако гипертензия, патология клапанов сердца, нарушения ритма и кардиомиопатии неишемической этиологии (алкоголь, вирус) также играют большую роль в дисфункции сердца. У пациентов с признаками гипоксии, при нормальном анализе крови на содержание кислорода, сердечная дисфункция является наиболее частой причиной данного состояния. Хотя при сердечной дисфункции чаще всего пациента госпитализируют, скрытые заболевания сердца часто обостряют основную причину заболевания. Сепсис может ухудшить тканевую гипоксию, связанную с гипотонией. Пациентам необходимо выполнить эхокардиографию, коронарную ангиографию, провести функциональные исследования, такие как стресс тест при подозрении на первичную патологию сердца.
Внешние сердечные нарушения
Неадекватная периферическая экстракция кислорода
Даже если кислород полностью связался с гемоглобином и был доставлен к тканям, то существует два обстоятельства, при которых нарушается утилизация кислорода клетками. Первым является тот факт, что кислород может быть сильно связан с гемоглобином, что препятствует переходу в ткани. Вторым является обстоятельство, при котором происходит интоксикация митохондрий, с помощью которых в клетке происходят процессы метаболизма.
Сродство гемоглобина к кислороду
Сродство гемоглобина к кислороду определяется по форме и позиции кривой диссоциации оксигемоглобина (рис. 6).
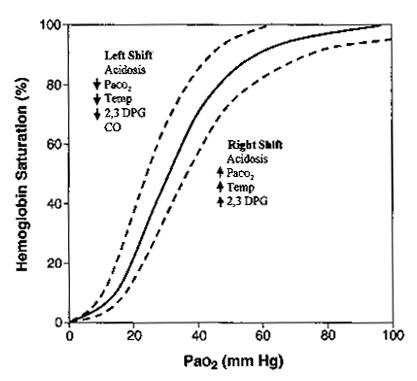 |
| Рисунок 6. Кривая диссоциации гемоглобина. Данная кривая показывает взаимоотношение РаО2 (по горизонтальной оси) с сатурацией гемоглобина (вертикальная ось). Существуют несколько факторов, которые влияют на способность гемоглобина связываться с кислородом. Кривая будет смещаться вправо, указывая на уменьшение связывания кислорода в легких или облегчение отдачи кислорода тканям. Данная картина встречается при ацидозе, гиперкапнии, гипертермии, повышения 2,3-дифосфоглицерата (2,3-ДФГ). Кривая будет отклоняться влево, увеличивая насыщение кислорода в легких и уменьшая отдачу кислорода тканям. Это встречается при алкалозе, гипокапнии, гипотермии, уменьшении 2,3-ДФГ, отравлении угарным газом. |
Когда кривая смещается вправо, сродство снижается и кислорода на грамм гемоглобина становится меньше, хотя на периферии кислород отсоединяется более легко. Когда кривая смещается влево и кверху сродство к кислороду увеличивается. Больше кислорода захватывается в легких где показатель РаО2 высокий, но на уровне тканей, где РаО2 низкий количество доступного кислорода снижается. Алкалоз, гипотермия, гипокапния, уменьшение 2,3-ДФГ приводят к сдвигу кривой влево. При переливании цельной крови происходит уменьшение 2,3-ДФГ, тем самым выражается вредное действие массивных гемотрансфузий. Так как 2,3-ДФГ вырабатывается эритроцитами, эффект обычно кратковременный. Угарный газ не сдвигает кривую влево, но занимает гемоглобиновые мостики и тем самым приводит к гипоксии.
Интоксикация митохондрий
Заключение
Существует большое количество заболеваний, которые могут закончиться гипоксемией. Гипоксемия возникает вследствие одного из этих факторов: снижение кислорода в окружающем воздухе, гиповентиляции, нарушения В/П, сброса крови «справа налево». При обследовании пациента необходимо установить действительно ли у него есть гипоксемия и если это так то необходимо определить Р(А-а)О2. Таким образом, определив газовый состав крови можно провести дифференциальный диагноз и правильно оценить ситуацию. Важно также запомнить, что при подключении более одного механизма необходимо снова и снова оценивать состояние пациента.
Что переносит кислород в организме
10.1. Классификация гипоксических состояний
Гипоксия – типовой патологический процесс, характеризующийся снижением содержания кислорода в крови (гипоксемией) и тканях, развитием комплекса вторичных неспецифических метаболических и функциональных расстройств, а также реакцией адаптации.
Первая классификация гипоксических состояний была предложена Баркрофтом (1925), а затем дополнена и усовершенствована И.Р. Петровым (1949). Классификация И.Р. Петрова используется и в наше время. Согласно этой классификации различают гипоксии экзогенного и эндогенного происхождения.
В основе гипоксии экзогенного происхождения лежит недостаток кислорода во вдыхаемом воздухе, в связи с чем выделяют нормобарическую и гипобарическую гипоксию. К гипоксиям эндогенного происхождения относятся следующие типы:
а) дыхательная (респираторная); б) сердечно-сосудистая (циркуляторная); в) гемическая (кровяная); г) тканевая (гистотоксическая); д) смешанная.
По течению различают:
• молниеносную (в течение нескольких секунд, например, при разгерметизации летательных аппаратов на большой высоте);
• острую (которая развивается через несколько минут или в пределах часа в результате острой кровопотери, острой сердечной или дыхательной недостаточности, при отравлении угарным газом, цианидами, при шоке, коллапсе);
• подострую (она формируется в течение нескольких часов при попадании в организм метгемоглобинообразователей, таких как нитраты, бензол, а в ряде случаев в результате медленно нарастающей дыхательной или сердечной недостаточности;
• хроническую гипоксию, которая возникает при дыхательной и сердечной недостаточности и других формах патологии, а также при хронической анемии, пребывании в шахтах, колодцах, при работе в водолазных и защитных костюмах.
а) местную (локальную) гипоксию, развивающуюся при ишемии, венозной гиперемии, престазе и стазе в зоне воспаления;
б) общую (системную) гипоксию, которая наблюдается при гиповолемии, сердечной недостаточности, шоке, коллапсе, ДВС-синдроме, анемиях.
Известно, что наиболее устойчивыми к гипоксии являются кости, хрящи и сухожилия, которые сохраняют нормальную структуру и жизнеспособность в течение многих часов при полном прекращении снабжения кислородом. Поперечно-полосатые мышцы выдерживают гипоксию в течение 2 часов; почки, печень – 20-30 минут. Наиболее чувствительна к гипоксии кора головного мозга.
10.2. Общая характеристика этиологических и патогенетических факторов гипоксий экзогенного и эндогенного происхождения
Экзогенный тип гипоксии развивается при уменьшении парциального давления кислорода в воздухе, поступающем в организм. При нормальном барометрическом давлении говорят о нормобарической экзогенной гипоксии (примером может служить нахождение в замкнутых помещениях малого объема). При снижении барометрического давления развивается гипобарическая экзогенная гипоксия (последнее наблюдается при подъеме на высоту, где РО2 воздуха снижено примерно до 100 мм рт. ст. Установлено, что при снижении РО2 до 50 мм рт. ст. возникают тяжелые расстройства, несовместимые с жизнью).
В ответ на изменение показателей газового состава крови (гипоксемию и гиперкапнию) возбуждаются хеморецепторы аорты, каротидных клубочков, центральные хеморецепторы, что вызывает стимуляцию бульбарного дыхательного центра, развитие тахи- и гиперпное, газового алкалоза, увеличение числа функционирующих альвеол.
Эндогенные гипоксические состояния являются в большинстве случаев результатом патологических процессов и болезней, приводящих к нарушению газообмена в легких, недостаточному транспорту кислорода к органам или к нарушению его утилизации тканями.
Дыхательная (респираторная) гипоксия
Респираторная гипоксия возникает вследствие недостаточности газообмена в легких, которая может быть обусловлена следующими причинами: альвеолярной гиповентиляцией, сниженной перфузией кровью легких, нарушением диффузии кислорода через аэрогематический барьер, и соответственно, нарушением вентиляционно-перфузионного соотношения. Патогенетическую основу дыхательной гипоксии составляют снижение содержания оксигемоглобина, повышение концентрации восстановленного гемоглобина, гиперкапния и газовый ацидоз.
Гиповентиляция легких является результатом действия ряда патогенетических факторов:
а) нарушения биомеханических свойств дыхательного аппарата при обструктивных и рестриктивных формах патологии;
б) расстройств нервной и гуморальной регуляции вентиляции легких;
в) снижения перфузии легких кровью и нарушения диффузии О2 через аэрогематический барьер;
г) избыточного внутри- и внелегочного шунтирования венозной крови.
Циркуляторная (сердечно-сосудистая, гемодинамическая) гипоксия развивается при локальных, региональных и системных нарушениях гемодинамики. В зависимости от механизмов развития циркуляторной гипоксии можно выделить ишемическую и застойную формы. В основе циркуляторной гипоксии может лежать абсолютная недостаточность кровообращения или относительная при резком возрастании потребности тканей в кислородном обеспечении (при стрессорных ситуациях).
Генерализованная циркуляторная гипоксия возникает при сердечной недостаточности, шоке, коллапсе, обезвоживании организма, ДВС-синд-роме и т.д., причем, если нарушения гемодинамики возникают в большом круге кровообращения, насыщение крови кислородом в легких может быть нормальным, а нарушается его доставка к тканям в связи с развитием венозной гиперемии и застойных явлений в большом круге кровообращения. При нарушениях гемодинамики в сосудах малого круга кровообращения страдает оксигенация артериальной крови. Локальная циркуляторная гипоксия возникает в зоне тромбоза, эмболии, ишемии, венозной гиперемии в тех или иных органах и тканях.
Особое место занимает гипоксия, связанная с нарушением транспорта кислорода в клетки при снижении проницаемости мембран для О2. Последнее наблюдается при интерстициальном отеке легких, внутриклеточной гипергидратации.
Для циркуляторной гипоксии характерны: снижение РаО2, увеличение утилизации О2 тканями вследствие замедления кровотока и активации системы цитохром, возрастание уровня ионов водорода и углекислого газа в тканях. Нарушение газового состава крови приводит к рефлекторной активации дыхательного центра, развитию гиперпноэ, увеличению скорости диссоциации оксигемоглобина в тканях.
Гемический (кровяной) тип гипоксии возникает в результате уменьшения эффективной кислородной емкости крови и, следовательно, ее кислород транспортирующей функции. Транспорт кислорода от легких к тканям почти полностью осуществляется при участии Hb. Главными звеньями снижения кислородной емкости крови являются:
1) уменьшение содержания Нb в единице объема крови и в полном объеме, например, при выраженных анемиях, обусловленных нарушением костно-мозгового кроветворения различного генеза, при постгеморрагических и гемолитической анемиях.
2) нарушение транспортных свойств Нb, которое может быть обусловлено либо снижением способности Нb эритроцитов связывать кислород в капиллярах легких, либо транспортировать и отдавать оптимальное количество его в тканях, что наблюдается при наследственных и приобретенных гемоглобинопатиях.
Достаточно часто гемическая гипоксия наблюдается при отравлении окисью углерода («угарным газом»), так как окись углерода обладает чрезвычайно высоким сродством к гемоглобину, почти в 300 раз превосходя сродство к нему кислорода. При взаимодействии окиси углерода с гемоглобином крови образуется карбоксигемоглобин, лишенный способности транспортировать и отдавать кислород.
Окись углерода содержится в высокой концентрации в выхлопных газах двигателей внутреннего сгорания, в бытовом газе и т.д.
Выраженные нарушения жизнедеятельности организма развиваются при увеличении содержания в крови НbСО до 50% (от общей концентрации гемоглобина). Повышение его уровня до 70-75 % приводит к тяжелой гипоксемии и летальному исходу.
Карбоксигемоглобин имеет ярко-красный цвет, поэтому при его избыточном образовании в организме кожа и слизистые становятся красными. Устранение СО из вдыхаемого воздуха приводит к диссоциации НbСО, но этот процесс протекает медленно и занимает несколько часов.
Воздействие на организм ряда химических соединений (нитратов, нитритов, окисла азота, бензола, некоторых токсинов инфекционного происхождения, лекарственных средств: феназепама, амидопирина, сульфаниламидов, продуктов ПОЛ и т.д.) приводит к образованию метгемоглобина, который не способен переносить кислород, так как содержит окисную форму железа (Fe3+).
Окисная форма Fe3+ обычно находится в связи с гидроксилом (ОН-). МетНb имеет темно-коричневую окраску и, именно этот оттенок приобретают кровь и ткани организма. Процесс образования метНb носит обратимый характер, однако его восстановление в нормальный гемоглобин происходит относительно медленно (в течение нескольких часов), когда железо Нb вновь переходит в закисную форму. Образование метгемоглобина не только снижает кислородную емкость крови, но и уменьшает способность активного оксигемоглобина диссоциировать с отдачей кислорода тканям.
Тканевая (гистотоксическая) гипоксия развивается вследствие нарушения способности клеток поглощать кислород (при нормальной его доставке к клетке) или в связи с уменьшением эффективности биологического окисления в результате разобщения окисления и фосфорилирования.
Развитие тканевой гипоксии связывают со следующими патогенетическими факторами:
1. Нарушением активности ферментов биологического окисления в процессе:
а) специфического связывания активных центров фермента, например, цианидами и некоторыми антибиотиками;
б) связывания SН-групп белковой части фермента ионами тяжелых металлов (Аg2+, Нg2+, Сu2+), в результате чего образуются неактивные формы фермента;
в) конкурентного блокирования активного центра фермента веществами, имеющими структурную аналогию с естественным субстратом реакции (оксалаты, малонаты).
2. Нарушением синтеза ферментов, которое может возникать при дефиците витаминов В1 (тиамина), ВЗ (РР), никотиновой кислоты и др., а также при кахексии различного происхождения.
3. Отклонениями от оптимума физико-химических параметров внутренней среды организма: рН, температуры, концентрации электролитов и др. Эти изменения возникают при разнообразных заболеваниях и патологических состояниях (гипотермиях и гипертермиях, недостаточности почек, сердца и печени, анемиях) и снижают эффективность биологического окисления.
4. Дезинтеграцией биологических мембран, обусловленной воздействием патогенных факторов инфекционной и неинфекционной природы, сопровождающейся снижением степени сопряжения окисления и фосфорилирования, подавлением образования макроэргических соединений в дыхательной цепи. Способностью разобщать окислительное фосфорилирование и дыхание в митохондриях обладают: избыток ионов Н+ и Са2+, свободных жирных кислот, адреналина, тироксина и трийодтиронина, некоторых лекарственных веществ (дикумарина, грамицидина и др.). В этих условиях увеличиваются расход кислорода тканями. В случаях набухания митохондрий, разобщения окислительного фосфорилирования и дыхания большая часть энергии трансформируется в тепло и не используется для ресинтеза макроергов. Эффективность биологического окисления снижается.
Что переносит кислород в организме
4.1. Транспорт кислорода
В сложных механизмах транспорта газов кровью и газообмена в тканях важная роль отводится эритроцитам, ответственным за доставку О2 к различным органам и удаление образующегося в процессе метаболизма СО2.
Эритроцит – безъядерная клетка, лишенная митохондрий, основным источником энергии для эритроцита служит глюкоза, метаболизируемая в гексозомонофосфатном шунте или цикле Эмбдена-Мейергофа. Транспорт О2 обеспечивается в значительной мере гемоглобином, состоящим из белка глобина и гема. Последний представляет собой комплексное соединение железа и порфирина. Глобин представляет собой тетрамер полипептидной цепи. Hb A (HbA) – основной гемоглобин взрослых содержит 2 – альфа и 2 – бета – цепи, Hb A2 – содержит две альфа и две дельта цепи.
Гем состоит из иона железа, встроенного в порфириновое кольцо. Ион железа гема обратимо связывает одну молекулу О2. С одной молекулой Hb максимально связываются 4 молекулы О2 с образованием оксигемоглобина.
Гем может подвергаться не только оксигенации, но и истинному окислению, когда железо становится из двухвалентного трехвалентным. Окисленный гем носит название гематина, а молекула гемоглобина становится метгемоглобином. В крови человека метгемоглобин находится в незначительных количествах, его уровень резко возрастает при отравлениях. Метгемоглобин не способен отдавать кислород тканям.
В норме метгемоглобин составляет менее 3% общего Hb крови. Основная форма транспорта О2 – в виде оксигемоглобина. Кислород транспортируется артериальной кровью не только в связи с гемоглобином, но и в растворенном виде. Принимая во внимание тот факт, что 1 г Hb может связать 1,34 мл О2, кислородная емкость крови в среднем у взрослого человека составляет около 200 мл/л крови. Одним из показателей кислородного транспорта является насыщение артериальной крови О2(Sa O2), равного отношению О2, связанного с Hb, к кислородной емкости крови:
SaO2=O2, связанного с Hb/O2 емкость крови* 100%.
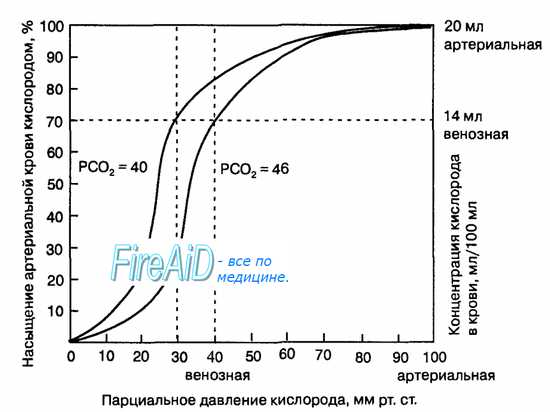
В соответствии с кривой диссоциации оксигемоглобина насыщение артериальной крови кислородом в среднем составляет 97%, в венозной крови – 75%.
PaO2 в артериальной крови около 100 мм. рт. ст., а в венозной – около 40 мм. рт. ст.
Количество растворенного кислорода в крови пропорционально парциальному давлению О2 и коэффициэнту его растворимости.
Последний для О2 составляет 0,0031/100 мл крови/ 1 мм. рт. ст.. Таким образом, 100 мл крови при PaO2, равном 100 мм. рт. ст., содержит менее 0,31 мл O2.
Диссоциация оксигемоглобина в тканях обусловлена главным образом химическими свойствами гемоглобина, а также рядом других факторов – температурой тела, рН среды, р СО2.
При понижении температуры тела наклон кривой диссоциации оксигемоглобина возрастает, а при ее повышении – снижается, и соответственно снижается сродство Hb к О2.
При снижении рН, т.е. при закислении среды, сродство гемоглобина к О2 уменьшается. Увеличение напряжения в крови СО2 также сопровождается снижением сродства Hb к О2 и уплощением кривой диссоциации оксигемоглобина.
Известно, что степень диссоциации оксигемоглобина определяется содержанием в эритроцитах некоторых фосфорорганических соединений, главным из которых является 2,3 – ДФГ (2,3 дифосфоглицерат), а также содержанием в эритроцитах катионов. В случаях развития алкалозов, поглощение О2 в легких увеличивается, но в то же время затрудняется отдача кислорода тканями. При ацидозах наблюдается обратная картина.
4.2.Утилизация кислорода тканями
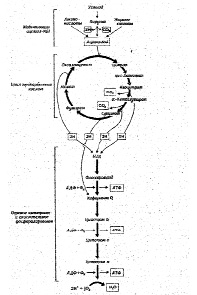
Тканевое или клеточное дыхание включает три стадии. На первой стадии пируват, аминокислоты и жирные кислоты окисляются до двухуглеродных фрагментов ацетильных групп, входящих в состав ацетилкофермента А. Последние на втором этапе окисления включаются в цикл лимонной кислоты, где происходит образование высокоэнергетических атомов водорода и высвобождение СО2 – конечного продукта окисления органических субстратов. На третьей стадии клеточного дыхания атомы водорода делятся на протоны (Н+) и «высокоэнергетические» электроны, передающиеся по дыхательной цепи на молекулярный О2 и восстанавливающие его до НО2. Перенос электронов сопряжен с запасом энергии в форме АТФ, т.е. с окислительным фосфорилированием (рис.6).
Касаясь патогенеза метаболических сдвигов, свойственных гипоксическим состояниям, следует отметить, что в организме человека более 90% всего потребляемого кислорода восстанавливается с участием цитохромоксидазы митохондрий, и лишь около 10% кислорода метаболизируется в тканях с участием оксигеназ: диоксигеназы и монооксигеназы.
Рис.6. Схема тканевого дыхания. Конечные продукты каждой стадии даны в рамке (Ленинджер А., 1999)
Наиболее многочисленны и сложны монооксигеназные реакции, протекающие в эндоплазматическом ретикулуме клеток при участии цитохрома Р-450 и обеспечивающие гидроксилирование субстрата (стероидных гормонов, лекарственных препаратов и различных др. соединений) и, как правило, его инактивацию.
Диоксигеназы катализируют реакции, в которых в молекулу органического субстрата включаются оба атома молекулы кислорода (например, реакция окисления катехола молекулярным кислородом с раскрытием кольца).
В реакциях, связанных с переносом электронов, т.е. в реакциях окисления-восстановления, где, как указывалось выше, используется более 90% потребляемого кислорода, атомы водорода, отщепленные дегидрогеназами от субстратов в цикле лимонной кислоты, передают свои электроны в цепь переноса электронов и превращаются также в Н +. Как известно, помимо 4 пар атомов водорода, поставляемых каждым оборотом цикла лимонной кислоты, образуются и другие атомы водорода, отщепленные дегидрогеназами от пирувата, жирных кислот и аминокислот в процессе их расщепления до Ацетил-СоА и других продуктов.
Таким образом, все атомы водорода, отщепляемые дегидрогеназами от субстратов, передают свои электроны в дыхательную цепь к конечному акцептору электронов – кислороду.
Скорость утилизации О2 в различных тканях различна. В среднем взрослый человек потребляет 250 мл О2 в 1 мин. Максимальное извлечение О2 из притекающей артериальной крови свойственно миокарду.
Кислород используется в клетках, в основном в метаболизме белков, жиров, углеводов, ксенобиотиков, в окислительно-восстановительных реакциях в различных субклеточных фракциях: в митохондриях, в эндоплазматическом ретикулуме, в реакциях липопероксидации, а также в межклеточном матриксе и в биологических жидкостях.
Коэффициент утилизации О2 в тканях равен отношению потребления О2 к интенсивности его доставки, широко варьирует в различных органах и тканях.
В условиях нормы минимальную потребность в О2 проявляют почки и селезенка, а максимальную потребность – кора головного мозга, миокард и скелетные мышцы, где коэффициент утилизации О2 колеблется от 0,4 до 0,6, а в миокарде до 0,7. При крайне интенсивной физической работе коэффициент утилизации О2 мышцами и миокардом может возрастать до 0,9.
Обмен дыхательных газов в тканях происходит в процессе свободной и облегченной диффузии. При этом О2 переносится по градиенту напряжения газа из эритроцитов и плазмы крови в окружающие ткани.
Одновременно происходит диффузия СО2 из тканей в кровь. На выход О2 из крови в ткани влияет диссоциация оксигемоглобина в эритроцитах, что обеспечивает так называемую облегченную диффузию О2. Интенсивность диффузионного потока О2 и СО2 определяется градиентом их напряжения между кровью и тканями, а также площадью газообмена, плотностью капилляров, распределением кровотока в микроциркуляторном русле. Интенсивность окислительных процессов в тканях определяется величиной критического напряжения О2 в митохондриях, которое в условиях нормы должно превосходить 0,1-1 мм рт. ст.
Соответствие доставки О2 к органам и тканям, возросшим потребностям в оксигенации обеспечивается на клеточном, органном уровнях за счет образования метаболитов изнашивания, а также при участии нервных, гормональных и гуморальных влияний.
Основная масса углекислого газа (СО2) образуется в организме как конечный продукт различных метаболических реакций и транспортируется к легким с кровью. Вдыхаемый воздух содержит лишь незначительное количество СО2.
Транспорт СО2 кровью осуществляется в 3-х состояниях: в виде аниона бикарбоната, в растворенной форме и в виде карбаминовых соединений.
СО2 хорошо растворяется в плазме крови и в артериальной крови, около 5% от общей двуокиси углерода содержится в крови в растворенной форме.
Третьей формой транспорта СО2 кровью являются карбаминовые соединения, образованные взаимодействием СО2 с концевыми группами белков крови преимущественно с гемоглобином:
Карбаминовые соединения составляют около 5% от общего количества СО2, транспортируемого кровью.
В оксигенированной артериальной крови напряжение СО2 составляет 40 мм. рт. ст., а в венозной крови Рv СО2 равно 46 мм. рт. ст.
4.4.Связывание гемоглобина с окисью углерода