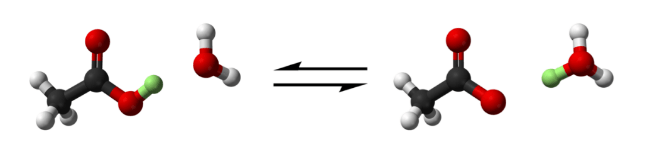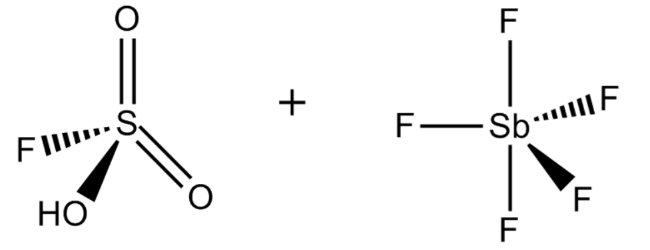что сильнее лимонная или щавелевая кислота
Как выбирать бытовую химию
Для мытья посуды
Главные активные вещества в таких средствах – ПАВ, или поверхностно-активные вещества и регуляторы pH (уровень кислотности важен, чтобы кожа рук не сохла и не трескалась). Также в составе могут быть красители, глицерин и отдушки. В некоторые средства добавляют консерванты и антисептики. Даже после третьего полоскания водой на посуде остается от 5 до 15% моющего средства. Поэтому важно внимательно читать, что написано на этикетках. Обращайте внимание на ПАВ, они бывают трех основных типов: анионные, катионные и неионные. По некоторым данным, анионные ПАВ могут нарушать работу иммунной системы организма и снижать выработку некоторых ферментов. Самыми безопасными на сегодня считаются неионные ПАВ растительного происхождения – произведенные из отрубей или соломы.
Что до эко-средств, не всегда стоит им безоглядно доверять. Надпись «эко» на бутылке ничего не гарантирует и ни к чему производителя не обязывает: в России до сих пор не существует собственной системы эко-сертификации.
Для стирки белья
В порошке главное – ПАВ и фосфаты. Фосфаты регулируют кислотность и смягчают воду, что улучшает качество стирки. К этим веществам в обществе накопилось много вопросов. Доказан их вред – правда, не для человека непосредственно, а для окружающей среды. Поэтому во многих странах Европы применение фосфатов в порошках ограничено. В качестве безопасной альтернативы используют цеолиты. По своей химической сути они похожи на песок, ракушки или стекло. Отстирывают белье порошки с цеолитами несколько хуже, и чтобы повысить качество стирки, рекомендуется стирать в горячей воде. Зато цеолиты безвредны и для природы, и для человека.
Для мытья унитазов
Как любила повторять одна свекровь одной невестке, «унитаз – лицо хозяйки». Чтобы это «лицо» всегда сияло, понадобятся средства с кислотами. Чаще всего в средства для чистки унитазов добавляют соляную кислоту в сочетании с нейтральными или амфотерными ПАВ (они дополняют ее действие, плюс не дают средству стечь, не выполнив стратегических задач). В менее агрессивных средствах главным действующим веществом могут быть органические кислоты – щавелевая или лимонная. Для отбеливающего эффекта в средство добавляют гипохлорит натрия – ту самую хлорку. Гипохлорит натрия распадается в воде с выделением атомарного, очень активного кислорода. Кислород как раз и дает отбеливающий эффект – окисляет окрашенные вещества, делает их бесцветными. В процессе выделяется некоторое количество хлора – он ядовит, но выделяется в минимальных количествах. Однако дышать этим все равно не стоит. Гораздо безопаснее в этом плане средства с перекисью водорода. Она разлагается на воду и кислород и при этом прекрасно отбеливает поверхности.
Для удаления известкового налета
Вода в наших домах обычно жесткая, поэтому на смесителях и стенках душевой кабины быстро образуются потеки, которые оттереть не так просто. Здесь понадобятся кислоты в сочетании с ПАВ. Самый лучший вариант средства против извести – с добавлением метансульфокислоты. Это самая сильная из кислот, при этом не слишком едкая, соответственно, достаточно безопасная. Однако при попадании на кожу и слизистые может вызвать ожог. Поэтому нужно работать в перчатках, маске и не вдыхать разбрызганное из пульверизатора средство.
Чаще всего в продаже бывают средства с соляной, щавелевой или лимонной кислотой. Соляная из них будет работать быстрее, но и потенциального вреда от нее больше. А вот щавелевая и лимонная кислоты настолько нетоксичны, что годятся даже для отмывания чайника – правда, потом его необходимо будет промыть 2-3 раза водой. В эко-средствах могут применять винный уксус, но с точки зрения безопасности для здоровья он ничем не отличается от той же лимонной кислоты.
Для удаления жира
Чтобы быстро справиться с жиром на плите или сковородке, нужна щелочь в сочетании в ПАВ, чтобы усилить эффект. Обычно в качестве щелочи добавляют гидроксид натрия. Другие его названия – каустическая сода и едкий натр. Это действительно очень едкое и агрессивное вещество, которое разъедает не только жир, но и руки, слизистые носа и глаз. Также не стоит подобными средствами пытаться отмыть алюминиевую сковороду – гидроксид натрия проест металл. Стекло после длительного контакта с этим веществом (особенно если его подогреть) мутнеет. Так что стеклокерамическую панель после сеанса удаления жира нужно очень хорошо промыть водой, прежде чем начинать на ней что-то готовить. Впрочем, хорошенько промывать – это главное правило использования жироудалителя с гидроксидом натрия. Второе – работать можно только в хорошо проветриваемом помещении (если моете плиту, включите вытяжку), в перчатках и желательно респираторе.
Если вам кажется, что едкий натр в вашем доме – это лишнее, попробуйте более мягкие средства без щелочи, только с ПАВ. Они тоже справляются с жиром, пусть и не так быстро и эффективно.
Плохой хороший запах
С отдушками в моющих средствах стоит быть осторожнее. «Ароматические композиции» могут содержать флататы – соли фалиевой кислоты. Эти вещества уже много лет вызывают ожесточенные споры в ученом мире. Исследователи пока не пришли к однозначному выводу, что фталаты вредны, однако, судя по данным последних исследований, это вполне может оказаться правдой. Так, в Колумбийском университете выяснили, что эти вещества нарушают работу щитовидной железы у девочек. А их австралийские коллеги из Университета Аделаиды обнаружили, что у мужчин с высоким уровнем фталатов в организме, повышаются риски развития диабета и сердечно-сосудистых заболеваний. Конечно, приятно, когда от средства хорошо пахнет. Но запах этот не должен быть слишком интенсивным и слишком «химическим».
Щавелевая кислота: применение и свойства
Применение щавелевой кислоты
Как и любая кислота, щавелевая благодаря своим уникальным свойствам применяется в следующих отраслях промышленности:
— химической (при изготовлении пластмасс, красителей, чернил, пиротехники);
— металлургической (для чистки металлов от коррозии, оксидов, накипи, ржавчины);
— текстильной и кожевенной (как протрава, при покраске шелка и шерсти);
— пчеловодстве (для обработки пчел);
— бытовой химии (входит в состав многих моющих средств 
— аналитической химии (осадитель редкоземельных элементов);
— микроскопии (отбеливатель срезов);
— косметологии (отбеливающий компонент от веснушек);
— медицине и фармакологии;
— деревообрабатывающей.
Важность щавелевой кислоты для организма
Данное химическое соединение в организме человека – это промежуточный продукт, который выделяется с мочой как соли кальция. При нарушении минерального обмена соли данной кислоты принимают участие в образовании камней в мочевом пузыре и почках. Данная органическая кислота, содержащаяся в сырых овощах, очень полезна для нашего организма. Она легко соединяется с кальцием и способствует его усвоению. Щавелевая кислота в отварных овощах негативно сказывается на здоровье, так как она становится неорганической. Это приводит к связыванию кальция, а как результат – к нехватке его в костной ткани, что является причиной ее поражения. Суточное выделение щавелевой кислоты вместе с мочой у взрослого человека составляет 20 мг, у детей до 1, 29 мг/кг.
Меры предосторожности

— работы проводить в специальной лабораторной посуде из стекла. Если лабораторная посуда будет из другого материла, кислота может вступить с ней в реакцию;
— во избежание попадания щавелевой кислоты на кожу, дыхательные пути, слизистые оболочки все исследования следует проводить: в резинотехнических изделиях (сапоги, прорезиненные фартуки, перчатки смотровые, перчатки нитриловые), защитных средствах (противогаз или респиратор, очки), спецодежда;
— во время использования щавелевой кислоты запрещается принимать пищу, пить, курить;
— после завершения работ необходимо лицо и руки тщательно промыть теплой водой с мылом или нейтрализующим средством (раствором питьевой соды);
— запрещается транспортировка и хранение щавелевой кислоты совместно с пищевыми продуктами;
— соблюдать меры противопожарной безопасности, если есть необходимость в использовании нагревательных приборов.
Нужно знать, что щавелевая кислота относится к сильным органическим кислотам, употребление ее в большом количестве может стать причиной раздражения слизистой пищевода, кишечника, желудка, кожи и дыхательных путей. При попадании данного химического реактива в организм может появиться жжение, кровавая рвота. Первая помощь в таких ситуациях – обильно промыть водой пораженный участок кожи. Хранить кислоту нужно в закрытой полиэтиленовой упаковке в хорошо вентилируемом помещении на поддонах.
Щавелевую кислоту купить
Щавелевую кислоту купить, борную кислоту купить, лимонную кислоту купить, молочную кислоту купить, как и любой другой химический реактив, можно в магазине химических реактивов Москва розница и опт «Прайм Кемикалс Групп». На нашем сайте есть все, что нужно современной научной или производственной лаборатории. Покупая любой товар в нашем интернет-магазине, вы приобретаете товар c сертификатом качества, отвечающий всем стандартам ГОСТ по доступным ценам и исключаете возможность покупки подделки.
“Prime Chemicals Group” – гарантия качества предлагаемой продукции.
Щавелевую кислоту купить с доставкой по городу и области можно Выгодно!
8 сильнейших кислот, известных нам
Что делает кислоту сильной или слабой? Чтобы ответить на этот вопрос, нам сначала нужно взглянуть на определение кислоты. Это химическое соединение, которое принимает электроны и / или отдает (диссоциирует) ионы водорода, также известные как протоны.
Следовательно, уровни кислотности кислоты зависят от ее способности диссоциировать ионы водорода, т.е. чем больше число ионов водорода, продуцируемых кислотой в растворе, тем более кислым он является. Теперь, прежде чем мы перейдем к списку сильнейших кислот на Земле, есть определенные термины и определения, с которыми вам необходимо ознакомиться.
Это подводит нас к другому связанному и важному показателю кислотности pKa. Это в основном отрицательный целочисленный логарифм Ka.
Чем сильнее кислота, тем ниже значения pKa.
Уксусная кислота отдает протон (в зеленом цвете) воде, чтобы произвести ион гидрония и ион ацетата. (Кислород в красном, водород в белом и углерод в черном)
Функция кислотности Гаммета: (H o) Всем нам известна шкала pH, которая обычно используется для измерения уровней кислотности или основности химических веществ, но когда речь идет о суперкислотах, она просто становится бесполезной, поскольку их уровни кислотности в миллион раз больше, чем серная и соляная кислоты.
Таким образом, чтобы измерить суперкислоты на основе их уровней кислотности, исследователи придумали функцию кислотности Гаммета. Первоначально он был предложен американским физическим химиком Луи Плаком Гаммет.
8. Серная кислота
Серная кислота (98%) на листе бумаги
Серная кислота или купорос не нуждаются в формальном введении. Он не имеет запаха, цвета и вызывает интенсивную экзотермическую реакцию при смешивании с водой. Серная кислота является важным химическим веществом, которое необходимо для многих отраслей промышленности, таких как сельское хозяйство, очистка сточных вод и нефтепереработка. Она также используется в кислотах аккумулятора и чистящих средствах.
Она также играет важную роль в изучении кислот в целом. Серная кислота служит базовым эталоном для сравнения уровней кислотности суперкислот или кислот. Хотя существует несколько способов получения серной кислоты, обычно используют контактный процесс и влажный процесс серной кислоты.
H 2 SO 4 может нанести значительный ущерб коже человека при прямом контакте. Это также очень разъедает многие металлы. Химическое вещество гораздо более агрессивно и опасно, когда присутствует в высокой концентрации, благодаря своим превосходным окислительным и дегидратирующим свойствам.
7. Соляная кислота
Подобно серной кислоте, соляная кислота также является важным химическим веществом, которое широко используется в лабораториях и различных отраслях промышленности. Соляная кислота была обнаружена где-то около 800 г. н.э. иранским ученым-эрудитом по имени Джабир ибн Хайян.
Те, кто задаются вопросом, почему соляная кислота сильнее серной кислоты, несмотря на то, что последняя является контрольной точкой для суперкислот, причина этого заключается в том, что серная кислота является дипротоновой кислотой, которая обычно не полностью диссоциирует.
Другими словами, HCl сильнее серной кислоты, поскольку ее ионы водорода (HCl) легко отделяются от хлорида по сравнению с сульфат-ионом из серной кислоты. Так или иначе, соляная кислота в основном используется в тяжелой промышленности для удаления ржавчины с железа и стали перед дальнейшей обработкой. Кроме того, это жизненно важный компонент в производстве органических (винилхлорид используется для ПВХ) и многих неорганических соединений.
6. Трифторметансульфоновая кислота
Трифликовая кислота используется во многих протонированиях и титрованиях (количественный анализ химического состава). Важная причина, по которой трифликовая кислота является предпочтительной в определенных случаях, заключается в том, что она не сульфонирует другие вещества, что характерно для хлорсульфоновой кислоты и серной кислоты.
Излишне говорить, что это чрезвычайно опасно. Любой контакт кожи с кислотой может вызвать серьезные ожоги и может привести к незначительному повреждению тканей. Это может также вызвать отек легких и судороги и другие критические условия при вдыхании.
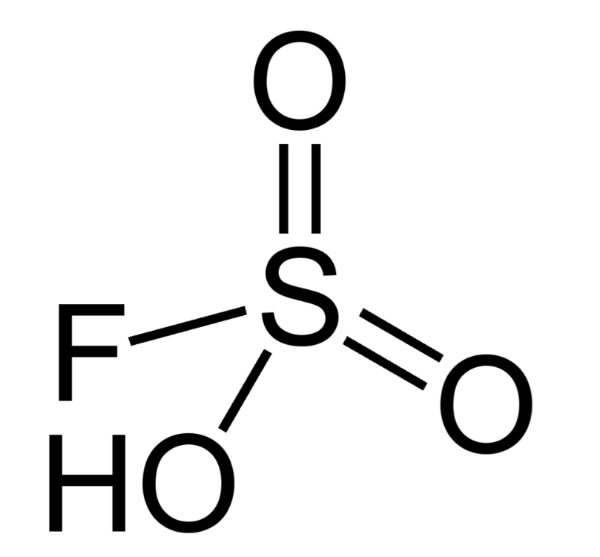
5. Фторсульфоновая кислота
Фторосерная кислота или серно-фтористоводородная кислота (официальное название) является второй сильнейшей однокомпонентной кислотой, доступной сегодня. Это желтый на вид и, конечно, очень едкий / токсичный. HSO 3 F обычно получают путем взаимодействия фтористого водорода с триоксидом серы, и в сочетании с пентафторидом сурьмы он образует «волшебную кислоту», гораздо более сильную кислоту и протонирующий агент.
Кислота может быть использована для алкилирования углеводородов (с алкенами) и изомеризации алканов, а также для травления стекла (художественное стекло). Это обычный фторирующий агент в лабораториях.
4. Хлорная кислота
Хлорная кислота является одной из самых сильных кислот Бренстеда-Лоури, которые обладают сильными окислительными свойствами и обладают высокой коррозионной активностью. Традиционно ее получают обработкой перхлората натрия соляной кислотой (HCl), которая также создает хлорид натрия.
NaClO4 + HCl → NaCl + HClO4
В отличие от других кислот, хлорная кислота не подвержена гидролизу. Это также одна из самых регулируемых кислот в мире. Еще в 1947 году в Лос-Анджелесе, штат Калифорния, около 150 человек получили ранения и 17 человек погибли в результате химического взрыва, в котором содержалось почти 75% хлорной кислоты (по объему) и 25% ангидрида уксусной кислоты. Также было повреждено более 250 близлежащих зданий и транспортных средств.
Несмотря на взрывную природу, хлорная кислота широко используется и даже предпочтительна в некоторых типах синтеза. Это также важный компонент перхлората аммония, который используется в современном ракетном топливе.
3. Фторированная карборановая кислота
Общая структура карбоновой кислоты
Одним из таких членов этой группы является фторированная карборановая кислота. Хотя о существовании такого химического вещества первоначально сообщалось в 2007 году, исследователи смогли в полной мере изучить его природу только в 2013 году. До его открытия корона сильнейшей кислоты Бренстеда перешла к сильно хлорированной версии этого семейства суперкислот.
Фторированный карборан является единственной известной кислотой, которая может протонировать (переносить ион водорода) диоксид углерода с образованием катионов, соединенных водородом. В отличие от этого, CO 2 не подвергается какой-либо заметной протонации при обработке другими суперкислотами, такими как магическая кислота и HF-SbF5.
2. Волшебная кислота
FSO 3 H · SbF 5, наиболее известный как магическая кислота, получают смешением фторсерной кислоты и пентафторида сурьмы в молярном соотношении 1: 1. Эта сверхкислотная система была впервые разработана в 1966 году исследователями из лаборатории Джорджа Олаха, Университета Case Western Reserve в Огайо.
Его довольно причудливое название было установлено после официального события в 1966 году, когда сотрудник лаборатории Олаха продемонстрировал протонирование углеводородов, в котором парафиновая свеча «волшебным образом» растворилась и превратилась в раствор трет-бутильного катиона после того, как она была помещена в то, что сейчас известно как волшебная кислота.
Хотя Волшебная кислота обычно используется для стабилизации ионов углерода в растворах, она имеет несколько других важных промышленных применений. Например, он может ускорить изомеризацию насыщенных углеводородов и даже протоната метана, ксенона и галогенов, которые все являются слабыми основаниями.
1. Фтороантимоновая кислота
Фторантимоновая кислота является, пожалуй, самой сильной из всех известных суперкислот, основанных на значениях функции кислотности Гаммета. Его получают путем смешивания фтористого водорода с пентафторидом сурьмы, как правило, в соотношении 2: 1. Эта реакция носит экзотермический характер.
Этот суперкислота имеет несколько важных применений в химическом машиностроении и нефтехимической промышленности. Например, его можно использовать для отделения метана и Н 2 от неопентана и изобутана (оба алкана) соответственно.
Неудивительно, что H 2 FSbF 6 чрезвычайно агрессивен и может подвергаться сильному гидролизу при контакте с водой. Как и большинство суперкислот, фторантимоновая кислота может питаться прямо через стекло, поэтому она должна храниться в контейнерах из политетрафторэтилена.
Теперь, большинство из вас, возможно, наткнулись на карбоновые кислоты (либо хлорированная карбоновая кислота, либо фторированная карборановая кислота), когда искали «самые сильные кислоты в мире». Ну, технически они верны, так как карбоновые кислоты являются самыми сильными известными однокомпонентными кислотами на Земле, гораздо более кислыми, чем подобные хлорной и трифликовой кислотам (фтороантимоновая кислота на самом деле является смешанной кислотой).
Пищевые кислоты: виды, характеристика, производство и применение
Кислоты в пищевой промышленности применяются для консервации и придания кондитерским продуктам, напиткам и консервам приятного кисловатого вкуса. Все органические кислоты, допущенные к производству пищевых продуктов, безопасны для здоровья.
Общая характеристика и свойства
Пищевые кислоты — это довольно обширное понятие, которое объединяет вещества неорганической и органической природы. Все они имеют различные свойства и применяются в пищевой промышленности в качестве добавок, регулирующих те или иные качества производимой продукции.

К пищевым относят следующие кислоты:
Большинство из них получают путем переработки различного растительного сырья. Во фруктах и ягодах кислоты могут содержаться не только в чистом виде, но и в форме растворимых солей.
Однако если пищевые кислоты сами по себе не несут вреда для организма, то различные примеси, содержащиеся в них, могут серьезно навредить. Поэтому существуют строгие требования, ограничивающие количество солей тяжелых металлов, свободных соляной и серной кислот, а также мышьяка в составе органической кислоты.
Лимонная кислота
Лимонная кислота — одна из самых распространенных добавок в пищевой промышленности. Это довольно слабая кислота, изначально получаемая путем переработки недозревших лимонов и стеблей махорки. В настоящее время ее научились синтезировать из сахарозы.
Лимонную кислоту в качестве консерванта используют для производства плавленых сыров, в сочетании с содой — как разрыхлитель теста при изготовлении кондитерских изделий, в роли усилителя вкуса — в винно-водочной промышленности и в безалкогольных напитках, как фиксатор цвета — в колбасном производстве.
При неосторожном обращении эта пищевая кислота может вызвать ожог слизистых оболочек, кожи или дыхательных путей.
Уксусная кислота
Второй по популярности кислотой, используемой в промышленности и домашнем хозяйстве, является уксусная. Это одно из веществ, известное человеку еще с древности, вероятнее всего, было обнаружено совершенно случайно в скисшем вине.
Эта пищевая кислота получается в результате реакции брожения в винах, соках, а также водных растворах спиртов. В пищевой промышленности уксусная кислота имеет индекс Е 260 и используется для приготовления маринадов и консервации. Она также эффективно показала себя в качестве средства против накипи и известкового налета.
Уксусная кислота бывает разных концентраций. Наиболее распространенные виды – 80 % эссенция и 3–9 % столовый уксус.
Щавелевая кислота
Безобидная, если судить по названию, щавелевая кислота на самом деле — токсичное вещество, используемое в металлургии, химической и деревоперерабатывающей промышленности, бытовой химии и косметологии.
В естественном виде она содержится в таких растениях, как щавель, шпинат, карамбола и ревень. Однако для промышленных нужд ее получают путем окисления углеводов, гликолей и спиртов.
Применение щавелевой кислоты достаточно широко. Она может использоваться для очищения различных металлов от коррозии, входит в состав порошков и моющих средств, применяется при изготовлении пластмасс и пиротехники. В косметологии является составной частью отбеливающих смесей, например, для удаления веснушек.
Щавелевая кислота — токсичное, горючее вещество. При работе с ней необходима резиновая защита — сапоги, перчатки, очки, прорезиненные фартуки и респираторы.
Виннокаменная кислота
Виннокаменная или винная кислота — вещество, содержащееся во фруктах и ягодах. Особенно много ее присутствует в винограде, вишне, черешне, бруснике, смородине, гранате и айве. Для промышленных нужд винную кислоту, имеющую название Е 334, добывают путем добавления в яблочный ангидрид перекиси водорода. Существует и второй способ — ферментативное воздействие на янтарную кислоту.
Винная кислота является безопасной для человека добавкой. Она обладает высокими антиокислительными свойствами, что делает актуальным ее применение при производстве продуктов питания длительного хранения, например, соков, желе, вареньях, джемах, безалкогольных газированных напитках.
Яблочная кислота
Яблочная (оксиянтарная) кислота или пищевая добавка Е 296. Это вещество добывается путем сбраживания свежевыжатого сока различных ягодно-плодовых культур. Особенно богаты на нее незрелые яблоки, малина, виноград, апельсины, барбарис, лимон и рябина.
Употребление яблочной кислоты способствует улучшению работы желудочно-кишечного тракта, ускорению обмена веществ, заживлению ран, снятию усталости. Несмотря на то что верхняя граница нормы потребления оксиянтарной кислоты не установлена, врачи и диетологи не рекомендуют есть больше 3–4 яблок в день.
Благодаря своим антиоксидантным свойствам, добавка Е 296 широко используется в пищевой промышленности, медицине, фармакологии и косметологии. В качестве консерванта ее применяют при изготовлении мармелада, пастилы, желе, в молочных фруктовых напитках.
Ортофосфорная кислота
Ортофосфорная кислота — это неорганический продукт, получаемый путем химической реакции между фосфатами и серной кислотой. Применяется в металлургии, стоматологии и сельском хозяйстве.
Это соединение обладает ярко выраженными антиоксидантными свойствами и потому часто используется в пищевой промышленности под названием Е 338. В газированных напитках, в частности, в «Кока-коле», ортофосфорная кислота выполняет функцию регулятора кислотности.
Молочная кислота
Молочную кислоту или добавку-консервант Е 270 получают при помощи молочнокислой ферментации. Ее образуют грамположительные микроаэрофильные или анаэробные лактобактерии из молочного сахара.
В пищевой промышленности молочная кислота используется при производстве йогуртов, сыров, кефиров, майонезов и некоторых других кисломолочных продуктов. Она обладает низкой кислотностью, и это делает возможным ее использование в мясоперерабатывающей, маслобойной и консервной отрасли.
В организме человека молочная кислота образуется при распаде глюкозы во время повышенных нагрузок и вызывает мышечные боли.
Муравьиная кислота
В природе муравьиная кислота встречается в хвое, крапиве, выделениях муравьев, пчел и некоторых других насекомых. Впервые она была открыта и описана в 1671 году. Производство пищевой кислоты было начато лишь 200 лет спустя, когда француз Марселен Бертелло сумел синтезировать ее из окиси углерода.
Сегодня муравьиная кислота, известная в пищевой промышленности как добавка Е 236, используется при производстве консервированных овощей, безалкогольных напитков, соков и пюре.