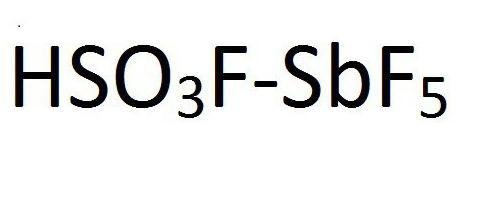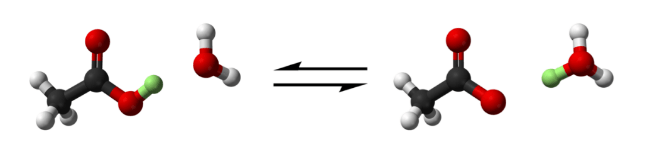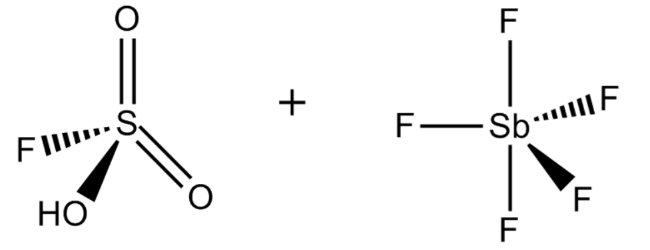что сильнее соляная или серная кислота
Самая сильная кислота. Формула самой сильной кислоты
О том, какая кислота самая сильная, спорили не одно поколение химиков. В разные времена это звание получала азотная, серная, соляная кислота. Некоторые считали, что сильнее плавиковой кислоты соединения быть не может. В последнее время получены новые соединения с сильными кислотными свойствами. Может быть, именно среди них имеется самая сильная кислота в мире? В этой статье рассмотрены характеристики наиболее сильных стойких кислот нашего времени и даны их краткие химические характеристики.
Понятие кислоты
Свойства кислот
Все кислоты обладают некоторыми химическими свойствами, которые можно назвать общими для данного класса химических соединений.
Во всех вышеназванных свойствах проявляется еще одно «умение» любой известной кислоты – это способность отдавать атом водорода, заменяя его на атом другого химического вещества или молекулу какого-либо соединения. Именно эта способность характеризует «силу» кислоты и степень ее взаимодействия с остальными химическими элементами.
Вода и кислота
Наличие воды значительно уменьшает способность кислоты отдавать атомы водорода. Это объясняется тем, что водород способен образовывать собственные химические связи между молекулами кислоты и воды, тем самым его способность отделяться от основания меньше, чем у неразбавленных кислот.
Суперкислота
Слово «суперкислота» введен в химический словарь в 1927 году, с легкой руки знаменитого химика Джеймса Конанта.
Известные сильные кислоты
Как ни странно, плавиковая кислота, которая представляет собой соединение водорода самым сильным галогеном – фтором, в претенденты на звание «Самая сильная кислота в химии» так и не попала. Единственной особенностью этого вещества является способность растворять стекло. Поэтому хранят такую кислоту в полиэтиленовой таре.
Сильные органические кислоты
Уксусная кислота чуть слабее муравьиной, но спектр ее распространения гораздо шире. Она часто встречается в соках растений и образуется при окислении различной органики.
Последние разработки в области химии позволили синтезировать новое вещество, способное конкурировать с традиционными органическими веществами. Трифторметансульфокислота имеет показатель кислотности выше, чем у серной. При этом CF3SO3H является стабильной гигроскопичной жидкостью с установленными физико-химическими свойствами при нормальных условиях. На сегодня титул «Самая сильная органическая кислота» может быть присвоен этому соединению.
Многие могут подумать, что степень кислотности не может быть значительно выше показателя серной кислоты. Но в последнее время ученые синтезировали ряд веществ, у которых параметры кислотности в несколько тысяч раз превышают значения серной кислоты. Аномально высокими значениями кислотности обладают соединения, получаемые при взаимодействии протонных кислот с кислотами Льюиса. В научном мире они называются: комплексные протонные кислоты.
Магическая кислота
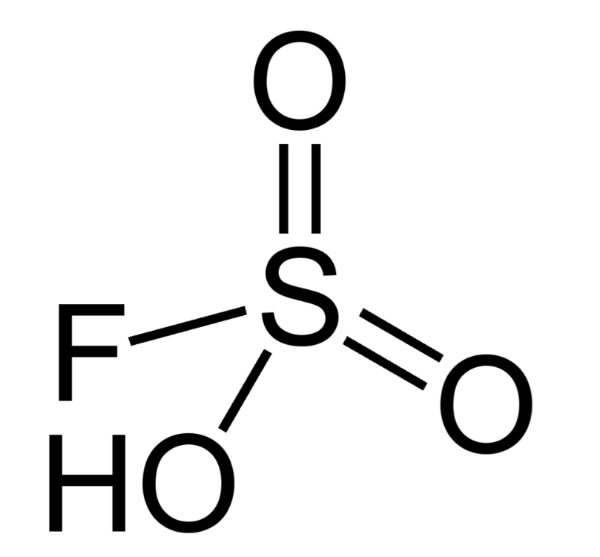
Да. Все правильно. Магическая кислота. Так и называется. Магическая кислота является смесью фтороводорода или фтор сульфороновой кислоты с пентафлоридом сурьмы. Химическая формула этого соединения представлена на рисунке:
Такое странное название магическая кислота получила на рождественской вечеринке химиков, которая произошла в начале 1960 годов. Один из сотрудников исследовательской группы Дж. Олаха показал забавный фокус, растворив восковую свечу в этой удивительной жидкости. Эта одна из самых сильных кислот нового поколения, но вещество, которое превзойдет ее по силе и кислотности, уже синтезировано.
Самая сильная кислота в мире
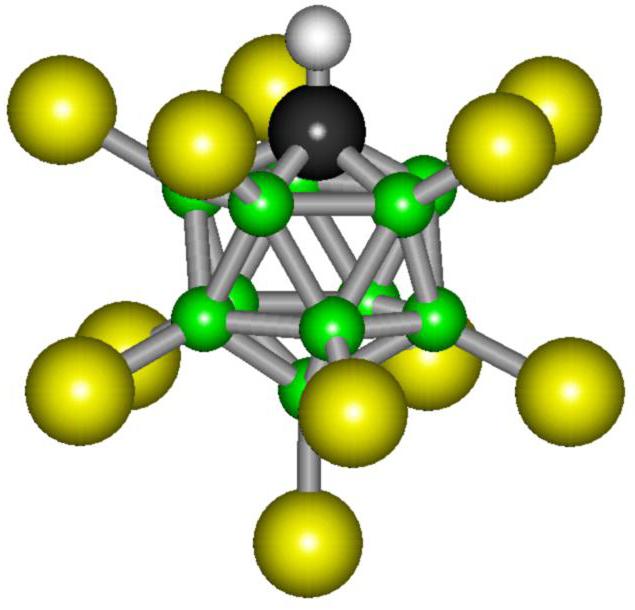
Carborane acid – карборановая кислота, которая является на сегодняшний день самой сильным соединением в мире. Формула самой сильной кислоты выглядит таким образом: H(CHB11Cl11).
Этот монстр был создан в 2005 году в Калифорнийском университете при тесном сотрудничестве с Новосибирским институтом катализа СО РАН.
Сама идея синтеза возникла в головах ученых вместе с мечтой о новых, невиданных доселе молекулах и атомах. Новая кислота в миллион раз сильнее серной, при этом она совершенно не агрессивна, и самая сильная кислота легко может храниться в стеклянной бутылке. Правда, со временем стекло все-таки растворяется, а при повышении температуры скорость такой реакции значительно увеличивается.
Такая удивительная мягкость обусловлена высокой стабильностью нового соединения. Как и все химические вещества, относящиеся к кислотам, карборановая кислота легко вступает в реакцию, отдавая свой единственный протон. При этом основание кислоты является настолько стабильным, что химическая реакция дальше не идет.
Химические свойства карборановой кислоты
Однако кислотное основание этого соединения потрясающе стабильно. Молекула этого вещества состоит из одиннадцати атомов брома и такого же количества атомов хлора. В пространстве эти частицы образуют сложную, геометрически правильную фигуру, которую называют икосаэдром. Такое расположение атомов является наиболее устойчивым, и это объясняет стабильность карборановой кислоты.
Значение карборановой кислоты
Самая сильная кислота в мире принесла своим создателям заслуженные награды и признание в научном мире. Хотя все свойства нового вещества до конца не изучены, уже становится ясным, что значение этого открытия выходит за рамки лабораторий и научно-исследовательских институтов. Карборановую кислоту можно использовать в качестве мощного катализатора при различных промышленных реакциях. Кроме этого, новая кислота может взаимодействовать с наиболее упрямыми химическими веществами – инертными газами. В настоящее время ведутся работы, допускающие возможность вступления в реакцию ксенона.
Несомненно, удивительные свойства новых кислот найдут свое применение в самых различных областях науки и техники.
Серная и соляная кислоты: какая сильнее?
Кислоты – это сложные вещества, которые состоят из одного или нескольких атомов водорода и кислотного остатка. Они обладают химическими свойствами, характерными для всего класса: реагирование с металлами с выделением водорода, взаимодействие с основаниями с образованием солей и способность изменять цвет индикаторов (окрашивание лакмусовой бумаги в красный цвет).
Эти реагенты являются электролитами и могут диссоциировать в водных растворах на катионы водорода и анионы кислотного остатка. Если соединение почти полностью диссоциирует, оно считается сильным.
Понятие силы определяет степень диссоциации реактива. Она выражается в процентах и является отношением диссоциированных молекул к сумме диссоциированных и недиссоциированных. Если вещество разбавлять водой, оно слабеет – водород образует химические связи между молекулами воды и кислоты, из-за чего его способность отделяться от основания уменьшается.
Самые сильные реагенты
Эталоном крепости кислот считается концентрированная серная (H2SO4) – она является более сильной, чем соляная. Значительным показателем кислотности и способностью взаимодействовать с большинством оснований и металлов также отличаются бромоводородная, йодоводородная и азотная кислоты.
Но в настоящее время существуют суперкислоты – вещества, обладающие даже большей кислотностью, чем у эталона. Значение таких реактивов определяется их свойством придавать положительный заряд любым основаниям.
Большим показателем кислотности, чем у H2SO4, обладает и органическая трифторметансульфокислота. При нормальных условиях ее физико-химические свойства также проявляют стабильность.
В чем опасность H2SO4?
Это соединение без цвета и запаха, получаемое путем сжигания серы или богатых ею руд, последующим окислением сернистого газа в безводный серный и его поглощением водой.
Реагент растворяется в воде в любых соотношениях и при этом выделяет значительное количество тепла. Поэтому во избежание разбрызгивания необходимо приливать данный реактив в воду, а не наоборот.
Соединение разрушающе действует на животные и растительные ткани, поглощая из них жидкость и вызывая их обугливание. Оно способно растворять большинство металлов с образованием сернокислых солей, но слабо воздействует на свинец. За короткое время сжигает хлопок, сахар, шерстяные и деревянные материалы. Вызывает очень глубокие ожоги кожных покровов и слизистых оболочек.
В чем хранят серную кислоту?
Реактив можно хранить в стеклянных тарах, так как он не проявляет агрессивного воздействия по отношению к стеклу. Соединение также не взаимодействует с керамикой, поэтому тары большого объема для хранения данного материала имеют внутреннее керамическое покрытие.
Также реагент может храниться в полиэтиленовых емкостях с пластиковыми крышками, а транспортироваться в стальных цистернах с антикоррозионным покрытием.
Хранить реактив необходимо отдельно от карбидов, металлических порошков, солей хлорноватой, азотной и пикриновой кислот. При контакте с горючими материалами он может привести к пожару. При тушении нельзя использовать воду, только золу или песок. При работе с реагентом необходимо применять защитные средства.
Самая сильная кислота. Формула самой сильной кислоты
О том, какая кислота самая сильная, спорили не одно поколение химиков. В разные времена это звание получала азотная, серная, соляная кислота. Некоторые считали, что сильнее плавиковой кислоты соединения быть не может. В последнее время получены новые соединения с сильными кислотными свойствами. Может быть, именно среди них имеется самая сильная кислота в мире? В этой статье рассмотрены характеристики наиболее сильных стойких кислот нашего времени и даны их краткие химические характеристики.
Свойства кислот
Все кислоты обладают некоторыми химическими свойствами, которые можно назвать общими для данного класса химических соединений.
Во всех вышеназванных свойствах проявляется еще одно «умение» любой известной кислоты – это способность отдавать атом водорода, заменяя его на атом другого химического вещества или молекулу какого-либо соединения. Именно эта способность характеризует «силу» кислоты и степень ее взаимодействия с остальными химическими элементами.




В чем опасность H2SO4
Это соединение без цвета и запаха, получаемое путем сжигания серы или богатых ею руд, последующим окислением сернистого газа в безводный серный и его поглощением водой.
Реагент растворяется в воде в любых соотношениях и при этом выделяет значительное количество тепла. Поэтому во избежание разбрызгивания необходимо приливать данный реактив в воду, а не наоборот.
Соединение разрушающе действует на животные и растительные ткани, поглощая из них жидкость и вызывая их обугливание. Оно способно растворять большинство металлов с образованием сернокислых солей, но слабо воздействует на свинец. За короткое время сжигает хлопок, сахар, шерстяные и деревянные материалы. Вызывает очень глубокие ожоги кожных покровов и слизистых оболочек.
Суперкислота
Слово «суперкислота» введен в химический словарь в 1927 году, с легкой руки знаменитого химика Джеймса Конанта.
Концентрация вещества
Зачастую химикам приходится решать задачи на определение количества чистой кислоты, находящейся в растворе, в процентах. В таких случаях искомым значением является концентрация.
Это величина, позволяющая определять количественный состав жидкого химического вещества. К примеру, для того, чтобы узнать, сколько чистой серной кислоты находится в разбавленном растворе, необходимо небольшое количество смеси налить в мерный стакан, взвесить и определить искомое значение по таблице плотности. Указанная таблица используется при вычислениях, так как плотность неразрывно связана с концентрацией.
Известные сильные кислоты
Самые известные кислоты из курса неорганической химии — это йодоводородная (HI), бромоводородная (HBr), соляная (HCl), серная (H2SO4) и азотная (HNO3) кислоты. Все они обладают большим показателем кислотности и способны реагировать с большинством металлов и оснований. В этом ряду самой сильной кислотой является смесь азотной и соляной кислоты, получившая название «царская водка». Формула самой сильной кислоты этого ряда — HNO3+3 HCl. Это соединение способно растворять даже драгоценные металлы – такие, как золото и платину.
Как ни странно, плавиковая кислота, которая представляет собой соединение водорода самым сильным галогеном – фтором, в претенденты на звание «Самая сильная кислота в химии» так и не попала. Единственной особенностью этого вещества является способность растворять стекло. Поэтому хранят такую кислоту в полиэтиленовой таре.
Водородный показатель
При проведении диссоциирующих реакций важно правильно определить уровень кислотности воды. Для его количественного выражения применяется величина pH, называющаяся силой, весом или потенциалом водорода. Она позволяет измерить активность ионов водорода. Если уровень pH превышает 7, то у вещества присутствуют кислотные свойства, если же этот показатель меньше 7, то свойства являются основными.
Способы определения
Результаты химических реакций, в которых участвует любое вещество, напрямую зависят от уровня его кислотности. А потому химики всегда измеряют этот показатель.
Существует несколько методов определения pH:
Буферный раствор
Буферным раствором называется вещество, отличающееся наличием постоянной концентрации ионов водорода.
При добавлении сильной кислоты или такого же основания в небольших дозах эти растворы сохраняют изначальный уровень кислотности.
Для приготовления такой смеси нужно смешать слабое кислое вещество или основание с соответствующей солью.
При изготовлении буферного раствора необходимо учитывать следующие факторы:
Сильные органические кислоты
Претенденты на титул «Самая сильная кислота в органической химии» — муравьиная и уксусная кислоты. Муравьиная кислота является самой сильной в гомологическом ряду предельных кислот. Свое название она получила из-за того, что некоторая часть ее содержится в выделениях муравьев.
Уксусная кислота чуть слабее муравьиной, но спектр ее распространения гораздо шире. Она часто встречается в соках растений и образуется при окислении различной органики.
Последние разработки в области химии позволили синтезировать новое вещество, способное конкурировать с традиционными органическими веществами. Трифторметансульфокислота имеет показатель кислотности выше, чем у серной. При этом CF3SO3H является стабильной гигроскопичной жидкостью с установленными физико-химическими свойствами при нормальных условиях. На сегодня титул «Самая сильная органическая кислота» может быть присвоен этому соединению.
Многие могут подумать, что степень кислотности не может быть значительно выше показателя серной кислоты. Но в последнее время ученые синтезировали ряд веществ, у которых параметры кислотности в несколько тысяч раз превышают значения серной кислоты. Аномально высокими значениями кислотности обладают соединения, получаемые при взаимодействии протонных кислот с кислотами Льюиса. В научном мире они называются: комплексные протонные кислоты.
Магическая кислота
Да. Все правильно. Магическая кислота. Так и называется. Магическая кислота является смесью фтороводорода или фтор сульфороновой кислоты с пентафлоридом сурьмы. Химическая формула этого соединения представлена на рисунке:
Такое странное название магическая кислота получила на рождественской вечеринке химиков, которая произошла в начале 1960 годов. Один из сотрудников исследовательской группы Дж. Олаха показал забавный фокус, растворив восковую свечу в этой удивительной жидкости. Эта одна из самых сильных кислот нового поколения, но вещество, которое превзойдет ее по силе и кислотности, уже синтезировано.
Кривые титрования
Кривые титрования представляют собой график зависимости параметра вещества, который связан с концентрацией реагента, подвергающегося титрованию, титранта или продукта химической реакции, от степени протекания процесса. Если проходит кислотно-основная реакция, то показателем концентрации каждого её участка является уровень рН.
Существуют теоретические и экспериментальные кривые. Теоретические используются для того, чтобы обосновать выбор индикатора. Их расчёт осуществляется по уравнению реакции и данным об исходной концентрации соединений, вступающих в реакцию. Экспериментальные кривые позволяют определить точки эквивалентности. Их получают путём измерения одного из свойств системы в процессе титрования.
Протекание и результат химических реакций, в которые вступает любая кислота, напрямую зависят от того, является это вещество сильным или слабым. В специальных химических таблицах приведены наименования самых распространённых соединений, что позволяет безошибочно определить силу реагента.
Самая сильная кислота в мире
Carborane acid – карборановая кислота, которая является на сегодняшний день самой сильным соединением в мире. Формула самой сильной кислоты выглядит таким образом: H(CHB11Cl11).
Этот монстр был создан в 2005 году в Калифорнийском университете при тесном сотрудничестве с Новосибирским институтом катализа СО РАН.
Сама идея синтеза возникла в головах ученых вместе с мечтой о новых, невиданных доселе молекулах и атомах. Новая кислота в миллион раз сильнее серной, при этом она совершенно не агрессивна, и самая сильная кислота легко может храниться в стеклянной бутылке. Правда, со временем стекло все-таки растворяется, а при повышении температуры скорость такой реакции значительно увеличивается.
Такая удивительная мягкость обусловлена высокой стабильностью нового соединения. Как и все химические вещества, относящиеся к кислотам, карборановая кислота легко вступает в реакцию, отдавая свой единственный протон. При этом основание кислоты является настолько стабильным, что химическая реакция дальше не идет.
Сильные и слабые реагенты
Если реагент в водном растворе полностью распадается на ионы, то есть диссоциирует, то оно является сильным, поскольку слабые химические соединения никогда не растворяются до конца.
Кроме того, отличить слабую кислоту можно посредством измерения её проводимости. Сильные соединения являются хорошими электролитами. Сильные основания при попадании в воду также распадаются. Следует отметить, что основания также называют гидроксидами или гидроокисями.
Существует специальные перечни слабых и сильных кислот и оснований. Таблица, приведённая ниже, также может использоваться для классификации реагентов.
| Сильная кислота | Слабая кислота | Сильное основание | Слабое основание |
| HCI соляная или хлороводородная | HF фтороводородная | NaOH гидроокись натрия | Mg(OH)2 гидроокись магния |
| HBr бромоводородная | CH3COOH уксусная | KOH гидроокись калия | Fe(OH)2 гидроокись железа (II) |
| HI йодоводородная | H2SO3 сернистая | Ca(OH)2 гидроокись кальция | Zn(OH)2 гидроокись цинка |
| HNO3 азотная | H2S сероводородная | Ba(OH)2 гидроокись бария | NH4OH гидроокись аммония |
| HClO4 хлорная | HNO2 азотистая | LiOH гидроокись лития | Fe(OH)3 гидроокись железа (III) |
| H2SO4 серная | H2SiO3 кремниевая |
А также следует отметить, что кислородсодержащая угольная (H2CO3) и ортофосфорная (H3PO4) или фосфорная кислоты — слабые. К сильным же необходимо добавить хромовую, которая является средней по силе.
Кроме того, нужно учитывать, что современная химия позволяет учёным создавать новые соединения. В связи с этим список кислот, как сильных, так и слабых, постоянно пополняется.
Химические свойства карборановой кислоты
Новая кислота – отличный донор протона Н+. Именно это и определяет силу этого вещества. Раствор карборановой кислоты содержит больше ионов водорода, чем любая другая кислота в мире. В химической реакции SbF5 — пентафторид сурьмы, связывает илон фтора. При этом высвобождаются новые и новые атомы водорода. Поэтому карборановая кислота и является сильнейшей в мире – взвесь протонов в ее растворе больше аналогичного показателя серной кислоты в 2×1019 раз.
Однако кислотное основание этого соединения потрясающе стабильно. Молекула этого вещества состоит из одиннадцати атомов брома и такого же количества атомов хлора. В пространстве эти частицы образуют сложную, геометрически правильную фигуру, которую называют икосаэдром. Такое расположение атомов является наиболее устойчивым, и это объясняет стабильность карборановой кислоты.
Значение карборановой кислоты
Самая сильная кислота в мире принесла своим создателям заслуженные награды и признание в научном мире. Хотя все свойства нового вещества до конца не изучены, уже становится ясным, что значение этого открытия выходит за рамки лабораторий и научно-исследовательских институтов. Карборановую кислоту можно использовать в качестве мощного катализатора при различных промышленных реакциях. Кроме этого, новая кислота может взаимодействовать с наиболее упрямыми химическими веществами – инертными газами. В настоящее время ведутся работы, допускающие возможность вступления в реакцию ксенона.
Несомненно, удивительные свойства новых кислот найдут свое применение в самых различных областях науки и техники.
8 сильнейших кислот, известных нам
Что делает кислоту сильной или слабой? Чтобы ответить на этот вопрос, нам сначала нужно взглянуть на определение кислоты. Это химическое соединение, которое принимает электроны и / или отдает (диссоциирует) ионы водорода, также известные как протоны.
Следовательно, уровни кислотности кислоты зависят от ее способности диссоциировать ионы водорода, т.е. чем больше число ионов водорода, продуцируемых кислотой в растворе, тем более кислым он является. Теперь, прежде чем мы перейдем к списку сильнейших кислот на Земле, есть определенные термины и определения, с которыми вам необходимо ознакомиться.
Это подводит нас к другому связанному и важному показателю кислотности pKa. Это в основном отрицательный целочисленный логарифм Ka.
Чем сильнее кислота, тем ниже значения pKa.
Уксусная кислота отдает протон (в зеленом цвете) воде, чтобы произвести ион гидрония и ион ацетата. (Кислород в красном, водород в белом и углерод в черном)
Функция кислотности Гаммета: (H o) Всем нам известна шкала pH, которая обычно используется для измерения уровней кислотности или основности химических веществ, но когда речь идет о суперкислотах, она просто становится бесполезной, поскольку их уровни кислотности в миллион раз больше, чем серная и соляная кислоты.
Таким образом, чтобы измерить суперкислоты на основе их уровней кислотности, исследователи придумали функцию кислотности Гаммета. Первоначально он был предложен американским физическим химиком Луи Плаком Гаммет.
8. Серная кислота
Серная кислота (98%) на листе бумаги
Серная кислота или купорос не нуждаются в формальном введении. Он не имеет запаха, цвета и вызывает интенсивную экзотермическую реакцию при смешивании с водой. Серная кислота является важным химическим веществом, которое необходимо для многих отраслей промышленности, таких как сельское хозяйство, очистка сточных вод и нефтепереработка. Она также используется в кислотах аккумулятора и чистящих средствах.
Она также играет важную роль в изучении кислот в целом. Серная кислота служит базовым эталоном для сравнения уровней кислотности суперкислот или кислот. Хотя существует несколько способов получения серной кислоты, обычно используют контактный процесс и влажный процесс серной кислоты.
H 2 SO 4 может нанести значительный ущерб коже человека при прямом контакте. Это также очень разъедает многие металлы. Химическое вещество гораздо более агрессивно и опасно, когда присутствует в высокой концентрации, благодаря своим превосходным окислительным и дегидратирующим свойствам.
7. Соляная кислота
Подобно серной кислоте, соляная кислота также является важным химическим веществом, которое широко используется в лабораториях и различных отраслях промышленности. Соляная кислота была обнаружена где-то около 800 г. н.э. иранским ученым-эрудитом по имени Джабир ибн Хайян.
Те, кто задаются вопросом, почему соляная кислота сильнее серной кислоты, несмотря на то, что последняя является контрольной точкой для суперкислот, причина этого заключается в том, что серная кислота является дипротоновой кислотой, которая обычно не полностью диссоциирует.
Другими словами, HCl сильнее серной кислоты, поскольку ее ионы водорода (HCl) легко отделяются от хлорида по сравнению с сульфат-ионом из серной кислоты. Так или иначе, соляная кислота в основном используется в тяжелой промышленности для удаления ржавчины с железа и стали перед дальнейшей обработкой. Кроме того, это жизненно важный компонент в производстве органических (винилхлорид используется для ПВХ) и многих неорганических соединений.
6. Трифторметансульфоновая кислота
Трифликовая кислота используется во многих протонированиях и титрованиях (количественный анализ химического состава). Важная причина, по которой трифликовая кислота является предпочтительной в определенных случаях, заключается в том, что она не сульфонирует другие вещества, что характерно для хлорсульфоновой кислоты и серной кислоты.
Излишне говорить, что это чрезвычайно опасно. Любой контакт кожи с кислотой может вызвать серьезные ожоги и может привести к незначительному повреждению тканей. Это может также вызвать отек легких и судороги и другие критические условия при вдыхании.
5. Фторсульфоновая кислота
Фторосерная кислота или серно-фтористоводородная кислота (официальное название) является второй сильнейшей однокомпонентной кислотой, доступной сегодня. Это желтый на вид и, конечно, очень едкий / токсичный. HSO 3 F обычно получают путем взаимодействия фтористого водорода с триоксидом серы, и в сочетании с пентафторидом сурьмы он образует «волшебную кислоту», гораздо более сильную кислоту и протонирующий агент.
Кислота может быть использована для алкилирования углеводородов (с алкенами) и изомеризации алканов, а также для травления стекла (художественное стекло). Это обычный фторирующий агент в лабораториях.
4. Хлорная кислота
Хлорная кислота является одной из самых сильных кислот Бренстеда-Лоури, которые обладают сильными окислительными свойствами и обладают высокой коррозионной активностью. Традиционно ее получают обработкой перхлората натрия соляной кислотой (HCl), которая также создает хлорид натрия.
NaClO4 + HCl → NaCl + HClO4
В отличие от других кислот, хлорная кислота не подвержена гидролизу. Это также одна из самых регулируемых кислот в мире. Еще в 1947 году в Лос-Анджелесе, штат Калифорния, около 150 человек получили ранения и 17 человек погибли в результате химического взрыва, в котором содержалось почти 75% хлорной кислоты (по объему) и 25% ангидрида уксусной кислоты. Также было повреждено более 250 близлежащих зданий и транспортных средств.
Несмотря на взрывную природу, хлорная кислота широко используется и даже предпочтительна в некоторых типах синтеза. Это также важный компонент перхлората аммония, который используется в современном ракетном топливе.
3. Фторированная карборановая кислота
Общая структура карбоновой кислоты
Одним из таких членов этой группы является фторированная карборановая кислота. Хотя о существовании такого химического вещества первоначально сообщалось в 2007 году, исследователи смогли в полной мере изучить его природу только в 2013 году. До его открытия корона сильнейшей кислоты Бренстеда перешла к сильно хлорированной версии этого семейства суперкислот.
Фторированный карборан является единственной известной кислотой, которая может протонировать (переносить ион водорода) диоксид углерода с образованием катионов, соединенных водородом. В отличие от этого, CO 2 не подвергается какой-либо заметной протонации при обработке другими суперкислотами, такими как магическая кислота и HF-SbF5.
2. Волшебная кислота
FSO 3 H · SbF 5, наиболее известный как магическая кислота, получают смешением фторсерной кислоты и пентафторида сурьмы в молярном соотношении 1: 1. Эта сверхкислотная система была впервые разработана в 1966 году исследователями из лаборатории Джорджа Олаха, Университета Case Western Reserve в Огайо.
Его довольно причудливое название было установлено после официального события в 1966 году, когда сотрудник лаборатории Олаха продемонстрировал протонирование углеводородов, в котором парафиновая свеча «волшебным образом» растворилась и превратилась в раствор трет-бутильного катиона после того, как она была помещена в то, что сейчас известно как волшебная кислота.
Хотя Волшебная кислота обычно используется для стабилизации ионов углерода в растворах, она имеет несколько других важных промышленных применений. Например, он может ускорить изомеризацию насыщенных углеводородов и даже протоната метана, ксенона и галогенов, которые все являются слабыми основаниями.
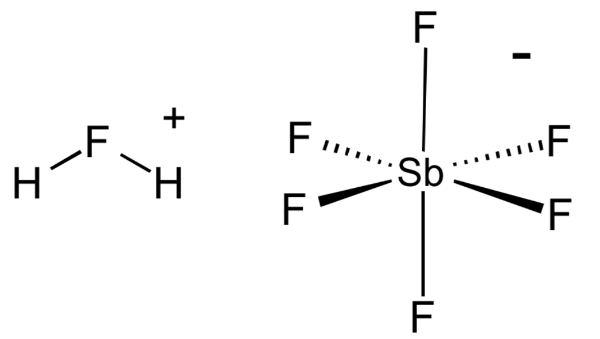
1. Фтороантимоновая кислота
Фторантимоновая кислота является, пожалуй, самой сильной из всех известных суперкислот, основанных на значениях функции кислотности Гаммета. Его получают путем смешивания фтористого водорода с пентафторидом сурьмы, как правило, в соотношении 2: 1. Эта реакция носит экзотермический характер.
Этот суперкислота имеет несколько важных применений в химическом машиностроении и нефтехимической промышленности. Например, его можно использовать для отделения метана и Н 2 от неопентана и изобутана (оба алкана) соответственно.
Неудивительно, что H 2 FSbF 6 чрезвычайно агрессивен и может подвергаться сильному гидролизу при контакте с водой. Как и большинство суперкислот, фторантимоновая кислота может питаться прямо через стекло, поэтому она должна храниться в контейнерах из политетрафторэтилена.
Теперь, большинство из вас, возможно, наткнулись на карбоновые кислоты (либо хлорированная карбоновая кислота, либо фторированная карборановая кислота), когда искали «самые сильные кислоты в мире». Ну, технически они верны, так как карбоновые кислоты являются самыми сильными известными однокомпонентными кислотами на Земле, гораздо более кислыми, чем подобные хлорной и трифликовой кислотам (фтороантимоновая кислота на самом деле является смешанной кислотой).