Что такое окисление жиров
Окисление жирных кислот
Содержание
Окисление жирных кислот для образования АТФ (в мышцах) и кетоновых тел (в печени) [ править | править код ]
Выход АТФ при полном окислении пальмитата
1 Синтаза длинноцепочечного ацил-КоА
2 Ацил-КоА-дегидрогеназа (х 7)
3 L-3-гидроксиацил-КоА-дегидрогеназа (х 7)
Примечание: в общем выходе реакции — 106 молекул АТФ — не учитываются затраты энергии на транспорт фосфата, эквивалентные 2 молекулам АТФ. Таким образом, на самом деле выход реакции составляет 104 молекулы АТФ [Salway J.G. Metabolism at a Glance. — 3rd ed. — Blackwell Publishing. — P. 38-39].
Образование АТФ в мышцах [ править | править код ]
В аэробных условиях лучшим источником энергии для мышц являются жирные кислоты, которые для образования АТФ предварительно подвергаются β-окислению (рис. 33.1).
Образование АТФ и кетоновых тел в печени [ править | править код ]
При голодании или в случае неконтролируемого сахарного диабета жирные кислоты поступают в клетки печени и транспортируются из цитозоля в митохондрии (рис. 33.2). Для переноса жирных кислот в матрикс митохондрий используется карнитиновая челночная система.
Карнитиновая челночная система [ править | править код ]
Пальмитоил-КоА связывается с карнитином, образуя пальмитоилкарнитин. Эту реакцию катализирует карнитинпальмитоилтрансфераза наружной мембраны митохондрий. Во внутренней мембране митохондрий расположена другая карнитинпальмитоилтрансфераза. Она катализирует обратную реакцию, расщепляя пальмитоилкарнитин на карнитин и пальмитоил-КоА.
При недостаточности карнитина жирные кислоты не могут проникнуть в митохондрии, β-окисление жирных кислот останавливается и развивается гипогликемия.
Кетогенез [ править | править код ]
При β-окислении жирных кислот образуются ацетил-КоА, НАДН и ФАДН2. НАДН и ФАДН2 окисляются в дыхательной цепи, и образованный АТФ для обеспечения реакций глюконеогенеза и синтеза мочевины. Из ацетил-КоА образуются кетоновые тела: ацетоацетат и β-гидроксибутират. Из ацетоацетата в небольших количествах образуется ацетон, поэтому от людей, использующих низкоуглеводную диету, и от диабетиков при кетоацидозе при выдохе исходит характерный фруктовый запах (изо рта) — это запах ацетона. Примечание: когда соотношение НАДН/НАД+ высокое (например, при диабетическом кетоацидозе) равновесие в β-гидроксибутиратдегидрогеназной реакции смещается в сторону образования β-гидроксибутирата. Таким образом, при диабетическом кетоацидозе концентрация β-гидроксибутирата может в 5 раз превышать концентрацию ацетоацетата. Запомните: метод определения содержания кетоновых тел в реакции с нитропруссидом позволяет измерять только концентрацию ацетоацетата, но не основного кетонового тела β-гидроксибутирата.
Окисление жиров
Окисление жиров атмосферным кислородом в той или иной степени происходит уже при их получении и переработке. При хранении в неблагоприятных условиях жиры приобретают неприятные вкус и запах и часто оказываются непригодными для пищевых целей. Этот процесс называется прогорканием и происходит в результате окисления жиров кислородом воздуха, а также биохимическим путем.
Глубина окислительных процессов и скорость окисления находятся в прямой зависимости от количества входящих в жиры глицеридов полиненасыщенных жирных кислот и степени их ненасыщенности. Преимущественно окисляется группа —СН2-, соседняя с двойной связью (а-положение), а с наибольшей скоростью — расположенная между двумя двойными связями. В результате воздействия кислорода воздуха на жиры происходит накопление различных продуктов распада, ухудшающих органолептические и реологические свойства. Жиры, в которых начались окислительные процессы, имеют пониженную стойкость при дальнейшем хранении. Совершенно неокисленные жиры трудно поддаются воздействию молекулярного кислорода. Скорость окисления зависит также от интенсивности соприкосновения жира с воздухом и от температуры. Механизм реакций окисления органических веществ, в том числе и жиров, объясняют перекисная теория Баха-Энглера и теория цепных реакций Н. Н. Семенова.
Согласно перекисной теории, первоначальными продуктами окисления жиров являются неустойчивые перекисные соединения различных типов, способные при распаде образовывать ряд более стабильных продуктов окисления.
При окислении насыщенных жирных кислот образуются насыщенные гидропероксиды, а при окислении ненасыщенных жирных кислот — ненасыщенные гидропероксиды. В этом случае окисление происходит не вследствие присоединения кислорода к двойной связи кислоты, а в результате отрыва водорода от метиленовой группы, расположенной по соседству с двойной связью. При окислении линолевой кислоты могут образовываться гидропероксиды с двумя сопряженными двойными связями. Образование циклических пероксидов происходит в результате присоединения кислорода по месту двойной связи кислоты.
Перекисные соединения неустойчивы. Они разлагаются под влиянием различных агентов с образованием вторичных, более устойчивых соединений — гидроксикислот, эпокисей, адьдегидов, кетонов, сополимерных и других веществ. Например, при термическом распаде гидроперекисей в присутствии непредельных кислот в числе других продуктов образуются гидроксикислоты и эпокиси. Гидропероксиды, гидроксикислоты и эпокиси кислот не имеют вкуса и запаха. Носителями неприятного вкуса и запаха окисленных жиров (прогорклых) являются кетоны, альдегиды и низкомолекулярные кислоты, образующиеся на последующих стадиях окисления жира.
В настоящее время большое распространение получила разработанная академиком Н. Н. Семеновым цепная теория окисления жиров, дающая объяснение механизму этого процесса. По этой теории окисление связано с цепным развитием реакции через свободные радикалы, имеющие свободные валентности и обладающие повышенной реакционной способностью. Радикалы эти постоянно переходят в устойчивое валентно-насыщенное состояние. При этом они сами расходуются на образование новых веществ и других свободных радикалов и атомов. Последние взаимодействуют в таком же порядке. Таким образом, этот процесс обусловливает протекание цепной реакции. Пероксиды являются первичными продуктами окисления. До их образования реакции протекают очень медленно. По мере накопления пероксидов они создают начальные радикалы, зарождающие новые цепи. Это приводит к автоускорению процесса окисления.
Цепные реакции окисления имеют ряд характерных особенностей:
1. Скорость реакции значительно увеличивается в присутствии небольших количеств веществ, способных образовывать свободные радикалы, например металлов переменной валентности (Со, Мп, Fe, Си др.).
2. Скорость реакции увеличивается при повышении температуры хранения и воздействии света, особенно ультрафиолетовых лучей, способствующих возникновению свободных радикалов.
3. Соотношение скорости окисления эфиров олеиновой, линолевой и линоленовой кислот составляет 1: 27 : 77.
4. Скорость реакции может быть резко заторможена добавлением небольших количеств веществ, получивших название ингибиторов окисления (антиокислителей).
Ингибиторы окисления препятствуют или задерживают окисление жиров. Действие их связано с возникновением менее активного радикала, который не вступает в реакцию с молекулой исходного окисляющегося вещества.
Природными антиокислителями являются токоферолы (в растительных маслах их содержится от 0,01 до 0,28%), госсипол хлопковых семян, сезамол кунжутных семян и некоторые фосфатиды. Получили распространение фенольные ингибиторы окисления, сложные эфиры
галловой кислоты. Достаточно ввести их в количестве около 0,01%, как стойкость некоторых жиров увеличивается более чем в 10 раз. Очень эффективны для защиты некоторых жиров хорошо растворяющиеся в них антиокислители — бутилгидокситолуол и бутилгидоксианизол (Е 321 и Е 320).
Некоторые вещества могут усиливать ингибирующее действие антиокислителей. Они получили название синергистов. Действие синергистов основано на способности дезактивировать ионы металлов переменной валентности (Pb, Си, Со, Mn, Fe и др.), играющих роль катализаторов окисления. Антиокислители и синергисты должны отвечать следующим требованиям:
• предохранять жиры и масла от окисления в течение длительного времени;
• растворяться в жирах;
• не вносить посторонних вкуса и запаха;
• не оказывать в применяемых концентрациях вредного воздействия на организм человека.
Окисление липидов может проходить и под действием ферментов — липаз и линоксигеназ. Ферментативное окислительное прогоркание характерно для липидного комплекса хранящихся масличных семян. Липаза осуществляет гидролиз триглицеридов, липоксигеназа катализирует образование гидропероксидов ненасыщенных жирных кислот (главным образом линолевой и линоленовой). Свободные жирные кислоты окисляются быстрее, чем их остатки, входящие в молекулы жира. Ферментативное прогоркание начинается с гидролиза жира ферментом липазой. В общем виде этот процесс может быть представлен схемой (рис. 2.1).
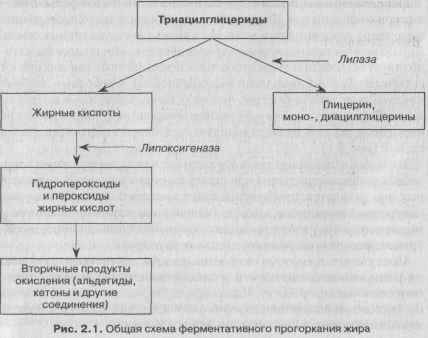
Присутствие продуктов окисления в жирах значительно ухудшает их физиологическое действие и органолептические показатели, а также затрудняет их переработку. Поэтому предотвращение окислительных процессов при получении, переработке и хранении жиров и контроль за этими процессами имеют очень важное значение.
 fitcultura
fitcultura
FITcultura
Тренируй разум, Обучай тело!
Сжечь жир нельзя помиловать
Один из главных вопросов, интересующий спортсменов и тренеров – биоэнергетика. Откуда берется энергия для жизнедеятельности? Вникнув в детали о макронутриентах и их метаболизме, у пытливого ума возникает уже более серьезный вопрос: как сочетаются процессы получения энергии из углеводов, жиров, белков? Что, например, нужно предпринять, чтобы сжигать больше жира?
На эту тему написана хорошая статья Андрея Антонова «Окисление жиров». Статья очень интересная, можно почерпнуть из нее много нового. И, что самое главное, – сделаны довольно неожиданные выводы. Вся информация подкреплена логическими рассуждениями, частично заимствованными от профессора Селуянова Виктора Николаевича, что придает научности данному труду.
Но при детальном рассмотрении приводимых фактов можно выявить неточности, разбирая которые, подвергаются сомнению и выводы, сделанные в статье. Эти неточности мы и разберем здесь.
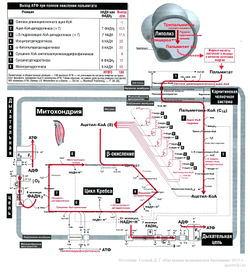
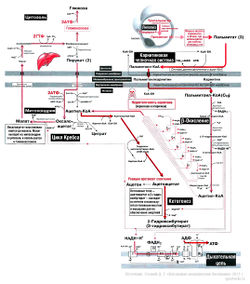
Для тех, кто все же решил осилить статью полностью – не стесняйтесь поглядывать на рисунок «Упрощенная схема катаболизма жиров и углеводов в клетке», на котором в упрощенном варианте обозначены описываемые механизмы.
Прежде всего, необходимо определиться с глобальным пониманием взаимодействия процессов метаболизма, в частности катаболизма углеводов/глюкозы и жиров/жирных кислот:
Но при более низком показателе энергообеспечения на один атом углерода, у глюкозы есть преимущество – она начинает давать энергию сразу там, где и находится – в цитоплазме клетки. Чтобы получить АТФ от жиров их нужно подхватить в цитоплазме, доставить в митохондрию – и только там можно с них «вытащить» так необходимую энергию/АТФ.
Эффективность энергообеспечения при окислении глюкозы и жиров
Эффективность энергообеспечения при окислении глюкозы и жиров сравнивать очень просто. Но нужно учитывать, что возможны варианты, например, исходя из доступности глюкозы в крови. Рассмотрим нейтральный вариант, когда уровень глюкозы в норме и пройдемся по порядку протекания процессов:
Митохондрия:
Глюкоза уже в виде пирувата проходит стадию подготовки к центральной части клеточного дыхания – цикл Кребса. Пируват декарбоксилируется/окисляется до 1 молекулы Ацетил-КоА с выделением 1 молекулы НАДН для каждой молекулы Ацетил-КоА, что в цепи переноса электронов преобразуется примерно в 3 молекулы АТФ. При этом теряется один углерод на образование CO2. Всего из одной молекулы глюкозы можно «выжать» 2 молекулы Ацетил-КоА, т.к. на стадии гликолиза мы получили 2 пирувата. Т.е. стадия подготовки глюкозы в митохондрии к циклу Кребса дает 6 молекул АТФ (=2НАДН).
Жирная кислота после попадания в митохондрию также проходит этап подготовки к циклу Кребса. Подготовка заключается в бета окислении, на каждом этапе которого будет получена 1 молекула Ацетил-КоА (уходящая сразу в дальнейшие преобразования в цикле Кребса) с образованием 1 ФАДН2 и 1 НАДН, что далее в цепи переноса электронов преобразуется примерно в 5 молекул АТФ (ФАДН2=2 АТФ, НАДН =3 АТФ). При этом не «теряются» атомы углерода – все идут в итоге в цикл Кребса, а значит, будут использованы для получения энергии/АТФ.
На этом этапе подготовки преимущество жирных кислот с точки зрения энергообеспечения становится неоспоримым. «Выигрыш» (+2 АТФ) идет не только в образовании ФАДН2 (= 2 АТФ) на каждый Ацетил-КоА, но и в том, что 1 молекула жирной кислоты дает минимум в 4-5 раз больше молекул Ацетил-КоА, которые далее имеют одинаковую судьбу независимо от происхождения – становятся «топливом» для цикла Кребса. И соответственно, из каждой молекулы Ацетил-КоА будет произведено одинаковое количество энергии независимо от ее происхождения (глюкоза или жирная кислота).
Понимая эти процессы, можно сделать вывод: при уже текущей полноценной работе механизмов катаболизма жиров и углеводов – жирные кислоты более эффективны для получения энергии. При меньших усилиях мы получим больше АТФ, а значит, мощность не упадет по причине перехода на окисление жиров, если механизм уже запущен. Если же мышечная работа только начинается, или резко возрастает запрос на большое количество дополнительной энергии/АТФ (включение новых МВ или миофибрилл внутри МВ) – усиливается гликолиз на время, пока окисление жирных кислот не «раскочегарится» до нужного уровня.
Организм в результате эволюции, или действий Создателя, или инопланетных влияний – на ваше философское или религиозное усмотрение – заточен на оптимизацию процессов и понимает лучше любого из нас описанные выше процессы.
Регуляция катаболизма жиров и углеводов, переключение процессов.
В реальности полного переключения источника энергии практически не бывает. В клетках фактически присутствуют оба процесса – окисление жиров и углеводов в случае наличия субстратов окисления (жиров и углеводов) и митохондрий (вместе с кислородом и необходимыми ферментами).
Рассмотрим это на примере интересующей большинство из нас мышечной клетки. Если упрощенно взглянуть на регуляцию окисления глюкозы и жирных кислот, то она направлена на то, чтобы при повышении потребности клетки в энергии (начало или усиление мышечной работы), процессы гликолиза и окисления глюкозы ускорялись, и также активизировалось окисление жирных кислот. Т.е. увеличение количества АДФ и АМФ (производные АТФ, полученные после энергетических затрат) стимулирует ускорение обоих процессов. При увеличении количества АТФ – скорость процессов снижается, т.е. это сигнал, что клетке достаточно энергии для этого режима работы. Таким же сигналом служат соотношения НАДН/НАД+ и ФАДН2/ФАД+, т.к. они говорят фактически о том же – дефицит или избыток производимой энергии. Также практически все этапы катаболизма обоих субстратов регулируются их производными. Т.е. избыток промежуточного продукта на одной из стадий ингибирует фермент, с помощью которого этот продукт производится и таким образом снижается скорость течения всего процесса. Это касается и гликолиза, и декарбоксилирования пирувата, и окисления жирных кислот, и цикла Кребса.
Доставкой жирных кислот в митохондрию занимается переносчик – карнитин. Т.е. от его активности будет зависеть преимущественное окисление жирных кислот.
Активность карнитина зависит от уровня инсулина и уровня гликогена (Lyle McDonald). Когда в крови много глюкозы, соответственно понижается необходимость экономить и окисление жирных кислот уступает преимущественное значение в образовании энергии. Два фермента имеют ключевое значение в этом процессе – Ацетил-КоА карбоксилаза, первый фермент синтеза жирных кислот, и Карнитин ацил трансфераза 1, которая лимитирует транспорт жирных кислот в митохондриальный матрикс для окисления (David L. Nelson, Michael M. Coх). Было бы логичным также предположить, что организм увеличивает потребление глюкозы при ее увеличении в крови во избежание гипергликемии.
Гликолиз кроме соотношения АТФ/АДФ, НАДН/НАД+ стимулируется: Ca2+(мышечные сокращения), адреналином, инсулином (David L. Nelson, Michael M. Coх, Е.С. Северин ).
Комментарии к статье «Окисление жиров».
1.Начнем с поднятого вопроса насчет исследований, указывающих на окисление жиров с первой минуты при умеренной работе. Просмотренные мной учебники по биохимии не говорят о начале окисления жиров с 45й минуты, везде информация соответствует реальности: окисление жирных кислот действительно начинается с первых же минут. Но говорить об их интенсивности можно, лишь определив внешние факторы: если уровень инсулина высокий, т.е. если мы говорим об абсорбтивном периоде – преимущественно будет использоваться глюкоза даже в ОМВ, т.к. активность карнитина будет подавлена (см. выше). Если мы говорим о низком уровне сахара в крови – то при увеличении потребности в дополнительной энергии (включение новых МВ, либо миофибрилл внутри МВ) ОМВ в любом случае начнут пополнять потраченную АТФ за счет гликолиза (т.к. энергия нужна срочно), но довольно быстро перейдут на преимущественное окисление жиров (при наличии кислорода) за счет увеличения активности карнитина. При нормальном уровне глюкозы в крови задействованные ОМВ также довольно быстро включат процессы окисления жиров, т.к. карнитин не ингибирован высоким инсулином. Но гликолиз также будет иметь место, при этом с течением времени уступая его все больше процессам окисления жиров за счет понижения уровня инсулина и уровня гликогена (факторы, влияющие на активность карнитина – см. выше).
2.Далее в статье упоминается цитрат, который ингибирует гликолиз. Так как нет пояснений, что именно это за цитрат, то рискну предположить, что имеется в виду цитрат, образующийся внутри митохондрии и являющийся одним из этапов цикла Кребса. Информация о цитрате, подавляющем гликолиз есть не только в википедии, но и у David L. Nelson и Michael M. Coх, на которых я уже ссылался выше, да и ссылается сама википедия. Что же пишут эти господа в контексте данного вопроса:
«Цитрат, продукт первого шага ЦТК (Цикла Кребса), является важным аллостерическим подавителем фосфофруктокиназы-1/PFK-1 в гликолитическом пути… Цитрат, ключевой посредник в аэробном окислении пирувата, жирных кислот, или аминокислот, также служит аллостерическим регулятором фосфофруктокиназы-1/ PFK-1; высокая концентрация цитрата увеличивает подавляющие эффекты АТФ, способствуя снижению использования глюкозы для гликолиза. В этом случае цитрат служит как внутриклеточный сигнал, что клетка удовлетворяет свои с текущие потребности окислением жиров.»
Здесь нужно обратить внимание на то, что цитрат подавляет фосфофруктокиназу-1. Это значит, что они должны взаимодействовать друг с другом. Фермент фосфофруктокиназа-1 находится в цитоплазме клетки. Цитрат же изначально образуется в митохондрии. Для его выхода в цитоплазму необходим избыток цитрата внутри митохондрии. При условиях постоянной потребности в АТФ (т.е. при мышечной работе) цитрат не накапливается, т.к. постоянно расходуется как одно из звеньев цикла Кребса.
Доктор хим. Наук, профессор, член корреспондент РАН Е.С. Северин : «Перенос цитрата в цитоплазму происходит только при увеличении количества цитрата в митохондриях, когда изоцитратдегидрогеназа и α-кетоглутаратдегидрогеназа ингибированы высокими концентрациями NADH и АТФ.» (повышенная концентрация NADH и АТФ – свидетельство накопления энергии). Что вполне логично, т.е. попадание цитрата в цитоплазму возможно при уменьшении запросов клетки на энергию или снижение мышечной активности, которая высвобождением CA2+ стимулирует скорость осуществления реакций цикла Кребса (David L. Nelson и Michael M. Coх). Выход цитрата в цитоплазму – это фактически начальный этап синтеза жирных кислот с дополнительными затратами АТФ, что в момент мышечной работы и повышенного расхода энергии маловероятно.
3.При работе МВ, где недостаточно митохондрий, или в условиях гипоксии, например, при выполнении статодинамических упражнений, продукт гликолиза, пируват, не идет в митохондрию, а преобразуется в лактат. Эта реакция обратима. Т.е. лактат может быть преобразован обратно в пируват, если будут для этого условия (см. рисунок «Упрощенная схема катаболизма жиров и углеводов в клетке»). Такие условия, например, создаются в ОМВ при окончании выполнения статодинамики.
Для ГМВ и ПМВ, где митохондрий недостаточно, чтобы справится с образовавшимся лактатом существуют защитные механизмы выведения лактата из клетки (Poole, Halestrap, 1993) – для предотвращения вредных эффектов. Примечателен тот факт, что ГМВ имеют развитые механизмы выведения лактата, а ОМВ имеют развитые механизмы поглощения лактата из крови для утилизации (Ketchum et all., 1988; Hashimoto, Brooks,2008; Laughton et all., 2007; Hertz, Dienel, 2002;Juel, 2001) – опять признаки слаженности и продуманности системы – повод пофилософствовать.
Излишнее количество лактата имеет губительные последствия для клетки, поэтому он в первую очередь идет на утилизацию – в митохондрию, где в итоге преобразуется в пируват, далее в ацетил-КоА и вступает в цикл Кребса с образованием энергии (Hashimoto, Brooks, 2008;Hashimoto et all., 2008; Lemire et all., 2008;Laughton et all., 2007; Schurr, Payne., 2007). Соответственно, если этой энергии будет достаточно для потребностей клетки – использование глюкозы и жиров ингибируется.
Когда уровень лактата спадает – все начинается заново – дефицит АТФ стимулирует гликолиз и окисление жиров по алгоритмам, описанным выше.
Лактат – очередной форс-мажор для клетки, включающий режим скорейшего избавления от лактата: Клетки, которые имеют лактат в избытке и не могут с ним справиться самостоятельно (не хватает митохондрий или кислорода), включают механизмы выведения лактата наружу – в кровь. Клетки, которые могут использовать лактат – поглощают его извне и отправляют в митохондрии, где в первую очередь пускают его по кругам окислительного фосфолирования. Если энергии в этом случае образуется достаточно для удовлетворения энергетических запросов клетки – другие источники энергии (углеводы, жиры) ингибируются. Глобальных корректив в изменение источника энергообеспечения лактат не производит. После утилизации лактата все процессы идут своим чередом по описанным выше алгоритмам. Образование лактата и вместе с ним ионов водорода – результат работы МВ, где недостаточно митохондрий, т.е. ГМВ и некоторых ПМВ. Увеличенное количество лактата и ионов водорода ведут к мышечному отказу волокон, где превышен этот предел (именно поэтому после мышечного отказа вы можете продолжать работать с меньшей нагрузкой). В работе остаются только те волокна, которые имеют достаточное количество митохондрий, т.е. в конечном итоге – ОМВ. Это значит, что предел физической формы/выносливости для каждой стадии мышечной гипертрофии (количество МВ, количество миофибрилл) – 100% ОМВ. Парадокс отменяется.
4.Использование жиров и глюкозы для потребностей энергии в клетке – постоянно конкурирующие процессы в мышцах. В реальности они идут всегда параллельно, периодически ингибируя друг друга. Говорить только о мышечной работе и о том, как это влияет на переключение с глюкозы на жиры или обратно – не совсем корректно. Необходимо учитывать и уровень сахара в крови – т.е. питание. Если вы делаете длительную равномерную по мощности работу, при которой включены только мышцы с большим содержанием митохондрий – вы потребляете в основном жиры. Без изменения нагрузки, увеличив содержание сахара в крови (прием пищи или специальных жидкостей с наличием углеводов), – вы увеличиваете использование глюкозы, и снижаете использование жиров. Мощность вашей работы при этом не меняется. В данном контексте клетке не важно, что является источником энергии – важно наличие своевременно восстановленных молекул АТФ. Так как при этой мощности задействованы только клетки с достаточным количеством митохондрий – образования лактата не будет – клетка сможет работать дальше. После снижения уровня сахара – вновь преобладание возьмет окисление жиров.
Чувство голода – фактор не совсем уместный для сравнения с умеренной работой на жирах. Образовавшийся лактат после «дикой» нагрузки накормит мозг напрямую, печень из лактата сделает глюкозу, что тоже удовлетворит мозг (Ketchum et all., 1988; Hashimoto, Brooks,2008; Laughton et all., 2007; Hertz, Dienel, 2002;Juel, 2001). Поэтому после интенсивных тренировок какое-то время не хочется есть. И в любом случае какое-то количество жира также сразу сгорит, если нагрузка, конечно, не будет совсем короткой (до 10-15 секунд).
Мобилизованный жир после высокоинтенсивной работы в итоге придет в мышцы и клетки, которые в любом случае используют жир, даже когда вы спите, либо делаете спокойно свои дела. Тогда-то он и сгорит, если вы не ингибируете этот процесс высокоуглеводной или очень жирной пищей с избытком калорий.
При длительной работе на жирах (медленно и равномерно) глюкоза все равно будет использоваться организмом. И через какое-то время вы в любом случае также почувствуете голод, т.к. сахар в крови понизиться. Здесь как раз самое время сделать ускорение и «накормить» лактатом мозг.
При использовании гликолиза мышцами тратится гликоген, который преимущественно восстанавливается при первой возможности – например, при приеме пищи с углеводами. Периодические трата-накопление гликогена увеличивает инсулиночувствительность мышц, что имеет очень даже положительный эффект в борьбе за красивую спортивную фигуру.
Вывод №3
Говорить о преимуществе для похудения умеренной длительной работы, направленной на окисление жиров в мышечной клетке, в сравнении с использованием гликолиза (увеличенных нагрузок) – некорректно. Каждый из вариантов имеет свои преимущества. Поэтому необходимо совмещать оба способа при параллельном контроле питания. Любая физическая нагрузка полезна для сжигания жира.
Надеюсь, данная статья побудит всех заинтересованных в спорте и фитнесе, активном и здоровом образе жизни людей шире смотреть на физиологию человека, больше изучать биохимию и стараться найти подтверждение получаемым от тренера или из статей знаниям.
 fitcultura
fitcultura