Что такое оксида азота
Оксиды азота
Содержание
Список оксидов
Известны девять соединений азота с кислородом. Кроме пяти классических оксидов азота:
обнаружены ещё димер диоксида азота (NO2)2 и три малостабильных соединения: нитрозилазид N4O, тринитрамид N(NO2)3 и нитратный радикал NO3.
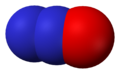
Несолеобразующий оксид. При нагревании разлагается на азот и кислород. При высоких концентрациях N2O возбуждает нервную систему («веселящий газ»). В медицине N2O применяют как слабое средство для наркоза.
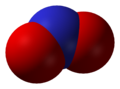
Оксид азота NO (монооксид азота) — бесцветный газ, незначительно растворим в воде. Не взаимодействует с водой, растворами кислот и щелочей. Оксид азота (II) — очень реакционное соединение, может вступать в реакции присоединения с рядом солей (нитрозосоли), с галогенами (напр., нитрозилхлорид NOCl), органическими соединениями. При обычной температуре NO соединяется с кислородом с образованием NO2. Оксид NO получают каталитическим окислением при производстве азотной кислоты.
N2O3(III)
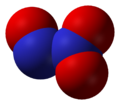
Оксид N2O3 (триоксид диазота, азотистый ангидрид) — темно-синяя жидкость, неустойчивая при обычных условиях, взаимодействует с водой, образуя азотистую кислоту HNO2.
NO2, N2O4(IV)
Оксид азота NO2 (диоксид азота) — бурый газ, токсичен, тяжелее воздуха, легко сжижается. При комнатной температуре NO2 находится в смеси с его бесцветным димером N2O4, приблизительно 1:1. Взаимодействует с водой:
и растворами щелочей:
Сильный окислитель. Многие вещества (уголь, сера, фосфор, органические соединения) могут гореть в NO2. Этот оксид окисляет SO2 до SO3, на этой реакции основан нитрозный метод получения серной кислоты. Раздражает дыхательные пути, при больших концентрациях появляется отёк легких.
N2O5(V)
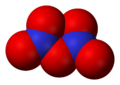
Оксид азота N2O5 (пентаоксид диазота, азотный ангидрид) — бесцветное кристаллическое вещество, легко разлагается на NO2 и О2. Сильный окислитель. В воде легко растворяется с образованием азотной кислоты HNO3.
N(NO2)3
Тринитрамид открыт в 2010 году. Является перспективным кандидатом на роль высокоэффективного ракетного топлива, однако на данный момент неизвестно, является ли устойчивой твёрдая фаза вещества.
Существует при температуре ниже −50 °C как бледно-жёлтое твёрдое вещество, выше этой температуры разлагается на N2O и N2.
Воздействие на организм
Все оксиды азота физиологически активны, относятся к третьему классу опасности.
Применение
Закись азота используется в медицине для наркоза, в пищевой промышленности в качестве пропеллента и упаковочного газа (зарегистрирована в качестве пищевой добавки E942).
См. также
Полезное
Смотреть что такое «Оксиды азота» в других словарях:
оксиды азота — оксиды азота: Смесь различных оксидов азота, образовавшихся в процессе горения топлива в цилиндре дизеля, обозначаемая символом NOx. Источник … Словарь-справочник терминов нормативно-технической документации
оксиды азота — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN nitrogen oxides Oxides formed and released in all common types of combustion; they are formed by the oxidation of atmospheric nitrogen at high temperatures. Introduced into the … Справочник технического переводчика
оксиды азота NOx — 3.6 оксиды азота NOx %: Смесь различных оксидов азота, образующихся в процессе горения топлива в цилиндре дизеля. Источник … Словарь-справочник терминов нормативно-технической документации
быстрые оксиды азота — Образуются в небольшом количестве в процессе окисления молекулярного азота во фронте горения. [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN promt nitrogen oxidations … Справочник технического переводчика
термические оксиды азота — Образуются при высокой температуре горения в результате окисления молекулярного азота, содержащегося в воздухе, по механизму Я.Б. Зельдовича, в зависимости от времени пребывания в зоне горения и концентрации кислорода. [А.С.Гольдберг. Англо… … Справочник технического переводчика
топливные оксиды азота — Образуются в процессе горения в результате окисления содержащегося в топливе азота. [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN fuel nitrogen oxidations … Справочник технического переводчика
АЗОТА ОКСИДЫ — АЗОТА ОКСИДЫ: гемиоксид N2O и монооксид NO (бесцветные газы) сесквиоксид N2O3 (синяя жидкость), диоксид NO2 (бурый газ, при обычных условиях смесь NO2 и его димера N2O4), оксид N2O5 (бесцветные кристаллы). N2O и NO несолеобразующие оксиды, N2O3 с … Большой Энциклопедический словарь
АЗОТА ОКСИДЫ — АЗОТА ОКСИДЫ: гемиоксид N2O и монооксид NO (бесцветные газы), сесквиоксид N2O3 (синяя жидкость), диоксид NO2 (бурый газ, при обычных условиях смесь NO2 и его димера N2O4), оксид N2O5 (бесцветные кристаллы). N2O и NO несолеобразующие оксиды, N2O3… … Энциклопедический словарь
Азота оксиды — N0, Оксиды азота NO, N02 в сумме в пересчете на NOj, относящиеся к классу опасности III Источник: ГОСТ Р 51206 98: Автотранспортные средства. Содержание вредных веществ в воздух … Словарь-справочник терминов нормативно-технической документации
АЗОТА ФОСФОРА СЕМЕЙСТВО — ПОДГРУППА VA. СЕМЕЙСТВО АЗОТА ФОСФОРА Тенденция изменения свойств от неметаллических до металлических, которая выявлена в подгруппах IIIA и IVA, характерна и для этой подгруппы. Переход к металличности (хотя и нерезкий) начинается с мышьяка, у… … Энциклопедия Кольера
«Лисий хвост»: 6 этапов убийства человека
«Черный юмор» химиков объясняется просто: диоксид азота – это знакомый многим рыже-бурый дым, клубящийся из труб теплоэлектростанций, нефтеперерабатывающих, нефтехимических и металлургических заводов, а также заводов, производящих азотную кислоту, различные удобрения и утилизирующих твердые бытовые отходы. Он, действительно, с виду напоминает пышный лисий хвост.
Откуда он берется? Дело в том, что в результате горения любого топлива выделяется оксид азота NO, который, будучи выпущен в атмосферу, быстро соединяется с кислородом, и превращается в диоксид азота NO2. Специалисты считают, что 90% этих зловредных веществ попадает в нашу атмосферу именно из-за человеческой деятельности, в том числе, из-за выхлопных газов автомобилей. Да-да, первым по объему выбросов диоксида азота в атмосферу в больших городах является автотранспорт!
Ученые отмечают, что именно в утренний «час пик» в воздухе над городами повышается концентрация NO, а стоит подняться солнцу и прогреть атмосферу, как в результате фотохимического окисления оксид азота превращается в еще более вредный и опасный NO2.
И не стоит радоваться, если в прохладное время года вы не видите знакомых рыжих клубов дыма или серо-желтого смога, городской воздух вам только кажется прозрачным и чистым: при низких температурах рыжий «лисий хвост» становится бесцветным, но он есть. И по-прежнему влияет на раннюю желтизну и бурые пятна на листьях деревьев, их увядание и гибель, на формирование кислотных облаков и осадков. Ведь при взаимодействии NO2 с водой образуется – азотная кислота!
Именно это свойство – образование азотной кислоты при реакции NO2 с водой – оказывает губительное воздействие на организм человека. Представьте, все наши слизистые являются влажными, т.е. содержат воду. А это значит, при вдыхании паров NO2 в горле, носоглотке, на стенках альвеол легких образуется HNO3, которая разъедает эти органы, запускается процесс разрушения человеческого организма.
Итак, 6 этапов убийства человека диоксидом азота:
1. В первые десять минут, вдыхая диоксид азота, человек ощущает специфический запах, но через 10 минут уже «принюхивается» и не улавливает его, так как умирают рецепторы запаха. И ощущение неприятной сухости в горле со временем и, как ни странно, с ростом концентрации NO2 проходит, но это коварный и ложный комфорт, ведь тем временем диоксид продолжает свое ужасное дело.
2. Показания уровня гемоглобина в крови человека падает, это чревато падением защитных сил организма.
3. Диоксид азота влияет и на зрение человека: его воздействие на слизистую глаз приводит к ухудшению способности видеть в условиях малой освещенности. Пороговая концентрация NO2, изменяющая световую чувствительность глаза, 0,14 мг/м3.
4. Стенки альвеол легких разъедаются, становятся легко проницаемыми. В результате сыворотка крови попадает в полость легких. При вдыхании воздух с жидкостью образуют пену, которая нарушает естественный газообмен и чревата развитием отека легких.
5. При контакте со щелочными средами организма NO2 образуются вредные нитраты и нитриты – те самые, которых мы так боимся в овощах и фруктах. Нитриты приводят к угнетению центральной нервной системы, расширяют кровеносные сосуды, снижают артериальное давление и пр.
6. В конце концов, нитраты в кишечнике трансформируются в канцерогенные нитрозамины, которые рано или поздно приводят к раку.
Вот что таится за таким милым и пушистым названием – «лисий хвост»!
Ученые отмечают, что затруднение дыхания здоровый человек чувствует при концентрации NO2 всего 0,056 мг/м3, а склонный к заболеваниям легких – при 0,038 мг/м3. Даже молодые здоровые люди, переехав в крупные города, замечают – участились простуды, грипп. Влияние NO2 на организм даже в малых дозах снижает его сопротивляемость и запускает вредоносные болезненные процессы. Особенно остро это проявляется у детей.
Поэтому сегодня борьба против вредоносных выбросов диоксида азота, борьба за экологию – важнейшая задача для каждого из нас!
Окислы азота
Оксиды азота — соединения азота с кислородом.
Содержание
Список оксидов
Азот образует несколько соединений с кислородом:
Оксид азота N2O — бесцветный газ со слабым запахом, растворим в воде. Не взаимодействует с водой, растворами кислот и щелочей. При нагревании разлагается на азот и кислород. При высоких концентрациях N2O возбуждает нервную систему («веселящий газ»). В медицине N2O применяют как слабое средство для наркоза.
Оксид азота NO — бесветный газ, незначительно растворим в воде. Не взаимодействует с водой, растворами кислот и щелочей. Оксид азота (II) — очень реакционноспособное соединение, может вступать в реакции присоединения с рядом солей (нитрозосоли), с галогенами (напр., нитрозилхлорид NOCl), органическими соединениями. При обычной температуре NO соединяется с кислородом с образованием NO2. Оксид NO получают каталитическим окислением при производстве азотной кислоты.
N2O3(III)
Оксид N2O3 (азотистый ангидрид) неустойчив при обычных условиях, взаимодействует с водой, образуя азотистую кислоту HNO2.
NО2, N2O4
Оксид азота NО2 — бурый газ, токсичен, тяжелее воздуха, легко сжижается. При комнатной температуре NО2 находится в смеси с его бесцветным димером N2O4, приблизительно 1:1. Взаимодействует с водой:
Сильный окислитель. Многие вещества (уголь, сера, фосфор, органические соединения) могут гореть в NО2. Этот оксид окисляет SО2 до SO3, на этой реакции основан нитрозный метод получения серной кислоты. Раздражает дыхательные пути, при больших концентрациях появляется отёк легких.
N2O5(V)
Оксид N2O5 (азотный ангидрид) — бесцветное кристаллическое вещество, легко разлагается на NО2 и О2. Сильный окислитель. В воде легко растворяется с образованием азотной кислоты HNO3.
Воздействие на организм
Применение
Оксиды азота зарегистрированы в качестве пищевой добавки E918.
См.также
Полезное
Смотреть что такое «Окислы азота» в других словарях:
Окислы азота — Смесь различных окислов азота, кроме закиси NO2, образовавшихся в цилиндре дизеля в процессе сгорания Источник: ГОСТ 24585 81: Дизел … Словарь-справочник терминов нормативно-технической документации
Окислы азота — С кислородом азот образует ряд соединений N2O5 азотный ангидрид [О над азотной кислоте см. Крепкая водка.], N2O4 или NO2 азотноватый ангидрид или двуокись азота, N2O3 азотистый ангидрид, NO окись азота, N2O закись азота. Определения Фавра,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Окислы азота (NOх) — 5. Окислы азота (NOх) Смесь окиси и двуокиси азота, содержащихся в пробе газа Примечание. В расчетах условно предполагается, что окись азота находится в виде двуокиси азота Источник … Словарь-справочник терминов нормативно-технической документации
Окислы азота и азотная кислота — 4.6. Окислы азота и азотная кислота оказывают в основном вредное влияние на активную массу отрицательных электродов, окисляя свинец в окись. Окись свинца, в свою очередь, вступая в реакцию с оставшейся неиспользованной кислотой, образует… … Словарь-справочник терминов нормативно-технической документации
ОКИСЛЫ — ОКИСЛЫ, соединения элементов с кислородом. Кислород соединяется со всеми элементами кроме благородных газов. Недавно открытая юкись фтора заполняет существовавший в отношении фтора пробел. В зависимости от степени окисления и валентности элемента … Большая медицинская энциклопедия
Азота окислы — соединения азота с кислородом. Известны N2O, NO, N2O3, NO2 (и его димер N2O4), N2O5; есть сведения о существовании NO3, не выделенного в свободном состоянии. При высокой температуре в пламени вольтовой дуги, а в природе при электроразряде … Большая советская энциклопедия
Окислы — Оксид (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам… … Википедия
Окислы — О. называются соединения простых тел с кислородом. Если придерживаться деления простых тел на две группы, на металлы и металлоиды (см.), то вообще в характере их О. можно заметить довольно ясную разницу. Тогда как типические представители первой… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Закись азота — химический состав см. Окислы азота. В медицине З. азота получила название веселящего газа: вдыхаемая в смеси с атмосферным воздухом или кислородом при обыкновенной температуре и давлении она вызывает особое состояние опьянения, уничтожающего… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Закись азота — веселящий газ, один из окислов азота (см. Азота окислы); в медицине применяют в смеси с кислородом как средство для ингаляционного Наркоза при хирургических операциях, родах, иногда при инфаркте миокарда. Назван веселящим газом английским … Большая советская энциклопедия
Оксиды азота. Азотная кислота
Оксиды азота
Известны несколько оксидов азота.
Несолеобразующие оксиды: N2O, NO
Все оксиды азота, кроме N2O, ядовитые вещества.
Оксид азота (I) N2O – это бесцветный газ со слабым запахом и сладковатым вкусом, хорошо растворимый в воде, но не взаимодействует с ней. При достаточно высокой температуре разлагается по уравнению:
В смеси с кислородом N2O используется в медицине для наркоза («веселящий» газ).
Наиболее важными являются оксиды азота (II) и (IV).
Оксид азота (II) NO – бесцветный газ, не имеет запаха. В воде малорастворим, относится, как и N2O, к несолеобразующим оксидам. Оксид азота (II) NO образуется из азота и кислорода при сильных электрических разрядах (например, во время грозы в воздухе) или при высокой температуре:
В лаборатории оксид азота (II) получают, например, при взаимодействии меди и разбавленной азотной кислоты:
Оксид азота (II) в промышленности получают каталитическим окислением аммиака и используют для получения азотной кислоты:
Оксид азота (II) на воздухе легко окисляется до оксида азота (IV):

Оксид азота (IV) NO2 – ядовитый газ бурого цвета, имеет характерный запах. Хорошо растворяется в воде. Оксид азота (IV) является смешанным оксидом, которому соответствуют две кислоты: азотистая HNO2 и азотная HNO3. Поэтому взаимодействие с водой происходит по уравнению:
При взаимодействии NO2 с водой в присутствии кислорода (на воздухе) образуется только азотная кислота:
При растворении NO2 в щелочи, например NaOH, образуются две соли (нитрат и нитрит) и вода:
В избытке кислорода образуется только нитрат натрия:
Ниже 22 0 С молекулы оксида азота (IV) NO2 легко соединяются попарно и образуют бесцветную жидкость состава N2O4, которая при охлаждении до – 10,2 0 С превращается в бесцветные кристаллы.
В лаборатории NO2 можно получить при взаимодействии, например, меди с концентрированной азотной кислотой:
В промышленности NO2 получают путем окисления NO кислородом и далее используют для получения азотной кислоты.
Оксид азота (III) N2O3 – это темно-синяя жидкость, является кислотным оксидом. При взаимодействии с водой образуется азотистая кислота:

Оксид азота (V) N2O5 – бесцветные кристаллы, хорошо растворимые в воде с образованием азотной кислоты:
Азотная кислота
Физические свойства
Азотная кислота HNO3 – бесцветная жидкость, имеет резкий запах, легко испаряется, кипит при температуре 83 0 С. При попадании на кожу азотная кислота может вызвать сильные ожоги (на коже образуется характерное желтое пятно, его сразу же следует промыть большим количеством воды, а затем нейтрализовать содой). С водой азотная кислота смешивается в любых соотношениях.
Обычно применяемая в лаборатории концентрированная азотная кислота содержит 63% HNO3. При хранении довольно легко, особенно на свету разлагается по уравнению:
Выделяющийся газ NO2 окрашивает азотную кислоту в бурый цвет.
Химические свойства
Кислотно – основные свойства
Азотная кислота – одна из наиболее сильных кислот. В водных растворах она полностью диссоциирована на ионы:
Как и все кислоты, она реагирует:
в) с солями более слабых кислот:
Окислительно – восстановительные свойства

Концентрированная HNO3 при взаимодействии с наиболее активными металлами (до Al в ряду напряжений) восстанавливается до N2O. Например:
Концентрированная HNO3 при взаимодействии с менее активными металлами (Ni, Cu, Ag, Hg) восстанавливается до NO2. Например:
Аналогично концентрированная азотная кислота реагирует с некоторыми неметаллами. Неметалл при этом окисляется до оксокислоты. Например:
Следует отметить, что концентрированная HNO3 пассивирует такие металлы, как Fe, Al, Cr. Сущность пассивирования заключается в образовании на поверхности металла тонкой, но очень плотной оксидной плёнки, предохраняющей металл от дальнейшего взаимодействия с кислотой; например:
Разбавленная HNO3 реагирует с наиболее активными металлами (до Al) с образованием аммиака или нитрата аммония NH4NO3:
При взаимодействии разбавленной азотной кислоты с менее активными металлами образуется оксид азота (II) NO:
Таким же образом разбавленная HNO3 взаимодействует с некоторыми неметаллами:

Получение
В лаборатории азотную кислоту получают при взаимодействии безводных нитратов с концентрированной серной кислотой:
В промышленности получение азотной кислоты идет в три стадии:
Применение
Азотную кислоту применяют для получения азотных удобрений, лекарственных и взрывчатых веществ.
Соли азотной кислоты
Соли азотной кислоты называются нитратами. Нитраты калия, натрия, аммония и кальция называются селитрами. Селитры применяют как минеральные азотные удобрения, так как азот является одним из основных элементов питания растений.
Все соли азотной кислоты хорошо растворимы в воде.
Соли азотной кислоты, как и она сама, являются сильными окислителями.
При нагревании все нитраты разлагаются с выделением кислорода, характер других продуктов разложения зависит от положения металла в ряду напряжений:
*на изображении записи кристаллы нитрата меди (II)
Окись азота
Окись азота
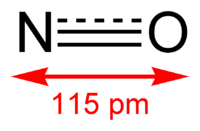
| Оксид азота(II) | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Оксид азота(II) |
| Химическая формула | NO |
| Отн. молек. масса | 30.0061 а. е. м. |
| Молярная масса | 30.0061 г/моль |
| Физические свойства | |
| Плотность вещества | 0.00134 (газ) г/см³ |
| Состояние (ст. усл.) | бесцветный газ |
| Термические свойства | |
| Температура плавления | −163.6 °C |
| Температура кипения | −151.7 °C |
| Энтальпия (ст. усл.) | 81 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 0,01 г/100 мл |
| Классификация | |
| номер CAS | [10102-43-9] |
Окси́д азо́та (II) NO (моноксид азота, окись азота, нитрозил-радикал) — несолеобразующий оксид азота. Он представляет собой бесцветный газ, плохо растворимый в воде. Сжижается с трудом; в жидком и твёрдом виде имеет голубой цвет.
Наличие неспаренного электрона обусловливает склонность NO к образованию слабосвязанных димеров N2O2. Это непрочные соединения с ΔH° димеризации = 17 кДж. Жидкий оксид азота (II) на 25% состоит из молекул N2O2, а твердый оксид целиком состоит из них.
Содержание
Получение
Оксид азота(II) — единственный из оксидов азота, который можно получить непосредственно из свободных элементов соединением азота с кислородом при высоких температурах (1200—1300 °C) или в электрическом разряде. В природе он образуется в атмосфере при грозовых разрядах:
и тотчас же реагирует с кислородом:
При понижении температуры оксид азота(II) разлагается на азот и кислород, но если температура падает резко, то не успевший разложиться оксид существует достаточно долго: при низкой температуре скорость распада невелика. Такое резкое охлаждение называется «закалкой» и используется при одном из способов получения азотной кислоты.
В лаборатории его обычно получают взаимодействием 30%-ной HNO3 с некоторыми металлами, например, с медью:
Более чистый, не загрязнённый примесями NO можно получить по реакциям:
Промышленный способ основан на окислении аммиака при высокой температуре и давлении при участии Pt, Cr2O3 (как катализаторов):
Химические свойства
При комнатной температуре и атмосферном давлении окисление NO кислородом воздуха происходит мгновенно:
Для NO характерны также реакции присоединения галогенов с образованием нитрозилгалогенидов, в этой реакции NO проявляет свойства восстановителя:
В присутствии более сильных восстановителей NO проявляет окислительные свойства:
В воде NO мало растворим и с ней не реагирует, являясь несолеобразующим оксидом.
Физиологическое действие
Как и все оксиды азота (кроме N2O), NO — токсичен, при вдыхании поражает дыхательные пути.
За два последних десятилетия было установлено, что эта молекула NO обладает широким спектром биологического действия, которое условно можно разделить на регуляторное, защитное и вредное. NO, являясь одним из мессенджеров, участвует в регуляции систем внутри- и межклеточной сигнализации. Оксид азота, производимый клетками эндотелия сосудов, отвечает за расслабление гладких мышц сосудов и их расширение(вазодилатацию), предотвращает агрегацию тромбоцитов и адгезию нейрофилов к эндотелию, участвует в различных процессах в нервной, репродуктивной и иммунной системах. NO также обладает цитотоксическими и цитостатическими свойствами. Клетки-киллеры иммунной системы используют оксид азота для уничтожения бактерий и клеток злокачественных опухолей. С нарушением биосинтеза и метаболизма NO связаны такие заболевания, как ассенциальная артериальная гипертензия, ишемическая болезнь сердца, инфаркт миокарда, первичная легочная гипертензия, бронхиальная астма, невротическая депрессия, эпилепсия, нейродегенеративные заболевания (болезнь Альцгеймера, болезнь Паркинсона), сахарный диабет, импотенция и др.
Клиренс NO (скорость очищения крови от NO в процессе его химических превращений) происходит путем образования нитритов и нитратов и составляет в среднем не более 5 секунд. В клиренс могут быть вовлечены промежуточные ступени, связанные со взаимодействием с супероксидом или с гемоглобином с образованием пероксинитрита. Оксид азота может быть восстановлен NO-редуктазой – ферментом, тесно связанным с NO-синтазой.
Применение
Полезное
Смотреть что такое «Окись азота» в других словарях:
ОКИСЬ АЗОТА — ОКИСЬ АЗОТА, см. монооксид АЗОТА … Научно-технический энциклопедический словарь
окись азота — — [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN nitric oxide … Справочник технического переводчика
окись азота — azoto oksidas statusas T sritis ekologija ir aplinkotyra apibrėžtis Azoto junginys su deguonimi: N₂O, NO, NO₂, N₂O₃, N₂O₄, N₂O₅. atitikmenys: angl. nitric oxide; nitrogen monoxide vok. Stickoxid, n; Stickstoffmonoxid, n rus. окись азота, f … Ekologijos terminų aiškinamasis žodynas
Азота окислы — соединения азота с кислородом. Известны N2O, NO, N2O3, NO2 (и его димер N2O4), N2O5; есть сведения о существовании NO3, не выделенного в свободном состоянии. При высокой температуре в пламени вольтовой дуги, а в природе при электроразряде … Большая советская энциклопедия
азота окись — azoto(II) oksidas statusas T sritis chemija formulė NO atitikmenys: angl. nitrogen monoxide; nitrogen(II) oxide rus. азота окись; азота(II) оксид ryšiai: sinonimas – azoto monoksidas … Chemijos terminų aiškinamasis žodynas
азота(II) оксид — azoto(II) oksidas statusas T sritis chemija formulė NO atitikmenys: angl. nitrogen monoxide; nitrogen(II) oxide rus. азота окись; азота(II) оксид ryšiai: sinonimas – azoto monoksidas … Chemijos terminų aiškinamasis žodynas
Окись этилена — Окись этилена … Википедия
Окись — Оксид (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам… … Википедия
Окись углерода — Монооксид углерода Общие Систематическое наименование Монооксид углерода Химическая формула … Википедия
Окислы азота — С кислородом азот образует ряд соединений N2O5 азотный ангидрид [О над азотной кислоте см. Крепкая водка.], N2O4 или NO2 азотноватый ангидрид или двуокись азота, N2O3 азотистый ангидрид, NO окись азота, N2O закись азота. Определения Фавра,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона