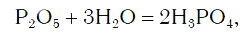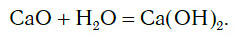Что такое оксиды и как они образуются
Оксиды. Классификация, свойства, получение, применение.

Классификация оксидов
Все оксиды, по способности образовать соли, можно разделить на две группы:
В свою очередь, солеобразующие оксиды подразделяют на 3 группы:
Данная классификация основана на проявлении оксидами определенных химических свойств. Так, основным оксидам соответствуют основания, а кислотным оксидам — кислоты. Кислотные оксиды реагируют с основными оксидами с образованием соответствующей соли, как если бы реагировали основание и кислота, соответствующие данным оксидам:

CO2 – оксид углерода (IV)
Физические свойства оксидов
Оксиды весьма разнообразны по своим физическим свойствам. Они могут быть как жидкостями (Н2О), так и газами (СО2, SO3) или твёрдыми веществами (Al2O3, Fe2O3). Приэтом оснОвные оксиды, как правило, твёрдые вещества. Окраску оксиды также имеют самую разнообразную — от бесцветной (Н2О, СО) и белой (ZnO, TiO2) до зелёной (Cr2O3) и даже чёрной (CuO).
Химические свойства оксидов
Основные оксиды
Некоторые оксиды реагируют с водой с образованием соответствующих гидроксидов (оснований):


Кислотные оксиды
Кислотные оксиды в реакции с водой образуют кислоты:
Кислотные оксиды взаимодействуют с основными оксидами, образую соли:


Амфотерные оксиды
Как уже говорилось ранее, амфотерные оксиды, в зависимости от условий, могут проявлять как кислотные, так и основные свойства. Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей: 
Получение оксидов
Оксиды можно получить самыми разнообразными способами, мы приведем основные из них.
Большинство оксидов можно получить непосредственным взаимодействием кислорода с химических элементом: 


Применение оксидов

Оксиды железа используют для получения красок, производства электродов, хотя больше всего оксидов железа восстанавливают до металлического железа в металлургии.
Оксид кальция, также известный как негашеная известь, применяют в строительстве. Оксиды цинка и титана имеют белый цвет и нерастворимы в воде, потому стали хорошим материалом для производства красок — белил.
Оксид кремния SiO2 является основным компонентом стекла. Оксид хрома Cr2O3 применяют для производства цветных зелёных стекол и керамики, а за счёт высоких прочностных свойств — для полировки изделий (в виде пасты ГОИ).
Оксид углерода CO2, который выделяют при дыхании все живые организмы, используется для пожаротушения, а также, в виде сухого льда, для охлаждения чего-либо.
Оксиды: классификация, получение и химические свойства
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов
Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом :
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
Калий, цезий, рубидий образуют преимущественно пероксиды состава MeO2:
Примечания : металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
Железо также горит с образованием железной окалины — оксида железа (II, III):
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000 о С), либо под действием электрического разряда, и только до оксида азота (II):
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Химические свойства основных оксидов
Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
Урок №43. Оксиды: классификация, номенклатура, свойства, получение, применение
Сегодня мы начинаем подробное знакомство с важнейшими классами неорганических соединений. Неорганические вещества по составу делятся, как вы уже знаете, на простые (металлы и неметаллы) и сложные:
А – кислотный остаток
ОН – гидроксильная группа
Сложные неорганические вещества подразделяют на четыре класса: оксиды, кислоты, основания, соли. Мы начинаем с класса оксидов.
ОКСИДЫ
оксид углерода ( II )
оксид марганца (VII )
Классификация оксидов
Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или безразличные.
4). Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II (Например, N 2 O, NO, CO).
Вывод: характер свойств оксидов в первую очередь зависит от валентности элемента.
Например, оксиды хрома:
Классификация по растворимости в воде
Кислотные оксиды
(не растворим в воде)
Основные оксиды
В воде растворяются только оксиды щелочных и щелочноземельных металлов
Амфотерные оксиды
С водой не взаимодействуют.
В воде не растворимы
Выполните задания:
1. Выпишите отдельно химические формулы солеобразующих кислотных и основных оксидов.
Выпишите оксиды и классифицируйте их.
Физические свойства оксидов
Химические свойства оксидов
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ
1. Основной оксид + Кислотный оксид = Соль (р. соединения)
3K 2 O + 2H 3 PO 4 = 2K 3 PO 4 + 3H 2 O
Na 2 O + H 2 O = 2NaOH
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ
2. Кислотный оксид + Основание = Соль + Н 2 О (р. обмена)
P 2 O 5 + 6KOH = 2K 3 PO 4 + 3H 2 O
3. Основной оксид + Кислотный оксид = Соль (р. соединения)
4. Менее летучие вытесняют более летучие из их солей
CaCO 3 + SiO 2 = CaSiO 3 +CO 2
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ
Взаимодействуют как с кислотами, так и со щелочами.
ZnO + 2 HCl = ZnCl 2 + H 2 O
ZnO + 2 NaOH + H 2 O = Na 2 [Zn(OH) 4 ] ( в растворе)
ZnO + 2 NaOH = Na 2 ZnO 2 + H 2 O (при сплавлении)
Применение оксидов
Некоторые оксиды не растворяются в воде, но многие вступают с водой в реакции соединения:
В результате часто получаются очень нужные и полезные соединения. Например, H 2 SO 4 – серная кислота, Са(ОН) 2 – гашеная известь и т.д.
Если оксиды нерастворимы в воде, то люди умело используют и это их свойство. Например, оксид цинка ZnO – вещество белого цвета, поэтому используется для приготовления белой масляной краски (цинковые белила). Поскольку ZnO практически не растворим в воде, то цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Нерастворимость и неядовитость позволяют использовать этот оксид при изготовлении косметических кремов, пудры. Фармацевты делают из него вяжущий и подсушивающий порошок для наружного применения.
Такими же ценными свойствами обладает оксид титана (IV) – TiO 2 . Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. TiO 2 не растворяется не только в воде, но и в кислотах, поэтому покрытия из этого оксида особенно устойчивы. Этот оксид добавляют в пластмассу для придания ей белого цвета. Он входит в состав эмалей для металлической и керамической посуды.
Оксид хрома (III) – Cr 2 O 3 – очень прочные кристаллы темно-зеленого цвета, не растворимые в воде. Cr 2 O 3 используют как пигмент (краску) при изготовлении декоративного зеленого стекла и керамики. Известная многим паста ГОИ (сокращение от наименования “Государственный оптический институт”) применяется для шлифовки и полировки оптики, металлических изделий, в ювелирном деле.
Классификация неорганических веществ
Среди простых веществ выделяют металлы и неметаллы. Среди сложных: оксиды, основания, кислоты и соли. Классификация неорганических веществ построена следующим образом:
Большинство химических свойств мы изучим по мере продвижения по периодической таблице Д.И. Менделеева. В этой статье мне хотелось бы подчеркнуть ряд принципиальных деталей, которые помогут в дальнейшем при изучении химии.
Оксиды
Все оксиды подразделяются на солеобразующие и несолеобразующие. Солеобразующие имеют соответствующие им основания и кислоты (в той же степени окисления (СО)!) и охотно вступают в реакции солеобразования. К ним относятся, например:
Солеобразующие оксиды, в свою очередь, делятся на основные, амфотерные и кислотные.
Основным оксидам соответствуют основания в той же СО. В химических реакциях основные оксиды проявляют основные свойства, образуются исключительно металлами. Примеры: Li2O, Na2O, K2O, Rb2O CaO, FeO, CrO, MnO.
Основные оксиды взаимодействуют с водой с образованием соответствующего основания (реакцию идет, если основание растворимо) и с кислотными оксидами и кислотами с образованием солей. Между собой основные оксиды не взаимодействуют.
Li2O + H2O → LiOH (основный оксид + вода → основание)
Здесь не происходит окисления/восстановления, поэтому сохраняйте исходные степени окисления атомов.
Эти оксиды действительно имеют двойственный характер: они проявляют как кислотные, так и основные свойства. Примеры: BeO, ZnO, Al2O3, Fe2O3, Cr2O3, MnO2, PbO, PbO2, Ga2O3.
С водой они не взаимодействуют, так как продукт реакции, основание, получается нерастворимым. Амфотерные оксиды реагируют как с кислотами и кислотными оксидами, так и с основаниями и основными оксидами.
ZnO + KOH + H2O → K2[Zn(OH)4] (амф. оксид + основание = комплексная соль)
ZnO + N2O5 → Zn(NO3)2 (амф. оксид + кисл. оксид = соль; СО азота сохраняется в ходе реакции)
Fe2O3 + HCl → FeCl3 + H2O (амф. оксид + кислота = соль + вода; обратите внимание на то, что СО Fe = +3 не меняется в ходе реакции)
Проявляют в ходе химических реакций кислотные свойства. Образованы металлами и неметаллами, чаще всего в высокой СО. Примеры: SO2, SO3, P2O5, N2O3, NO2, N2O5, SiO2, MnO3, Mn2O7.
Кислотные оксиды вступают в реакцию с основными и амфотерными, реагируют с основаниями. Реакции между кислотными оксидами не характерны.
SO2 + Na2O → Na2SO3 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +4)
SO3 + Li2O → Li2SO4 (кисл. оксид + осн. оксид = соль; сохраняем СО S = +6)
P2O5 + NaOH → Na3PO4 + H2O (кисл. оксид + основание = соль + вода)
Реакции несолеобразующих оксидов с основаниями, кислотами и солеобразующими оксидов редки и не приводят к образованию солей. Некоторые из несолеобразующих оксидов используют в качестве восстановителей:
FeO + CO → Fe + CO2 (восстановление железа из его оксида)
Основания
Основания классифицируются по количеству гидроксид-ионов в молекуле на одно-, двух- и трехкислотные.
Так же, как и оксиды, основания различаются по свойствам. Все основания хорошо реагируют с кислотами, даже нерастворимые основания способны растворяться в кислотах. Также нерастворимые основания при нагревании легко разлагаются на воду и соответствующий оксид.
Mg(OH)2 → (t) MgO + H2O (при нагревании нерастворимые основания легко разлагаются)
Если в ходе реакции основания с солью выделяется газ, выпадает осадок или образуется слабый электролит (вода), то такая реакция идет. Нерастворимые основания с солями почти не реагируют.
Ba(OH)2 + NH4Cl → BaCl2 + NH3 + H2O (в ходе реакции образуется нестойкое основание NH4OH, которое распадается на NH3 и H2O)
KOH + BaCl2 ↛ реакция не идет, так как в продуктах нет газа/осадка/слабого электролита (воды)
В растворах щелочей pH > 7, поэтому лакмус окрашивает их в синий цвет.
Al(OH)3 + HCl → AlCl3 + H2O (амф. гидроксид + кислота = соль + вода)
Al(OH)3 + KOH → K[Al(OH)4] (амф. гидроксид + основание = комплексная соль)
При нагревании до высоких температур комплексные соли не образуются.
Кислоты
Кислоты отлично реагируют с основными оксидами, основаниями, растворяя даже те, которые выпали в осадок (реакция нейтрализации). Также кислоты способны вступать в реакцию с теми металлами, которые стоят в ряду напряжений до водорода (то есть способны вытеснить его из кислоты).
Zn + HCl → ZnCl2 + H2↑ (реакция идет, так как цинк стоил в ряду активности левее водорода и способен вытеснить его из кислоты)
Cu + HCl ↛ (реакция не идет, так как медь расположена в ряду активности правее водорода, менее активна и не способна вытеснить его из кислоты)
Все кислоты подразделяются на сильные и слабые. Напомню, что мы составили подробную таблицу сильных и слабых кислот (и оснований!) в теме гидролиз. В реакции из сильной кислоты (соляной) можно получить более слабую, например, сероводородную или угольную кислоту.
В завершении подтемы кислот предлагаю вам вспомнить названия основных кислот и их кислотных остатков.
Блиц-опрос по теме Классификация неорганических веществ
Урок 31. Оксиды
В уроке 31 «Оксиды» из курса «Химия для чайников» познакомимся с оксидами их классификацией, а также узнаем где они встречаются в природе.
Все неорганические вещества делятся на несколько классов, важнейшими из которых являются оксиды, кислоты, основания и соли. Первоначальные сведения об этих веществах вы уже получили. Теперь вам предстоит познакомиться с ними более подробно и систематизировать свои знания.
Вы уже знаете, что самым распространенным элементом на Земле является кислород. Его атомы, соединяясь с атомами других элементов, образуют огромное количество сложных неорганических веществ, среди которых важное место занимают оксиды.
Состав оксидов
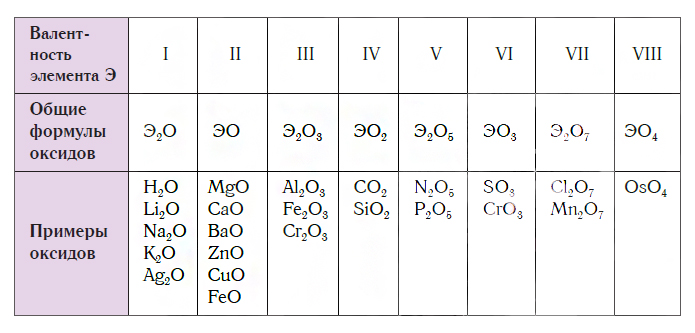
В состав любого оксида входят атомы двух химических элементов, один из которых — кислород, например: Н2О, Al2O3, Р2О5, CuO, Cl2O7. Всего известно около трехсот разных оксидов. Их общая химическая формула — ЭxOy, где буква Э обозначает символ химического элемента, образующего оксид, О — символ кислорода, а буквы x и y — индексы, обозначающие число атомов в молекулах или в формульных единицах оксидов.
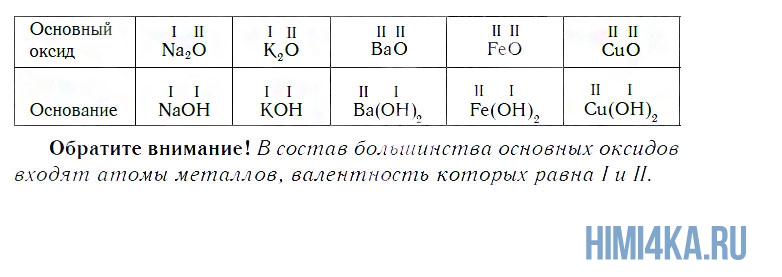
Поскольку валентность атомов кислорода в оксидах всегда равна II, а валентность атомов других элементов принимает значения от I до VIII, состав оксидов выражается формулами, приведенными в следующей таблице.
Классификация оксидов
Поскольку оксидов известно очень много, возникает необходимость классификации этих веществ по их химическим свойствам, т. е. по способности превращаться в другие вещества.
Вы уже знаете, что оксиды могут реагировать с водой, превращаясь при этом в соединения двух типов — кислоты и основания. Так, например, оксид фосфора(V) P2O5, присоединяя воду, превращается в кислоту H3PO4:
а оксид кальция CaO, взаимодействуя с водой, превращается в основание Ca(OH)2:
Иначе говоря, оксиду фосфора соответствует кислота, а оксиду кальция соответствует основание. Исходя из этого, оксиды можно разделить на две большие группы — кислотные и основные оксиды.
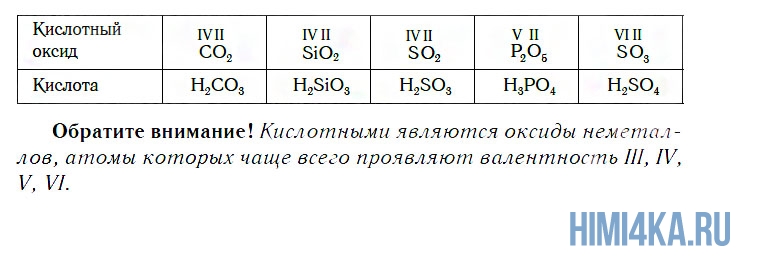
К кислотным относятся оксиды, которым соответствуют кислоты. Наряду с Р2О5, кислотными являются также оксиды: CO2, SiO2, SO2, N2O5, SO3 и некоторые другие. Всем им соответствуют кислоты.
К основным относятся оксиды, которым соответствуют основания. Кроме СaO, основными являются оксиды: Na2O, K2O, BaO, FeO, CuO и ряд других. Всем этим оксидам соответствуют основания.
Оксиды в природе
Оксиды содержатся в каждой из трех оболочек нашей планеты — в атмосфере, гидросфере, литосфере.
Самым распространенным оксидом в атмосфере и гидросфере является вода H2O, а в литосфере — оксид кремния(IV) SiO2, встречающийся в виде красивых кристаллов кварца (рис. 116) и кварцевого песка.
Краткие выводы урока:
Надеюсь урок 31 «Оксиды» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.