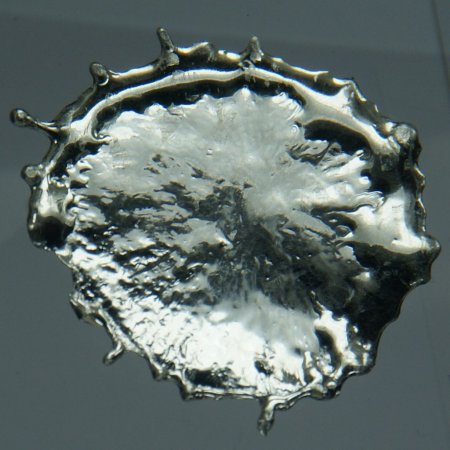
Что такое олово в химии
Олово: степени окисления и реакции с ним
Химические свойства олова
Олово – это легкий металл с атомным номером 50, который находится в 14-й группе периодической системы элементов. Этот элемент был известен еще в древности и считался одним из самых редких и дорогих металлов, поэтому изделия из олова могли позволить себе самые богатые жители Римской Империи и Древней Греции. Из олова изготавливали специальную бронзу, которой пользовались еще в третьем тысячелетии до нашей эры. Тогда бронза была самым прочным и популярным сплавом, а олово служило одной из примесей и использовалось более двух тысяч лет.
На латыни этот металл называли словом «stannum», что означает стойкость и прочность, однако таким названием ранее обозначался сплав свинца и серебра. Только в IV веке этим словом начали называть само олово. Само же название «олово» имеет множество версий происхождения. В Древнем Риме сосуды для вина делались из свинца. Можно предположить, что оловом называли материал свинец, из которого изготавливали сосуды для хранения напитка оловина, употребляемого древними славянами.
В природе этот металл встречается редко, по распространенности в земной коре олово занимает всего лишь 47-е место и добывается из касситерита, так называемого оловянного камня, который содержит около 80 процентов этого металла.
Применение в промышленности
Так как олово является нетоксичным и весьма прочным металлом, он применяется в сплавах с другими металлами. По большей части его используют для изготовления белой жести, которая применяется в производстве банок для консервов, припоев в электронике, а также для изготовления бронзы.
Физические свойства олова
Этот элемент представляет собой металл белого цвета с серебристым отблеском.
Если нагреть олово, можно услышать потрескивание. Этот звук обусловлен трением кристалликов друг о друга. Также характерный хруст появится, если кусок олова просто согнуть.
Олово весьма пластично и ковко. В классических условиях этот элемент существует в виде «белого олова», которое может модифицироваться в зависимости от температуры. Например, на морозе белое олово превратится в серое и будет иметь структуру, схожую со структурой алмаза. Кстати, серое олово очень хрупкое и буквально на глазах рассыпается в порошок. В связи с этим в истории есть терминология «оловянная чума».
Раньше люди не знали о таком свойстве олова, поэтому из него изготавливались пуговицы и кружки для солдат, а также прочие полезные вещи, которые после недолгого времени на морозе превращались в порошок. Некоторые историки считают, что именно из-за этого свойства олова снизилась боеспособность армии Наполеона.
Получение олова
Основным способом получения олова является восстановление металла из руды, содержащей оксид олова(IV) с помощью угля, алюминия или цинка.
Особо чистое олово получают электрохимическим рафинированием или методом зонной плавки.
Химические свойства олова
При комнатной температуре олово довольно устойчиво к воздействию воздуха или воды. Это объясняется тем, что на поверхности металла возникает тонкая оксидная пленка.
На воздухе олово начинает окисляться только при температуре свыше 150 °С:
Если олово нагреть, этот элемент будет реагировать с большинством неметаллов, образуя соединения со степенью окисления +4 (она более характерна для этого элемента):
Взаимодействие олова и концентрированной соляной кислоты протекает довольно медленно:
Sn + 4HCl → H₂[SnCl₄] + H₂
С концентрированной серной кислотой олово реагирует очень медленно, тогда как с разбавленной в реакцию не вступает вообще.
Очень интересна реакция олова с азотной кислотой, которая зависит от концентрации раствора. Реакция протекает с образованием оловянной кислоты, H₂SnO₃, которая представляет собой белый аморфный порошок:
3Sn + 4HNO₃ + nH₂O = 3H₂SnO₃·nH₂O + 4NO
Если же олово смешать с разбавленной азотной кислотой, этот элемент будет проявлять металлические свойства с образованием нитрата олова:
4Sn + 10HNO₃ = 4Sn(NO₃)₂ + NH₄NO₃ + 3H₂O
Нагретое олово нагреть может реагировать со щелочами с выделением водорода:
Sn + 2KOH + 4H₂O = K₂[Sn(OH)₆] + 2H₂
Здесь вы найдете безопасные и очень красивые эксперименты с оловом.
Степени окисления олова
В простом состоянии степень окисления олова равняется нулю. Также Sn может иметь степень окисления +2: оксид олова(II) SnO, хлорид олова(II) SnCl₂, гидроксид олова(II) Sn(OH)₂. Степень окисления +4 наиболее характерна для оксида олова(IV) SnO₂, галогенидах(IV), например хлорид SnCl₄, сульфид олова(IV) SnS₂, нитрид олова(IV) Sn₃N₄.
Олово

СТРУКТУРА
СВОЙСТВА
Предел прочности при растяжении 16,6 Мн/м 2 (1,7 кгс/мм 2 ); относительное удлинение 80-90%; твердость по Бринеллю 38,3-41,2 Мн/м 2 (3,9-4,2 кгс/мм 2 ). При изгибании прутков олова слышен характерный хруст от взаимного трения кристаллитов.
Чистое олово обладает низкой механической прочностью при комнатной температуре (можно согнуть оловянную палочку, при этом слышится характерный треск, обусловленный трением отдельных кристаллов друг о друга) и поэтому редко используется.
ЗАПАСЫ И ДОБЫЧА

В России запасы оловянных руд расположены в Чукотском автономном округе (Пыркакайские штокверки; рудник/посёлок Валькумей, Иультин — разработка месторождений закрыта в начале 1990-х годов), в Приморском крае (Кавалеровский район), в Хабаровском крае (Солнечный район, Верхнебуреинский район (Правоурмийское месторождение)), в Якутии (месторождение Депутатское) и других районах.
В процессе производства рудоносная порода (касситерит) подвергается дроблению до размеров частиц в среднем
10 мм, в промышленных мельницах, после чего касситерит за счет своей относительно высокой плотности и массы отделяется от пустой породы вибрационно-гравитационным методом на обогатительных столах. В дополнение применяется флотационный метод обогащения/очистки руды. Таким образом удается повысить содержание олова в руде до 40-70 %. Далее проводят обжиг концентрата в кислороде для удаления примесей серы и мышьяка. Полученный концентрат оловянной руды выплавляется в печах. В процессе выплавки восстанавливается до свободного состояния посредством применения в восстановлении древесного угля, слои которого укладываются поочередно со слоями руды, или алюминием (цинком) в электропечах: SnO2 + C = Sn + CO2. Особо чистое олово полупроводниковой чистоты готовят электрохимическим рафинированием или методом зонной плавки.
ПРОИСХОЖДЕНИЕ
Основная форма нахождения олова в горных породах и минералах — рассеянная (или эндокриптная). Однако олово образует и минеральные формы, и в этом виде часто встречается не только как акцессорий в кислых магматических породах, но и образует промышленные концентрации преимущественно в окисной (касситерит SnO2) и сульфидной (станнин) формах.
В общем можно выделить следующие формы нахождения олова в природе:
На сульфидных месторождениях олово входит как изоморфный элемент в сфалериты (Силинское месторождение, Россия, Приморье), халькопириты (Дубровское месторождение, Россия, Приморье), пириты. Высокие концентрации олова выявлены в пирротине грейзенов Смирновского месторождения (Россия, Приморье). Считается, что из-за ограниченного изоморфизма происходит распад твёрдых растворов с микровыделениями Cu2 +1 Fe +2 SnS4 или тиллита PbSnS2 и других минералов.
ПРИМЕНЕНИЕ

Дисульфид олова SnS2 применяют в составе красок, имитирующих позолоту («поталь»).
Искусственные радиоактивные ядерные изомеры олова 117m Sn и 119m Sn — источники гамма-излучения, являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
Интерметаллические соединения олова и циркония обладают высокими температурами плавления (до 2000 °C) и стойкостью к окислению при нагревании на воздухе и имеют ряд областей применения.
Олово является важнейшим легирующим компонентом при получении конструкционных сплавов титана.
Двуокись олова — очень эффективный абразивный материал, применяемый при «доводке» поверхности оптического стекла.
Смесь солей олова — «жёлтая композиция» — ранее использовалась как краситель для шерсти.
Олово применяется также в химических источниках тока в качестве анодного материала, например: марганцево-оловянный элемент, окисно-ртутно-оловянный элемент. Перспективно использование олова в свинцово-оловянном аккумуляторе; так, например, при равном напряжении, по сравнению со свинцовым аккумулятором свинцово-оловянный аккумулятор обладает в 2,5 раза большей емкостью и в 5 раз большей энергоплотностью на единицу объёма, внутреннее сопротивление его значительно ниже.
Исследуются изолированные двумерные слои олова (станен), созданные по аналогии с графеном.
Олово: свойства, интересные факты, применение
Олово — легкий цветной металл, простое неорганическое вещество. В таблице 
Металл относится к рассеянным элементам, и не самым распространенным на земле. В природе он встречается в виде различных минералов. Самые важные для промышленной добычи: касситерит — оловянный камень, и станнин — оловянный колчедан. Добывают олово из руд, как правило, содержащих не более 0,1 процента этого вещества.
Свойства олова
Легкий мягкий пластичный металл серебристо-белого цвета. Имеет три структурные модификации, переходит из состояния α-олово (серое олово) в β-олово (белое олово) при температуре +13,2 °С, а в состояние γ-олово при t +161 °С. Модификации весьма сильно отличаются своими свойствами. α-олово — серый порошок, который относят к полупроводникам, β-олово («обычное олово» при комнатной температуре) — серебристый ковкий металл, γ-олово — белый хрупкий металл.
В химических реакциях олово проявляет полиморфизм, то есть кислотные и оснóвные свойства. Реактив достаточно инертный на воздухе и в воде, так как быстро покрывается прочной оксидной пленкой, защищающей его от коррозии.
Олово легко вступает в реакции с неметаллами, с трудом — с концентрированной серной и соляной кислотой; с этими кислотами в разбавленном состоянии не взаимодействует. С концентрированной и разбавленной азотной кислотой реагирует, но по-разному. В одном случае получается оловянная кислота, в другом — нитрат олова. Со щелочами вступает в реакции только при нагревании. С кислородом образует два оксида, со степенью окисления 2 и 4. Является основой целого класса оловоорганических соединений.
Воздействие на человеческий организм

Пары олова и его аэрозольные частицы опасны, так как при длительном и регулярном вдыхании оно может вызвать заболевания легких; ядовиты также органические соединения олова, поэтому работать с ним и его соединениями надо в средствах защиты.
Такое соединение олова как оловянистый водород, SnH4, может служить причиной тяжелых отравлений при употреблении в пищу очень старых консервов, в которых органические кислоты вступили в реакцию со слоем олова на стенках банки (жесть, из которой делают консервные банки — это тонкий лист железа, покрытый с двух сторон оловом). Отравление оловянистым водородом может быть даже смертельным. К его симптомам относятся судороги и чувство потери равновесия.
Это интересно
При понижении температуры воздуха ниже 0 °С белое олово переходит в модификацию серого олова. При этом объем вещества увеличивается почти на четверть, оловянное изделие трескается и превращается в серый порошок. Это явление стали называть «оловянной чумой».
Некоторые историки считают, что «оловянная чума» послужила одной из причин поражения армии Наполеона в России, так как превратила пуговицы на одежде французских солдат и пряжки для ремней в порошок, и тем самым оказала на армию деморализующее влияние.
А вот настоящий исторический факт: экспедиция английского полярного исследователя Роберта Скотта к Южному полюсу закончилась трагически в том числе потому, что все их топливо вылилось из запаянных оловом баков, они лишились своих мотосаней, а дойти пешком сил не хватило.
Применение
— Большая часть выплавляемого олова используется в металлургии для 
— Олово в виде фольги (станиоль) востребовано в производстве конденсаторов, посуды, изделий искусства, органных труб.
— Используется для легирования конструкционных титановых сплавов; для нанесения антикоррозионных покрытий на изделия из железа и иных металлов (лужение).
— Сплав с цирконием обладает высокой тугоплавкостью и стойкостью к коррозии.
— Оксид олова (II) — используется в качестве абразива при обработке оптических стекол.
— Входит в состав материалов, применяющихся для изготовления аккумуляторов.
— При производстве красок «под золото», красителей для шерсти.
— Искусственные радиоизотопы олова применяются как источник γ-излучения в спектроскопических методах исследования в биологии, химии, материаловедении.
— Двухлористое олово (оловянную соль) используют в аналитической химии, в текстильной индустрии для крашения, в химпроме для органического синтеза и производства полимеров, в нефтепереработке — для обесцвечивания масел, в стекольной отрасли — для обработки стекол.
— Олово борфтористое применяется для изготовления жести, бронзы, других нужных промышленности сплавов; для лужения; ламинирования.
Олово
| Олово | |
|---|---|
| Серебристо-белый мягкий, пластичный металл (β-олово) или серый порошок (α-олово) | |
 |
(молярная масса)
(первый электрон)
Содержание
История
Олово было известно человеку уже в IV тысячелетии до н. э. Этот металл был малодоступен и дорог, поэтому изделия из него редко встречаются среди римских и греческих древностей. Об олове есть упоминания в Библии, Четвёртой Книге Моисея. Олово является (наряду с медью) одним из компонентов оловяннистой бронзы, изобретённой в конце или середине III тысячелетия до н. э. Поскольку бронза являлась наиболее прочным из известных в то время металлов и сплавов, олово было «стратегическим металлом» в течение всего «бронзового века», более 2000 лет (очень приблизительно: XXXV—XI века до н. э.).
Чистое олово получено не ранее XII в., о нем упоминает в своих трудах Р. Бэкон. До этого олово всегда содержало переменное количество свинца. Хлорид SnCl4 впервые получил А. Либавий в 1597 г. Аллотропию олова и явление «оловянной чумы» объяснил Э. Кохен в 1899 г.
Происхождение названия
Физические свойства
Механические и технологические свойства:
модуль упругости 55 ГПа при 0 °С и 48 ГПа при 100 °С; модуль сдвига 16,8—8,1 ГПа; временное сопротивление разрыву — 20 МПа; относительное удлинение — 40 %; твёрдость по Бринеллю — 152 МПа (белое олово), 62 МПа (серое олово); температура литья — 260—300 °С.
При температуре немного выше 170 °С олово становится хрупким.
Стандартный электродный потенциал E °Sn 2+ /Sn равен −0,136 В, а E пары °Sn 4+ /Sn 2+ около 0,151 В.
Серое и белое олово
Соприкосновение серого олова и белого приводит к «заражению» последнего, то есть к ускорению фазового перехода по сравнению со спонтанным процессом из-за появления зародышей новой кристаллической фазы. Совокупность этих явлений называется «оловянной чумой». Нынешнее название этому процессу в 1911 году дал Г. Коэн. Начало научного изучения этого фазового перехода было положено в 1870 году работами петербургского учёного, академика Ю. Фрицше. Много ценных наблюдений и мыслей об этом процессе высказано Д. И. Менделеевым в его «Основах химии».
Одним из средств предотвращения «оловянной чумы» является добавление в олово стабилизатора, например висмута. С другой стороны, ускоряет процесс перехода белого олова в серое при не очень низких температурах катализатор хлорстаннат аммония (NH4)2SnCl6.
«Оловянная чума» — одна из причин гибели экспедиции Скотта к Южному полюсу в 1912 году. Она осталась без горючего из-за того, что топливо просочилось из запаянных оловом баков, поражённых «оловянной чумой».
Некоторые историки указывают на «оловянную чуму» как на одно из обстоятельств поражения армии Наполеона в России в 1812 году — сильные морозы привели к превращению оловянных пуговиц на мундирах солдат в порошок.
«Оловянная чума» погубила многие коллекции оловянных солдатиков. Например, в запасниках петербургского музея Александра Суворова превратились в труху десятки фигурок — в подвале, где они хранились, лопнули зимой батареи отопления.
Изотопы
Природное олово состоит из десяти стабильных нуклидов с массовыми числами 112 (в смеси 0,96 % по массе), 114 (0,66 %), 115 (0,35 %), 116 (14,30 %), 117 (7,61 %), 118 (24,03 %), 119 (8,58 %), 120 (32,85 %), 122 (4,72 %) и 124 (5,94 %). Для некоторых из них энергетически возможен двойной бета-распад, однако экспериментально он пока (2018 г.) не наблюдался, поскольку предсказываемый период полураспада очень велик (более 10 20 лет).
Изотопы олова 117 Sn и 119 Sn являются мёссбауэровскими изотопами и применяются в гамма-резонансной спектроскопии.
Химические свойства
Металлическое олово
При комнатной температуре олово, подобно соседу по группе германию, устойчиво к воздействию воздуха или воды. Такая инертность объясняется образованием поверхностной плёнки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150 °C:
При нагревании олово реагирует с большинством неметаллов. При этом образуются соединения в степени окисления +4, которая более характерна для олова, чем +2. Например:
Растворяется в разбавленных кислотах (HCl, H2SO4):
Олово реагирует c концентрированной соляной кислотой. При этом белое олово (α-Sn) образует раствор хлорида олова (II), а серое (β-Sn) хлорида олова (IV):
При взаимодействии с разбавленной азотной кислотой (3-5%) образуется нитрат олова (II):
Окисляется растворами щелочей до гидроксостанната (II), который в горячих расстворах склонен к диспропорцианированию:
Sn + NaOH + 3H2O → Na[Sn(OH)3] + H2↑ 2Na[Sn(OH)3] → Sn + Na2[Sn(OH)6] Sn + 2NaOH + 4H2O → Na2[Sn(OH)6] + 2H2↑
Олово (II)
Менее устойчивая степень окисления чем (IV). Вещества имеют высокую восстановительную активность и легко диспропорцианируют:
На воздухе соединения быстро окисляются кислородом, как в твердом виде, так и в растворах:
2SnO + O2 → 2SnO2 2Sn 2+ + O2 + 4H + → 2Sn 4+ + 2H2O
Сильным восстановителем является «оловянная соль» SnCl2 ⋅ 2H2O
Оксид можно получить действием аммиака на горячий раствор хлорида олова в атмосфере СO2:
Также при слабом нагревании гидроксида олова (II) Sn(OH)2 в вакууме или осторожном нагревании некоторых солей:
В растворах солей олова идёт сильный гидролиз:
При действии на раствор соли Sn(II) растворами сульфидов выпадает осадок сульфида олова (II):
Этот сульфид может быть легко окислен до сульфидного комплекса раствором полисульфида натрия, при подкислении превращающегося в осадок сульфида олова (IV):
Олово (IV)
Оксид олова(IV) (SnO2) образуется прямым окислением кислородом. При сплавлении с щелочами образует станнаты, при обработке водой образующие гидроксостаннаты:
Гидрид олова — станнан SnH4 — можно получить по реакции:
Этот гидрид весьма нестоек и медленно разлагается уже при температуре 0 °C.
Четырёхвалентное олово образует обширный класс оловоорганических соединений, используемых в органическом синтезе, в качестве пестицидов и др.
Нахождение в природе
Олово — редкий рассеянный элемент, по распространённости в земной коре олово занимает 47-е место. Кларковое содержание олова в земной коре составляет, по разным данным, от 2⋅10 −4 до 8⋅10 −3 % по массе. Основной минерал олова — касситерит (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) — Cu2FeSnS4 (27,5 % Sn).
Месторождения
Мировые месторождения олова находятся в основном в Китае и Юго-Восточной Азии — Индонезии, Малайзии и Таиланде. Также есть крупные месторождения в Южной Америке (Боливии, Перу, Бразилии) и Австралии.
В России запасы оловянных руд расположены в Хабаровском крае (Солнечный район — месторождения Фестивальное и Соболиное; Верхнебуреинский район — Правоурмийское месторождение), в Чукотском автономном округе (Пыркакайские штокверки; рудник/посёлок Валькумей, Иультин — разработка месторождений закрыта в начале 1990-х годов), в Приморском крае (Кавалеровский район), в Якутии (месторождение Депутатское) и других районах.
Распространённость в природе
Распространённость в природе отражена в следующей таблице:
| Геол. объект | Камен. метеориты | Дуниты и др. | Базальты и др. | Диориты и др. | Гранитоиды | Глины и др. | Вода океанов | Живое вещество(% на живой вес) | Почва | Зола растений |
|---|---|---|---|---|---|---|---|---|---|---|
| Содержание, вес. % | 00 1⋅10 −4 | 0 5⋅10 −5 | 0 1,5⋅10 −4 | 0000 − | 000 3⋅10 −4 | 1⋅10 −3 | 0 7⋅10 −7 | 0000 5⋅10 −5 | 1⋅10 −3 | 00 5⋅10 −4 |
Олово является амфотерным элементом, то есть элементом, способным проявлять кислотные и основные свойства. Это свойство олова определяет и особенности его распространения в природе. Благодаря этой двойственности олово проявляет литофильные, халькофильные и сидерофильные свойства. Олово по своим свойствам проявляет близость к кварцу, вследствие чего известна тесная связь олова в виде окиси (касситерита) с кислыми гранитоидами (литофильность), часто обогащёнными оловом, вплоть до образования самостоятельных кварц-касситеритовых жил. Щелочной характер поведения олова определяется в образовании довольно разнообразных сульфидных соединений (халькофильность), вплоть до образования самородного олова и различных интерметаллических соединений, известных в ультраосновных породах (сидерофильность).
Формы нахождения
Основная форма нахождения олова в горных породах и минералах — рассеянная (или эндокриптная). Однако олово образует и минеральные формы, и в этом виде часто встречается не только как акцессорий в кислых магматических породах, но и образует промышленные концентрации преимущественно в окисной (касситерит SnO2) и сульфидной (станнин) формах.
Твёрдая фаза. Минералы
В общем можно выделить следующие формы нахождения олова в природе:
На сульфидных месторождениях олово входит как изоморфный элемент в сфалериты (Силинское месторождение, Россия, Приморье), халькопириты (Дубровское месторождение, Россия, Приморье), пириты. Высокие концентрации олова выявлены в пирротине грейзенов Смирновского месторождения (Россия, Приморье). Считается, что из-за ограниченного изоморфизма происходит распад твёрдых растворов с микровыделениями Cu2 +1 Fe +2 SnS4 или тиллита PbSnS2 и других минералов.
Собственно минеральные формы
Самородные элементы, сплавы и интерметаллические соединения
Хотя концентрации этих минералов в породах очень низки, однако распространены они в широком круге генетических образований. Среди самородных форм вместе с Sn выявлены Fe, Al, Cu, Ti, Cd и так далее, не считая уже известные самородные платиноиды, золото и серебро. Эти же элементы образуют между собой и различные сплавы: (Cu + Sn + Sb), (Pb + Sn + Sb) и другие, а также твёрдые растворы. Среди интерметаллических соединений установлены стистаит SnSb, атакит (Pd,Pt)3Sn, штумырлит Pt(Sn,Bi), звягинцевит (Pd,Pt)3(Pb,Sn), таймырит (Pd,Cu,Pt)3Sn и другие.
Приведённые формы нахождения олова и других элементов встречаются в различных геологических образованиях:
Окисные соединения олова
Касситерит
Касситерит (от греч. kassiteros — олово) — главный рудный минерал для получения олова, химическая формула SnO2. Теоретически содержит 78,62 % Sn. Образует отдельные выделения, зерна, сплошные массивные агрегаты, в которых зёрна минерала достигают в размере 3—4 мм и даже больше. В чистом виде бесцветные кристаллы, примеси придают минералу самые различные цвета.
Основные формы выделения касситерита:
В России месторождения касситерита имеются на Северо-Востоке, в Приморье, Якутии, Забайкалье; за рубежом — в Малайзии, Таиланде, Индонезии, КНР, Боливии, Нигерии и других странах.
Гидроокисные соединения
Второстепенное место занимают гидроокисные соединения олова, которые можно рассматривать как соли полиоловянных кислот. К ним можно отнести минерал сукулаит Ta2Sn2 +2 O; твёрдый раствор олова в магнетите вида Fe2SnO4 или Fe3SnO3 (Бретштейн Ю. С., 1974; Воронина Л. Б., 1979); «варламовит» — продукт окисления станнина; считается, что он представляет собой смесь аморфных и полуаморфных соединений Sn, метаоловянной кислоты, поликонденсированной фазы и гидрокасситеритовой фазы. Известны также гидратированные продукты окисления — гидромартит 3SnO·H2O; мушистонит (Cu,Zn,Fe)Sn(OH)6; гидростаннат меди CuSn(OH)6 и другие.
Силикаты
Известна многочисленная группа силикатов олова, представленная малаяитом CaSn[SiO5]; пабститом Ba(Sn, Ti)Si3O9, стоказитом Ca2Sn2Si6O18·4H2O и др. Малаяит образует даже промышленные скопления.
Шпинелиды
Из других окисных соединений известны также шпинелиды, например, минерал нигерит Sn2Fe4Al16O32 (Peterson E. U., 1986).
Сульфидные соединения олова
Включает различные соединения олова с серой. Это вторая по промышленному значению группа минеральных форм нахождения олова. Наиболее важным из них является станнин, второй по значению минерал. Кроме этого, отмечаются франкеит Pb5Sn3Sb2S14, герценбергит SnS, берндтит SnS2, тиллит PbSnS2 и кестерит Cu2ZnSnS4. Выявлены и более сложные сульфидные соединения олова со свинцом, серебром, медью, имеющие в основном минералогическое значение. Тесная связь олова с медью обусловливает частое присутствие на оловорудных месторождениях халькопирита CuFeS2 с образованием парагенезиса касситерит — халькопирит.
Станнин
Станнин (от лат. stannum — олово), оловянный колчедан, минерал из класса сульфидов с общей формулой вида Cu2FeSnS4. Она следует из формулы халькопирита путём замены одного атома Fe на Sn. Содержит 29,58 % Cu, 12,99 % Fe, 27,5 % Sn и 29,8 S, а также примеси Zn, Sb, Cd, Pb и Ag. Широко распространённый минерал в оловорудных месторождениях России. На ряде месторождений России (Приморье, Якутия) и Средней Азии (Таджикистан) он является существенным элементов сульфидных минералов и часто вместе с варламовитом составляет 10—40 % общего олова. Часто образует вкрапленность в сфалерите ZnS, халькопирите. Во многих случаях наблюдаются явления распада станнина с выделением касситерита.
Коллоидная форма
Коллоидные и олово-кремнистые соединения играют значительную роль в геохимии олова, хотя детально она не изучена. Значительное место в геологии элемента играют коломорфные соединения и продукты его кристаллических превращений в скрытокристаллические разности. Коломорфный касситерит рассматривается как форма выражения вязких гелеобразных растворов.
Анализ свойств соединения Sn(OH)4 и близость их к соединению Si(OH)4 выявляет способность его к полимеризации с образованием в конечном счёте соединений H2Sn k O2 k +1, Sn k O2 k −1(OH)2. В обоих случаях возможно замещение группы (ОН) на анионы F и Cl.
Имеющиеся данные говорят о том, что коллоидная форма является естественным промежуточным звеном при осаждении олова из гидротермальных растворов.
Формы нахождения олова в жидкой фазе
Наименее изученная часть геохимии олова, хотя в газово-жидких включениях установлены касситериты в виде минералов-узников (Кокорин А. М. и др., 1975). Работ по анализу конкретных оловосодержащих природных растворов нет. В основном вся информация основана на результатах экспериментальных исследований, которые говорят только о вероятных формах нахождения олова в растворах. Существенную роль в разработке методики этих исследований принадлежит академику В. Л. Барсукову.
Вся совокупность экспериментально установленных форм нахождения олова в растворах разбивается на группы:
Промышленные типы месторождений олова
Описанные выше геохимические особенности олова находят косвенное отражение в формационной классификации оловорудных месторождений, предложенной Е. А. Радкевич с последующими дополнениями.
А. Формация оловоносных гранитов. Касситерит установлен в акцессорной части гранитов. Б. Формация редкометальных гранитов. Это граниты литионит-амазонит-альбитового типа (апограниты по А. А. Беусу). Касситерит в акцессорной части вместе колумбит-татнатлитом, микролитом и прочими. В. Формация оловоносных пегматитов. Оловянная минерализация характерна для Be-Li-, Be-Ta-, F-Li- типов. Г. Формация полевошпат-кварц-касситеритовая. Выделена Ив. Ф. Григорьевым. Это кварц-полевошпатовые жилы с касситеритом и другими минералами. Д. Формация кварц-касситеритовая. Распространена на северо-востоке России. Это жильные зоны, грейзены с кварцем, мусковитом, вольфрамитом, касситеритом и другим. Е. Формация касситерит-силикатно-сульфидная с турмалиновым и хлоритовым типами. Одна из основных продуктивных формаций Приморья России. Ж. Формация касситерит-сульфидная. Также основная оловопродуктивная формация. В ней выделяют основные типы: 1) штокверковое олово-вольфрамовое оруденение; 2) рудные тела квар-касситерит-арсенопиритового типа; 3) продуктивные кварцевые жилы сульфидно-касситерит-хлоритового типа. З. Формация оловянно-скарновая. И. Формация деревянистого олова (риолитовая формация). К. Формация основных и ультраосновных пород (по И. Я. Некрасову). Л. Формация щелочных пород Украины (по В. С. Металлиди, 1988).
Производство
В процессе производства рудоносная порода (касситерит) подвергается дроблению до размеров частиц в среднем
Применение
Физиологическое действие
Вредные примеси, содержащиеся в олове в обычных условиях хранения и применения, в том числе в расплаве при температуре до 600 °C, не выделяются в воздух в объёмах, превышающих предельно допустимую концентрацию (в частности, определенную по ГОСТ 12.1.005—76. Длительное (в течение 15—20 лет ) воздействие пыли олова оказывает фиброгенное воздействие на лёгкие и может вызвать заболевание работающих пневмокониозом.