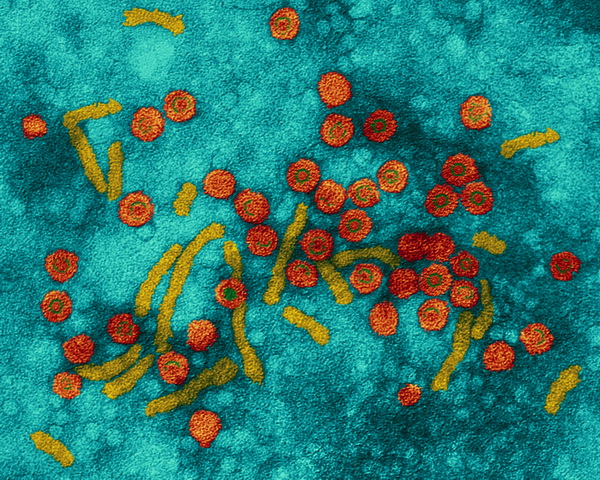Что такое онкогенные вирусы
Онкогенные вирусы
Инфекция, вызванная онкогенными вирусами, является причиной 15,4% заболеваний раком по всей земле. Первый онкогенный вирус, который был идентифицирован — это куриный вирус саркомы Рауса в 1911 году. Десятилетиями позже были обнаружены серии других онкогенных вирусов, в том числе вирус папилломы Шопа (вирус папилломы кроличьего хвоста), вирус опухоли молочной железы мыши, аденовирус, вирус SV40 (обезьяний вирус sv40). Теория опосредованного вирусом онкогенеза в итоге была экспериментально продемонстрирована в 1976 году Гарольдом Вармусом и Майклом Бишопом путем превращения инфицированных клеток в опухолевые вирусом саркомы (ген v-src вызывает образование опухоли после захвата протоонкогена человеческой клетки в результате трансдукции).
Несмотря на то, что онкогенные вирусы нашли в исследованиях онкогенной активности животных клеток, они были не в состоянии преобразовать человеческие клетки. Теория вирусного онкогенеза в человеческой клетке оставалась спорной до 1965 года, когда вирус Эпштейн-Барр (EBV) был обнаружен в клетках лимфомы Беркитта. В ходе последующих исследований, в том числе выделении Т-лимфотропного вируса человека (HTLV) из клеток Т-клеточной лимфомы и выявлении роли папилломовирусов человека с высокой онкогенной активностью в развитии рака шейки матки, был определен путь для понятия человеческих онкогенных вирусов. Обнаружение связи между герпес-вирусом и саркомой Капоши (KSHV) и лимфомой и между полиомавирусом клеток Меркеля (MCV) и карциномой клеток Меркеля (MCC) подчеркнуло возможность открытия еще большего количества онкогенных вирусов с помощью современных технологий. Далее каждый вирус будет рассмотрен отдельно.
Вирус Эпштейн-Барр
Вирус Эпштейн-Барр (ВЭБ, EBV) — ДНК-содержащий вирус, который преимущественно поражает B-лимфоциты, также является митогеном для них; вызывает лимфопролиферативные болезни (лимфома Беркитта, носоглоточная карцинома, NK-клеточная лейкемия, лимфома Ходжкина и т.д.), а также инфекционный мононуклеоз. Вирионы вируса были обнаружены при электронной микроскопии биоптата лимфомы Беркитта в начале 1964 года Энтони Эпштейном и Ивонной Барр.
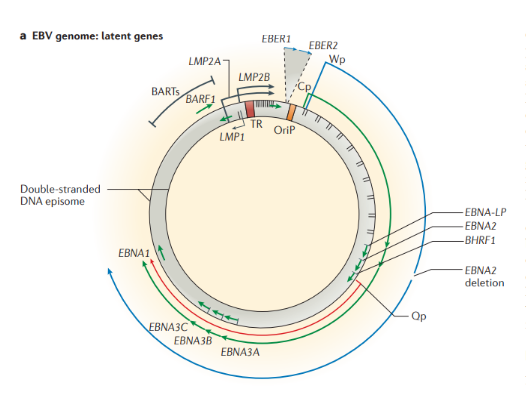
Строение. ВЭБ имеет вирусный капсидный антиген (VCA), ядерные антигены-EBNAs 1, 2, 3, 3a, 3b, 3c; латентные мембранные протеины (LMPs) 1, 2 и две маленькие Эпштейна-Барр-кодируемые РНК (EBER) молекулы — EBER1 и EBER2. EBNAs и LMPs являются ДНК-связывающими белками, считающимися необходимыми для развития инфекции и фиксации.
В зависимости от набора экспрессируемых вирусных генов в пораженных клетках выделяют три типа латентности (I, II и III тип), характерные для различных видов лимфом: I тип подразумевает избирательную экспрессию EBNA-1 при ВЭБ-положительной лимфоме Беркитта; II тип заключается в экспрессии EBNA-1, LMP-1 и LMP-2 и является отличительным признаком ВЭБ-положительной ходжкинской лимфомы, периферических T/NK-клеточных лимфом; латентность III типа, характеризуемая экспрессией всего набора из девяти латентных белков ВЭБ, наблюдается при лимфопролиферативных поражениях, возникающих у пациентов с тяжелым иммунодефицитом (после трансплантации паренхиматозных органов или стволовых клеток, ВИЧ-инфекции). Тип латентности определяет восприимчивость инфицированных клеток к различным иммунотерапевтическим тактикам. Индуцированные ВЭБ злокачественные новообразования связаны с экспрессией латентных генов. У большинства иммунокомпетентных носителей ВЭБ вирус не индуцирует опухолевый процесс. Новообразования развиваются при комплексном взаимодействии ВЭБ, иммуногенетических факторов, факторов внешней среды (паразитарных инфекций — чаще, малярии, недоедании, потреблении пищи, содержащей канцерогены) и иммунодефицита (ВИЧ-инфекция, трансплантация).
Папилломавирусы человека
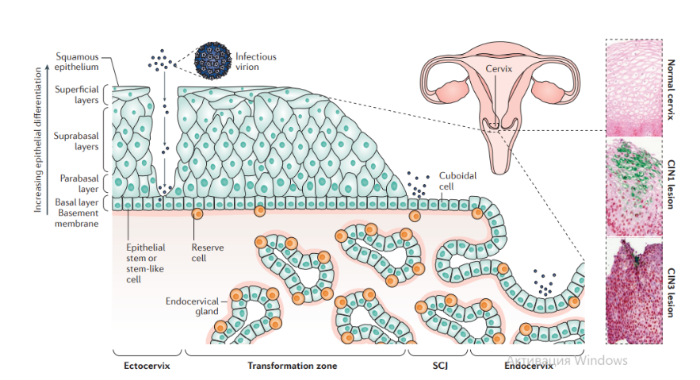
Описано около 200 папилломавирусов. Вирусы передаются при контактах через микротравмы кожи и слизистых оболочек, а также половым путем. Папилломавирусы человека вызывают доброкачественные кожные, генитальные, оральные и конъюнктивальные папилломы; индуцируют пролиферацию эпителия, обладают онкогенным потенциалом. С папилломавирусом, особенно ПВЧ-5 и ПВЧ-8, тесно связано развитие немеланомных разновидностей рака кожи. Различают низкоонкогенные папилломавирусы, вызывающие бородавки, которые не малигнизируются, и высокоонкогенные, способные вызвать рак шейки матки, — ПВЧ-16, 18, 31, 33, 35, 45, 51, 52, 58.
Строение. Капсид икосаэдрический, состоит из двух капсидных белков (L1-L2), формирующих 72 пентамера. Геном — двунитевая циркулярная ДНК; имеет в зависимости от вируса восемь ранних генов (E1-E8) и два поздних гена (L1-L2). Гены E6-E7 обладают онкогенной активностью.
Патогенез. В целом, для развития продуктивного поражения ВПЧ (высокого или низкого риска) требуется, чтобы вирус имел доступ к эпителию базального слоя как только эпителиальный барьер был подвержен риску. Папилломавирусы должны инфицировать делящуюся клетку, чтобы стать признанными как малое количество копий ядерной эписомы, и для развития стойкого поражения первичная инфицированная клетка, вероятно, должна быть похожа на долгоживующую эпителиальную стволовую клетку или похожую на нее. Кроме того, связанные с заживлением ран изменения в местном микроокружении, включая увеличение количества факторов роста, могут играть ключевую роль в создании резервуара инфекции в базальном слое. Способность ВПЧ инфицировать, и реплицироваться, и управлять прогрессированием рака зависит от функции вирусного белка, положении в эпителии, где эти белки экспрессируются. Как только инфицированные базальные клетки поделились и в конечном итоге вошли в парабазальный слой, они начинают проходить программу экспрессии генов, которая связана с дифференциацией. Амплификация вирусного генома обычно происходит в срединно-эпителиальных слоях, тогда как сбор и выход вируса происходит вблизи наружной поверхности эпителия.
Несмотря на то, что эффективная амплификация генома требует комбинированного действия множественных продуктов вирусного гена, включая E6, E7, E2 и кодированную вирусом геликазы E1, поддержание репликации в базальном слое эпителия может зависеть от факторов репликации клетки хозяина. Программа, зависящая от дифференциации, которая происходит в надбазальных слоях эпителиальной клетки, включает как временные изменения в активности промотора, так и изменения в шаблонах сплайсинга мРНК, которые облегчают производство различных продуктов вирусных генов на разных стадиях во время программы дифференциации. Функция вирусного белка далее регулируется посттрансляционной модификацией, включая фосфорилирование и протеолитическое деление клетки.
Герпесвирус, ассоциированный с саркомой Капоши
KSHV, или человеческий герпесвирус 8, был обнаружен в 1994 году как член семейства гамма-герпеса человека, присоединившись к ВЭБ. Инфекция иммунокомпрометированных индивидуумов с KSHV была связана с развитием саркомы Капоши, полученной из эндотелиальных клеток, и по меньшей мере двумя B-лимфоцит лимфопролиферативными заболеваниями: первичная выпотная лимфома и многоцентричная болезнь Кастлмана. Однако изучение патогенеза и онкогенеза KSHV затруднено отсутствием значимой модели животных и восприимчивой клеточной культуры.
Онкогенное действие. Две иммортализованные клеточные линии, KS Y-1 и SLK, когда-то использовались для исследований KS и KSHV, но в KS Y-1 были также обнаружены клетки линии рака мочевого пузыря T 24, что затруднило дальнейшую работу. Первичные эмбриональные метанефрические мезенхимальные клетки-предшественники почек крысы восприимчивы к инфекции и трансформации KSHV, но из них распространяются ограниченное количество инфекционных вирионов. Линии B-клеток, полученные из первичной выпотной лимфомы, обычно заражаются KSHV на латентной стадии и могут быть индуцированы для получения малого количества вирионов KSHV, но первичные B-лимфоциты из периферической крови или тонзиллярной ткани являются устойчивыми к инфекции KSHV, и для их инфицирования может потребоваться совместный рост с KSHV-позитивными клетками.
Т-лимфотропный вирус человека (HTLV)
T-лимфотропный вирус человека (HTLV) относится к семейству ретровирусов, является возбудителем T-клеточного лимфолейкоза взрослых. Вирус впервые был изолирован в 1980 году от больного Т-лимфомой.
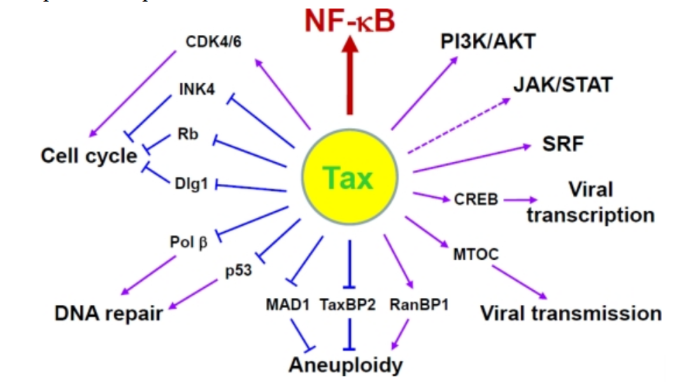
Геном. Gag, Pol и Env являются вирусными структурными белками, другие — вирусными регуляторными/вспомогательными белками. За исключением гена hbz, который кодируется минус-цепью провирусного генома HTLV из 3′-LTR, все остальные гены кодируются плюсовой нитью по направлению 5′-LTR. Следует отметить, что 5′-LTR часто удаляется или метилируется по мере прогрессирования заболевания. Кроме того, на поздних стадиях лейкемиогенеза в гене tax часто возникают нонсенс- или миссенс-мутации. Хотя белок tax и ген HBZ индуцируют опухоли у трансгенных мышей, а p12 проявляет слабую онкогенную активность, ни один из вирусных белков/генов, кроме tax, не требуется для опосредованного HTLV-1 опухолеобразования. Продукт tax гена действует на терминальные повторы LTR, стимулируя синтез вирусной иРНК, а также образование рецепторов IL-2 на поверхности зараженной клетки.
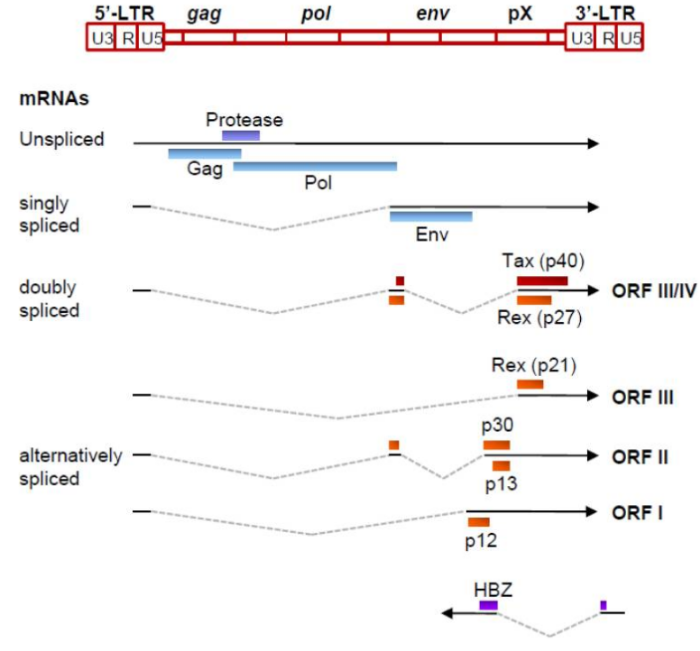
Рисунок 4. К леточные пути вирусного онкобелка tax
Патогенез. Проникновение HTLV-1 в клетку человека охарактеризовывает начало выживания и репликации вируса. HTLV-1 связывается с рецептором клеток, имеющих необходимый антиген, что инициирует процесс инвазии. Рецепторный комплекс состоит из транспортера глюкозы (GLUT1), гепаринсульфат протеогликана (HSPG) и рецептора VEGF-165 нейропилина-1 (NRP-1). HTLV-1 взаимодействует с HSPG. Процесс слияния происходит через комбинацию GLUT1 с HSPG/NRP-1, после чего ядро, содержащее вирусную РНК, доставляется в цитоплазму клеток-мишеней. После обратной транскрипции HTLV-1 встраивает свой геном в генома хозяина, чтобы сформировать провирус, окруженный двумя LTR на 5′ и 3′ концах. Затем провирус транскрибируется и кодирует структурные, регуляторные и вспомогательные белки. Впоследствии вирусные геномные РНК и Gag, Env и Gag-Pol белки переносятся в плазматическую мембрану, чтобы начать собираться в зрелую вирусную частицу.
Вирусы гепатита
Вирус гепатита В (HBV) и вирус гепатита С (HCV) представляют собой несвязанные вирусы, имеющие тропность к гепатоцитам и реплицирующиеся в них. Около 2 миллиардов человек инфицированы HBV, и более 350 миллионов человек становятся хроническими носителями. Только 5-10% взрослых, которые приобретают инфекцию, становятся хроническими носителями, у 30% развиваются прогрессирующие хронические заболевания печени: гепатит, фиброз, цирроз и, наконец, гепатоцеллюлярная карцинома (HCC).
Геном. Геном вируса гепатита B представляет собой одну двухцепочечную кольцевую ДНК длиной около 3200 нуклеотидов (длина генома различна у разных изолятов). Одна из цепей («плюс-цепь») ДНК короче другой (ее длина составляет 1700-2800 нуклеотидов). Вторая цепь тоже не является замкнутой и к ее 5’-концу ковалентно присоединена молекула полимеразы (P). В геноме вируса найдено 4 гена: S, С, Р, X, кодирующих соответственно HBsAg, HBcAg, полимеразу и белок-регулятор экспрессии генов. Кроме того, там есть регуляторные последовательности ДНК, ответственные за синтез белков и репликацию вируса. Гены частично перекрываются, что обусловливает малый размер генома.
Патогенез. HCC, индуцированная посредством HBV и HCV, развивается в области воспаления и регенерации, что является результатом хронического повреждения печени, а это в свою очередь указывает на то, что патогенез HCC иммунно-опосредован. Эти вирусы постоянно реплицируются в культуре клеток без явных повреждений и смерти клеток, подразумевая, что они являются не цитопатическими. Постоянная репликация вируса является фактором риска для образования HCC, потому что воспаление часто приводит к длительным хроническим заболеваниям печени CLD без выведения вируса. В этом контексте HBV и HCV генерируют белки, подавляющие иммунитет, который должен контролировать хронические инфекции. HBV- и HCV-кодированные белки изменяют экспрессию гена хозяина и клеточный фенотип, что является признаком рака. Эти изменения способствуют независимой от фактора роста пролиферации, сопротивлению к ингибированию роста, инвазии тканей и метастазированию, ангиогенезу, перепрограммированию энергетического метаболизма и устойчивости к апоптозу. Хроническое воспаление также способствует генетической нестабильности в клетках опухоли. Вклад HBV в развитие HCC включает в себя экспрессию гена гепатита Bx (HBx) и, возможно, усеченные пре-S или S-полипептиды карбоксимицина; основной белок и неструктурные (NS) белки NS3 и NS5A HCV способствуют онкогенной трансформации. Изменения в экспрессии гена хозяина, которые способствуют возникновению опухолевого генеза, также, похоже, поддерживают репликацию вируса и/или защиты вирусных гепатоцитов от иммунного опосредованного повреждения и разрушения.
Что нужно знать об онкогенных вирусах
Когда речь идет об онкологических заболеваниях, редко кому приходит в голову, что раком можно заразиться. Однако уже достоверно известно, что ряд вирусов вызывает определенные злокачественные образования, причем некоторые из этих вирусов передаются от человека к человеку
Онкогенная активность вирусов
С развитием злокачественных опухолей ассоциированы представители четырех семейств вирусов. Процесс трансформации нормальных клеток в злокачественные изучен для шести вирусов, которые вызывают 15% всех опухолей человека. К канцерогенным относят вирусы простого герпеса 2-го (HHV-2) и 8-го типа (HHV-8); вирус Эпштейна — Барр; вирус папилломы человека;
Вирус простого герпеса; просвечивающая электронная микроскопия
вирусы Т-лимфоцитов-1 (НТLV-1) и Т-лимфоцитов-2 (НТLV-2). Доказана канцерогенная роль вируса папилломы человека в развитии рака шейки матки, вируса гепатита B — в развитии рака печени, ВИЧ — в развитии саркомы Капоши.
Попадая в организм человека, генетический материал вируса может активно взаимодействовать с ДНК хозяина, активируя протоонкогены человека и трансформируя их в действующие онкогены. Геном некоторых ретровирусов содержит самостоятельные высокоактивные онкогены, активирующиеся после включения ДНК вируса в ДНК клеток человека. Большинство онкогенных вирусов обладают специфическим клеточным тропизмом. Отличительным признаком опухолей, ассоциированных с вирусами, является то, что опухолевые клетки содержат вирусный геном.
География вирусного канцерогенеза
Частота опухолей, связанных с онкогенными вирусами, отличается в зависимости от континента. Вирус НТLV-1 (АТLV) распространен в тропических странах, но спорадически вызываемая им лимфома и лейкемия встречаются во всем мире. Заболевание возникает обычно у лиц старше 50 лет, протекает тяжело и быстро приводит к летальному исходу.
Кроме полового пути инфицирования, вирусом можно заразиться при переливании зараженной крови и через загрязненные медицинские инструменты. Этот вирус может проникнуть трансплацентарным путем от матери к плоду. Заболевает один из 2000 инфицированных. В эндемических очагах 20% населения, в основном родственники больных, являются носителями данного вируса.
Инфекция HTLV-1 эндемична в районах Японии. Вирус, очевидно, передается от матери к ребенку, но после инфицирования Т-клеточная лейкемия проявляется не сразу, а лишь спустя 20 лет.
Вирус Эпштейна — Барр вызывает aфpиканскую лимфому Беркитта и недифференцированную назофарингеальную карциному, распространенную в Юго-Восточной Азии. Получены весомые аргументы в пользу возможной этиологической роли вируса Эпштейна — Барр для лимфомы Ходжкина.
Последствия беспорядочных половых связей
По результатам исследования установлено, что беспорядочные половые связи приводят к развитию рака шейки матки и рака полового члена, а также могут быть причиной рака предстательной железы. С этим процессом связывают вирус простого герпеса (симплексвирус 2-го типа). Одним из доказательств служит тот факт, что у монахинь рак шейки матки возникает крайне редко. А у женщин, которые рано начали половую жизнь и часто меняют партнеров, повышен риск развития рака шейки матки.
Вирусы герпеса способны размножаться в клетках эпителия головки члена и внутренней поверхности крайней плоти. Своеобразным резервуаром для вирусов служит смегма, превращающаяся в канцероген для эпителия влагалищного отдела шейки матки. Также половым путем, причем от мужчины к женщине, но не наоборот, передается вирус НТLV-1 (АТLV), который вызывает Т-клеточную лимфому и Т-клеточную лейкемию.
Вирус Эпштейна — Барр вызывает aфpиканскую лимфому Беркитта и недифференцированную назофарингеальную карциному, распространенную в Юго-Восточной Азии. Получены весомые аргументы в пользу возможной этиологической роли вируса Эпштейна — Барр для лимфомы Ходжкина
Папилломы и иммуноскомпрометированные мишени
Папилломавирусы широко распространены среди населения во всем мире, но зачастую никак себя не проявляют. Вирус папилломы человека не только является возбудителем доброкачественных вирусных бородавок на коже и слизистой оболочке ротовой полости, но также ассоциирован с онкологическими заболеваниями гениталий, полости рта и гортани. Значительная часть случаев рака шейки матки, вульвы и яичника связана с воздействием этого вируса. Латентный период до развития рака может длиться до 30 лет. Кроме того, вирус папилломы человека 5-го типа вызывает такое редкое заболевание кожи, как дисплазию Левандовского.
Особую опасность онкогенные вирусы представляют для людей, у которых в силу различных причин снижен иммунитет. Например, на фоне тяжелого иммунодефицита вирус герпеса человека 8-го типа вызывает злокачественные опухоли. Наиболее часто он обусловливает развитие злокачественной опухоли легкого — саркомы Капоши.
Гепатит, вызывающий рак
Вирус гепатита В; просвечивающая электронная микроскопия
В большинстве случаев наличие онкогенных вирусов является недостаточным для 100% развития рака. У многих людей клетки могут быть инфицированными в течение десятилетий, однако лишь у 1% из них развивается опухоль. Вирус гепатита В (гепаднавирус HBV) повышает частоту рака печени лишь в сочетании с другими агентами. Для перехода в активную стадию необходимо наличие не менее двух онкогенов.
Следует отметить, что HBV легко передается от родителей к ребенку. В 90% случаев дети, инфицированные в родах, остаются на всю жизнь постоянно инфицированными. Хроническая инфекция предрасполагает к развитию гепатита, цирроза и гепатоцеллюлярной карциномы. HBV — самый частый из известных факторов риска развития карциномы. Ежегодно в мире с НBV ассоциируется 1 млн новых случаев гепатоцеллюлярного рака. Это заболевание особенно распространено на западе Центральной Африки, на Тайване и в Китае.
Онковирусы не всесильны
Следует подчеркнуть, что обычные контакты с онкологическим больным не приводят к развитию злокачественных опухолей у родственников и медицинского персонала. Все известные опасные онкогенные вирусы передаются только через кровь или половым путем. Кроме того, у многих людей клетки могут быть инфицированы некоторыми онкогенными вирусами десятилетиями, однако лишь у небольшой части зараженных развивается злокачественная опухоль.
Достижения молекулярной биологии и новые знания о вирусном канцерогенезе открывают реальные перспективы для эффективной профилактики опухолевых заболеваний. В частности, применение вакцин может обеспечить защиту от развития рака шейки матки.
Татьяна Кривомаз, канд. биол. наук
На фото под заголовком: вирус папилломы человека, электронная микроскопия; © Institut Pasteur
ОНКОГЕННЫЕ ВИРУСЫ
ОНКОГЕННЫЕ ВИРУСЫ (греч. onkos масса, опухоль + gennao создавать, производить; вирусы: син. онковирусы) — группа вирусов, обладающмх способностью обусловливать трансформацию нормальных клеток эукариотов в опухолевые. Первыми исследователями, высказавшими еще в 1903 г. мысль о том, что опухоли, в частности раковые, могут быть вызваны агентами вирусной природы, были А. Боррель и Боек (F. J. Bose), Эллерманн и Банг (V. Ellermann, О. Bang, 1908). Несколько позже Раус (1911) в эксперименте установил вирусную этиологию лейкоза и саркомы кур. Однако эти работы долго не находили признания, тем более, что в то время лейкозы не считали неопластическими заболеваниями. Лишь в 1966 г. Ф. Раус был удостоен Нобелевской премии за основополагающие исследования в области онковирусологии.
Идея о роли вирусов в возникновении опухолей издавна занимала умы русских ученых. И. И. Мечников в 1909 г. публично заявил: «Весьма вероятно. что раковые заболевания человека обязаны своим происхождением какому-нибудь вирусу, к-рый усердно ищут, но еще не обнаружили». Развивая мысль об участии вирусов в возникновении опухолей, И. И. Мечников еще в 1910 г. утверждал, что одного лишь проникновения вирусов в организм недостаточно для развития рака и что они могут проявить свою болезне-творность только при соответствующих условиях, основным из к-рых он считал наличие хронически пораженных тканей.
Долгое время попытки выделить вирус, к-рый вызывает опухоли у млекопитающих, оставались безрезультатными. Более того, факт получения опухолей у кур в результате введения им различных хим. веществ, названных канцерогенными, был способен поколебать мнение о живой природе возбудителя и о его принадлежности к вирусам. Тем не менее даже в те годы (1930— 1931) Н. Ф. Гамалея писал: «. если клетки саркомы могут возникать в организме курицы или в тканевых культурах без внесения вируса, а под влиянием стерильных веществ. то надо допустить, что саркоматозный вирус предсуществует в здоровых клеточках в скрытом состоянии., не проявляя своего присутствия. не мешает их нормальной жизни и не имеет самостоятельного обмена веществ, т. к. не изменяет их ассимиляции». Это положение позволяет считать, что именно Н. ф. Гамалея первым предсказал существование и значение эндогенных онковирусов.
Только в 1932—1933 гг. Р. Шоуп описал вирусные опухоли у млекопитающих — фиброму и папиллому диких кроликов, из к-рых последняя могла переродиться в карциному. Затем Дж. Биттнер описал в 1936 г. вирус рака молочных желез мышей, а в 1951 г. ЛГросс сообщил о выделении вируса лейкоза мышей. Исследования, проводившиеся в разных странах, показали, что количество О. в. довольно велико и составляет более 200. Среди О. в. имеются как ДНК-, так и РНК-содержащие вирусы.
РНК-содержащие О. в. (онкорнавирусы) представляют наиболее многочисленную группу вирусов, являющихся причиной возникновения злокачественных новообразований у естественных хозяев (см. Ретровирусы). ДНК-содержащие О. в. разделяют на три группы: вирусы папиллом (см. Паповавирусы), вирусы группы герпеса (см. Герпеса вирусы) и вирусы группы оспы (см. Поксвирусы), к-рые обладают свойством вызывать различные опухоли. Среди О. в. имеются вирусы, вызывающие опухоли практически у всех представителей животного мира (см. табл.). Лишь выявление РНК-содержащих О. в. в опухолях человека до сих пор остается неустановленным.
По морфологии РНК-содержащие О. в. делят на онковирусы (или ретровирусы) типа А, В, С и D (рис. 1,7—4). О. в. типа А рассматриваются гл. обр. как внутриклеточные предшественники О. в. типов В, Си D. Предполагают также, что среди О. в. типа А существует самостоятельная группа вирусов, роль к-рых неизвестна. О. в. типа В являются возбудителями карцином молочных желез у мышей, а О. в. типа С — лейкозов и сарком у птиц и млекопитающих; О. в. типа D объединяют вирус обезьян Мейзона— Пфайзера, вирус перевиваемых раковых клеток человека, эндогенные вирусы белок и обезьян.
Структура и морфогенез ДНК-содержащих О. в. разнообразны и сходны с субмикроскопической организацией и внутриклеточным развитием инф. вирусов группы оспы, герпеса, аденовирусов, паповавирусов (рис. 1, 5—8 и рис. 2).
Внеклеточные вирионы РНК-содержащих О. в. состоят из оболочки и сердцевины, имеющих достаточно сложное строение, как, напр., у О. в. типа С млекопитающих (рис. 3—4). Для внутриклеточного развития РНК-содержащих О. в. характерны два основных признака: интеграция вирусного ДHК-транскрипта (ДНК-овой копии вирусного РНК-содержащего генома, к-рая синтезируется вирусным ферментом — ревертазой) с геномом клетки и наличие дополнительной стадии дифференцировки (созревания) у выделившегося (или выделяющегося) из клетки О. в. (цветн. рис.).
Помимо обычных РНК-содержащих онкогенных вирусов (рис. 5,а), описаны так наз. минимальные формы РНК-содержащих О. в. (рис. 5, б, в, г), к-рые обнаружены в популяции онковирусов типа А, С и D. Они отличаются меньшей величиной и формируются либо на поверхности клетки, либо в процессе фрагментации внеклеточных онковирусов при неблагоприятных условиях культивирования. В подобных условиях выявляются многочисленные аномальные формы онковирусов, в частности гигантские их формы (рис. 6).
Большая роль в становлении современной онковирусологии принадлежит советскому ученому Л. А. Зильберу, впервые высказавшему гипотезу о возможности интегративного взаимодействия опухолевых вирусов и клеток, к-рая впоследствии получила полное и повсеместное признание в качестве вирусо-генетической теории возникновения опухолей (Л. А. Зильбер, 1968).
По мере накопления данных сложилась следующая схема механизма вирусного канцерогенеза. Вирусный генетический материал закрепляется в клетке, становится составной частью клеточного генома. В составе закрепленного вирусного генома имеется ген (гены), продукт к-рого непосредственно отвечает за превращение нормальной клетки в опухолевую (такие гены получили название онкогенов). Продукт онкогена («раковый белок»), образующийся в результате функционирования онкогена, стойко нарушает нормальную регуляцию клеточного деления — клетка становится опухолевой. Что же касается химических и физических канцерогенных факторов, то они усиливают активность до той поры не проявлявших своей опухолевой природы вирусов.
Усиление опухолеродных свойств О. в. при заражении животных не-онкогенными вирусами было впервые описано советским вирусологом Н. П. Мазуренко в 1957—1962 гг. и получило наименование вирусновирусного коканцерогенеза (см. Онкогенез).
Помимо РНК-содержащих О. в., попадающих в клетку извне, обнаружены так наз. эндогенные онковирусы, генетическая информация к-рых содержится в геноме всех клеток данного вида животных (в т. ч. и в геноме половых клеток). Клетки природных хозяев всех известных эндогенных вирусов неблагоприятны для размножения этих вирусов. Роль эндогенных онковирусов неизвестна. Советские вирусологи В. М. Жданов и Т. И. Тихоненко высказали предположение, что эти эндогенные онковирусы могут являться одним из факторов клеточной дифференцировки и обмена генетической информации в биосфере.
Из дополнительных материалов
Известно, что как ДНК-содержащие, так и РНК-содержащие онкогенные вирусы вызывают опухоли у экспериментальных животных. ДНК-содержащие онкогенные вирусы обнаружены среди вирусов группы оспы, герпеса, аденовирусов, паповавиру-сов, а РНК-содержащие онкогенные вирусы — только среди ретровирусов. Онкогенные вирусы способны вызывать опухоли практически у всех представителей хордовых животных за исключением, как полагали до недавнего времени, человека. В связи с невозможностью использования прямых экспериментальных доказательств были установлены закономерности, на основании к-рых с помощью косвенных методов можно судить об участии вирусов в малигнизации клеток организма человека: регулярное обнаружение вирусов в опухолевых клетках и отсутствие в тканях в норме; способность этих вирусов вызывать опухоли у родственных видов животных и злокачественную трансформацию чувствительных клеток в культуре ткани; их морфологическое, биохимическое или иммунологическое сходство с известными онкогенными вирусами, вызывающими опухоли и лейкозы у млекопитающих и птиц; наличие в опухолевых клетках генетического материала — ДНК или РНК вируса. Наиболее изучены в этом отношении РНК-содержащие онкогенные вирусы, к-рые можно разделить на три основные группы: вирусы, вызывающие лейкозы; вирусы, способные вызывать различные виды сарком и лейкозов, а также злокачественную трансформацию клеток в культуре ткани; вирусы, обусловливающие развитие опухолей молочных желез. При изучении РНК этих вирусов было выявлено наличие в них трех принципиальных групп генов: структурных генов вирионов, ответственных за синтез белков вирусной частицы (ген gag кодирует белки сердцевины вириона, ген env — белки оболочки вириона, ген pol — обратную транскриптазу, или ревертазу); гена, имеющегося только у вирусов, вызывающих саркомы, и непосредственно связанного со способностью вирусов вызывать злокачественную трансформацию клеток (этот ген получил название онкогена); функционального гена, представляющего собой нуклеотидные последовательности, имеющие функциональное значение и необходимые для регуляции транскрипции указанных генов. Биологически активные вирионы содержат полные гены gag, pol env и функциональный ген, однако среди вирусов, вызывающих саркомы и лейкоз, а также злокачественную трансформацию клеток в культуре ткани, имеется большое количество вирусов с дефектами этих генов, размножение таких вирусов возможно только в присутствии других вирусов, вызывающих лейкоз.
Наличие онкогенов характерно не только для ретровирусов: они обнаружены и у ДНК-содержащих вирусов — паповавирусов (полио-мы и SV-40) и аденовирусов. Размер этих генов коррелирует с размерами онкогенов. Доказательство существования в составе генома РНК-содержащих вирусов онкогенов, ответственных за злокачественную трансформацию клеток, открыло новую главу в экспериментальной онкологии. Практически у всех известных трансформирующих ретро-вирусов с помощью методов молекулярной биологии и генетической инженерии были выделены, очищены и клонированы онкогены. Оказалось, что онкогены обладают одним уникальным свойством: при внесении в чувствительные клетки они вызывают наследственную злокачественную трансформацию клеток. Это прямое экспериментальное доказательство того, что единственный ген в составе ретровирусов (а не вирусные частицы в целом) способен трансформировать клетку. Онкогены различаются по тестам молекулярной гибдадизации и синтезируют в зараженных клетках специфический белок.
Отдельную группу составляют онкогены вирусов сарком птиц Рауса, В 77, Фудзинами, У 73, ЭШ, вируса лейкоза мышей Абельсона, нек-рых штаммов вирусов сарком кошек. Продукты этих онкогенов обладают ферментативной (так наз. фосфо-протеинкиназной) активностью, обусловливающей фосфорилирование нек-рых клеточных белков, в т. ч. и тех, к-рые играют важную роль в контакте клеток между собой. По-видимому, изменение структуры этих белков является одним из основных факторов, определяющих образование трансформированного фенотипа клеток.
Продукты другой группы онкогенов — онкогенов вирусов эритробластоза птиц (AEV) и саркомы кошек — являются гликопротеидами и также связаны с поверхностными белками клетки. Продукт онкогена вируса AEV имеет родство с рецептором эпидермального фактора роста.
К третьей группе принадлежат онкогены семейства ras вирусов саркомы крыс Кирстена, Харви и Рашида. Онкогены этой группы активно функционируют во многих опухолях человека. Продукт онкогена этой группы — белок р21 обладает способностью связывать гуаниловые нуклеотиды.
Четвертая группа, к к-рой относятся онкогены вирусов сарком мышей Молони и обезьян (онкоген sis), характеризуется тем, что синтез онкогенов в очень небольших количествах происходит в индуцированных ими опухолевых клетках, причем белок онкогена sis обладает гомологией к тромбоцитарному фактору роста.
К пятой группе принадлежат онкогены (онкоген шус) вирусов мие-лоцитоматоза птиц (МС 29), миело-бластоза птиц и остеосаркомы мышей (FBJ). Продукты этих онкогенов локализованы в ядре. У онкогена туе выявлена способность переводить клетки в так наз. имморта-лизованное состояние, характеризующееся тем, что клетки, оставаясь морфологически нормальными, приобретают способность к неограниченному числу делений при пассировании в культуре ткани, т. е. становятся «вечноживущими».
В большинстве ретровирусов присутствует по одному онкогену, однако в нек-рых имеется по два, в частности в вирусе эритробластоза птиц (AEV), в вирусах острых лейкозов птиц (МН 2, Е 26) и остеосаркомы мышей (FBJ).
Онкогены являются составной частью вирусного генома и подчиняются основным закономерностям репликации ретровирусов. Содержащийся в составе вируса фермент обратная транскриптаза присутствует в цитоплазме зараженных клеток и участвует в синтезе ДНК-копии вирусного генома, к-рая затем переносится в ядро и интегрирует с клеточным геномом. После интеграции вирусные гены начинают функционировать как обычные клеточные гены. Интеграция с клеточным геномом носит неспецифический характер и имеет ряд особенностей. Непосредственно перед интеграцией вирусная ДНК образует кольцевую структуру, при этом концевые функциональные последовательности замыкаются. Такая структура, называемая провирусом, сходна с так наз. мобильными диспергированными генами, описанными Г. П. Георгиевым и В. А. Гвоздевым с соавт. Одно из основных свойств генов такого типа заключается в способности перемещаться как внутри хромосомы, так и между хромосомами. Эти перемещения оказывают существенное влияние на активность соседствующих генов. Поэтому интеграция и передислокация провируса могут изменять функциональную активность многих клеточных генов. Описанный путь передачи генетической информации через стадию ДНК расширил основные положения вирусогенетической концепции, разработанной Л. А. Зильбером.
Т. о., различные РНК-содержащие вирусы, обладающие общим свойством вызывать злокачественную трансформацию клеток, осуществляют этот процесс благодаря специальным генам (онкогенам), отличающимся друг от друга по генетической структуре и механизмам функционирования.
Использование молекулярных зондов, специфичных для вирусных онкогенов, показало, что их гомологи присутствуют в нормальных клетках практически всех видов животных, включая и насекомых. Тем самым было подтверждено высказанное ранее Фогтом (P. Vogt) и А. Д. Альт-штейном предположение о клеточном происхождении онкогенов. Свойства клеточных онкогенов (или протоонкогенов) оказались в целом сходными с вирусными, однако обнаружен и ряд существенных отличий.
Клеточные онкогены имеют структуру, похожую на структуру других клеточных генов. Как правило, в виде единственной копии они локализованы на определенных хромосомах, имеют большие размеры, чем вирусные онкогены, но размеры кодируемых ими РНК в целом соответствуют или несколько превышают размеры РНК, специфичных для вирусных онкогенов. При сравнении нуклеотидных последовательностей вирусных и клеточных онкогенов также не обнаружено существенной разницы между ними, за исключением незначительных различий в концевых структурах. Продукты онкогенов в нормальных клетках (онкобелки) имеют несколько большие размеры, чем продукты вирусных онкогенов, но обладают тем же видом ферментативной активности, что и продукты вирусных онкогенов. Онкогены нормальных клеток являются слабо экспрессируемыми генами, и в большинстве нормальных клеток содержание продукта онкогена в 100—1000 раз меньше, чем в клетках, трансформированных вирусом. Нек-рые из них могут селективно экспрессироваться на разных стадиях эмбриогенеза или дифференцировки клеток. Основное отличие вирусных онкогенов от клеточных заключается в том, что последние не обладают способностью трансформировать клетки в культуре ткани, но вместе с тем нек-рые из клеточных онкогенов, выделенные из спонтанных опухолей или из опухолей, индуцированных химическими канцерогенами, вызывали злокачественную трансформацию клеток в культуре ткани.
Т. о., аналоги всех вирусных онкогенов имеются как в нормальных, так и в опухолевых клетках. Во многих опухолевых клетках описаны характерные изменения в структуре клеточных онкогенов, к-рые, по-видимому, непосредственно связаны со злокачественной трансформацией. Доказано существование нескольких типов таких изменений. Первое из них — появление мутаций в онкогене, выявленное в клеточных линиях, полученных из клеток рака мочевого пузыря человека. В этих линиях выявляется повышенная экспрессия клеточного онкогена ras (гомолога гена вируса саркомы мышей Харви), обусловленная точечной мутацией в этом гене, при этом аминокислота глицин в положении 12 заменяется на валин. Это изменение является одним из основных в последующей цепи превращений нормальной клетки в опухолевую. Другой тип изменений онкогена в опухолевых клетках — увеличение его транскрипционной активности, напр, в лимфомах бурсы цыплят, где происходит резкое усиление синтеза клеточного онкогена туе (гомолога гена вируса миелоцитомато-за птиц). Эти опухоли возникают у цыплят при заражении вирусом лимфатического лейкоза птиц, в к-ром отсутствует онкоген, но имеются структурные гены вируса (см. выше), а также функциональные последовательности (обозначаемые LTR), включающие сигналы контроля синтеза РНК (промоторы). В лимфомах бурсы цыплят активация синтеза myc-гена происходит за счет присоединения LTR из вируса лимфоидного лейкоза к онкогену туе.
Другой вид активации клеточного онкогена, обнаруженный в лимфомах кур и человека, заключается в последовательном «включении» нескольких клеточных онкогенов, начальным- этапом к-рого является транслокация фрагментов хромосом.
Доказано наличие в опухолевых клетках еще двух типов изменений онкогенов. В нек-рых линиях, полученных из лейкозных клеток человека (в частности, К 562), имеют место внутренние перестройки в онкогене abi (гомолог гена вируса лейкоза Абельсона), что и приводит к увеличению синтеза измененного продукта этого гена. В линии клеток HL 60, полученной из лейкозных промиелоцитов человека, наблюдается более чем 10-кратная амплификация (увеличение числа копий) гена туе с одновременным возрастанием его транскрипционной активности.
Следовательно, клетки в норме содержат гомологи вирусных онкогенов, к-рые в различных опухолях могут дифференцированно экспрессироваться с помощью различных механизмов, выполняя т. о. одну из ключевых ролей в начальных этапах превращения нормальной клетки в опухолевую.
Доказательства присутствия трансформирующих генов в опухолях животных и человека были получены в опытах по трансфекции, основанных на внесении ДНК опухолей в чувствительные клетки мышей, в результате к-рой происходила их злокачественная трансформация. Положительные результаты получены для ДНК, выделенной из опухолевой ткани при раке легкого, кишечника, мочевого пузыря, печени, молочной железы, лимфомах, нек-рых видах лейкозов, нейробластомах и ряде сарком. С помощью методов молекулярной гибридизации показано, что в большинстве случаев активный трансформирующий ген опухолей человека представлен одним из онкогенов семейства ras. В ряде других опухолей трансформирующие гены еще не идентифицированы, но они отличаются от всех известных вирусных онкогенов.
Если биологически активный ген ras выделить из состава ДНК и внести в клетку без остальной части клеточной ДНК, то его способность к осуществлению трансформации клетки резко падает. Ее можно восстановить при внесении вместе с геном ras в чувствительные клетки генов-иммортализаторов типа онкогена туе или ранних генов аденовирусов и паповавирусов (см. выше). Это свидетельствует о том, что иммортализация клеток является необходимой предпосылкой их малигнизации. Таким образом, первичные этапы, связанные с превращением клеток в опухолевые, обусловлены последовательной активацией нескольких клеточных генов, среди к-рых главная роль принадлежит аналогам вирусных онкогенов, что согласуется с положением о много-этапности и многофакторности процесса развития злокачественной опухоли.
Следовательно, изучение онкогенов внесло в онкологию принципиально новую и важную информацию для понимания природы злокачественных опухолей: наличие в составе клеток специальных генов (гомологичных трансформирующим генам РНК-содержащих онко генных вирусов), к-рые в определенных условиях способны перестраивать свою программу таким образом, что размножение клеток выходит из-под контроля и приводит к развитию опухоли.
Иначе складывается ситуация с РНК-содержащими вирусами, к-рые не имеют онкогена, но вызывают различные формы лейкозов у экспериментальных животных. Получены данные, свидетельствующие о том, что вирусы подобного тина способны вызывать лейкозы и у человека. От больных с Т-клеточным лейкозом выделен ретровирус, к-рый по биохимическим и морфологическим признакам сходен с классическими вирусами, вызывающими лейкозы у животных. Вирус оказался способным трансформировать лимфоциты нормальных доноров, но наибольший эффект наблюдался в том случае, если использовали лимфоциты родственников больных. Вирус обладал высокой тропностью и был способен размножаться только в Т-лимфоцитах человека. Он получил обозначение HTLV (human Т-cell leucemia virus) и был выделен одновременно в лабораториях Галло (R. С. Gallo) в США и Хинумы (Y. Hinuma) в Японии. У больных с синдромом приобретенного иммунного дефицита (СПИД) из крови выделен HTLV-подобный вирус, а в Т-лимфоцитах обнаружен интегрированный вирусный геном. Следовательно, два родственных (сходных) вируса, взаимодействуя с Т-лимфоцитами человека, способны вызывать два разных заболевания — лейкоз и СПИД.
До сих пор остается неясным механизм действия вируса опухолей молочных желез мышей. Основная особенность этого вируса по сравнению с другими РНК-содержащими онкогенными вирусами заключается в том, что в составе функциональных последовательностей (LTR) этого вируса имеются участки, позволяющие вирусу синтезировать в клетках дополнительный белок, функция к-рого пока не установлена. Кроме того, в составе функциональных последовательностей вируса обнаружены участки, контролирующие чувствительность к гликокортикоид-ным гормонам.
Последняя группа РНК-содержащих онкогенных вирусов — так наз. вирусы D-типа, выделенные из опухолевых клеток человека и обезьян и являющиеся лишь «пассажирами» в них, несмотря на большое сходство с онкогенными ретровирусами. Наиболее интересен тот факт, что нек-рые представители вирусов этой группы могут вызывать у обезьян заболевание, сходное по клинической картине со СПИД.
Следовательно, вне зависимости от того, каков окончательный итог взаимодействия ретровирусов с клеткой, оно осуществляется при участии двух геномов — вирусного и клеточного. В тех случаях, когда вирус имеет онкоген, происходит интеграция вирусного генома с клеточным, и вирусный онкоген перестраивает программу клетки путем синтеза собственных продуктов, направляющих клетку на неконтролируемый рост. В других случаях часть вирусного генома может активировать другие клеточные гены (прежде всего онкогены клетки), к-рые приводят либо к неконтролируемому делению (развитие опухоли), либо к изменению в дифференцировке клеток (различные виды лейкозов). Активация клеточных онкогенов, по-видимому, возможна и в результате воздействия других факторов (химические канцерогены, различные гормоны и факторы окружающей среды).
Успехи в понимании природы опухолевого роста и роли в этом процессе РНК-содержащих онкогенных вирусов в основном связаны с изучением молекулярных процессов, происходящих в трансформированных клетках. В отношении ДНК-содержащих онкогенных вирусов и особенно их роли в этиологии опухолей человека конкретная информация отсутствует. Одна важная особенность объединяет между собой онкогенные вирусы группы герпеса, аденовирусы и паповавирусы: в составе генома этих вирусов, молекулярная масса к-рых варьирует от 100 X 106 до 3 X 106, имеются специальные гены, осуществляющие иммортализацию клеток (см. выше), т. е. заражение клеток этими вирусами может приводить к их конверсии и предтрансформирован-ному состоянию, а затем действие ряда других факторов может вывести зараженные клетки из-под контроля деления и дифференцировки. Кроме того, в составе ДНК-содержащих вирусов выявлены последовательности, к-рые могут усиливать транскрипцию других клеточных генов после интеграции вирусной ДНК в клеточный геном.
Большой интерес представляют собой вирусы группы папиллом. До недавнего времени полагали, что эти вирусы вызывают доброкачественные опухоли типа папиллом, причем в зараженных клетках выявляли геном этих вирусов в неинтегрированной форме. Выделено два новых папилломатозных вируса, связанных со злокачественными опухолями половых органов. В этих опухолях (в отличие от доброкачественных) вирусный геном интегрирован с клеточной ДНК. Характерно, что интегрированная ДНК обнаруживалась только в опухолях половых органов, но никогда не выявлялась в опухолях другой локализации.
Таким образом, основным достижением в изучении механизма онкогенеза является обнаружение онкогенов, играющих ключевую роль в процессах превращения нормальных клеток в опухолевые.