Что такое перекись водорода с точки зрения химика
Перекись водорода: помощь или вред?
Перекись водорода была впервые получена химиком Луисом Тенеро в 1818 году и уже очень скоро стала применяться в промышленности. Сейчас ее повсеместно используют в хозяйстве и быту.
1 Что такое перекись водорода: химическая формула и свойства
Перекись водорода это простейший представитель пероксидов. Он представляет собой прозрачную жидкость со своеобразным металлическим вкусом и слабым запахом, способную неограниченно растворяться в спирте, воде и эфире.
Химическая формула

Химические свойства
При взаимодействии с определенными металлами, такими например, как Mn или Fe, происходит активная химическая реакция
Распад вещества быстрее происходит в щелочной среде, кислотная же среда наоборот замедляют процесс. Именно поэтому в раствор часто добавляют фосфорную кислоту. В термических условиях H2O2 быстро разлагается, поэтому не рекомендуется хранить его на свету.
Пероксид водорода хорошо смешивается с C2H5OH (спиртом) и H2O (водой) в любых пропорциях.
Реакция распада перокисда водорода
Кислотная среда более подходящаая среда для распада. Щелочная же более подходит для восстановления
Пример реакции восстановления мы можем наблюдать при взаимодействии H2O2 с серебром
Аналогично, по существу, протекает его взаимодействие с озоном (О3 + Н2О2 = 2 Н2О + 2 О2) и с перманганатом калия в кислой среде:
Последняя реакция применяется для количественного определения пероксида водорода.
2 Основные лечебные свойства
3 Способы применения
Уже многие годы перекись водорода используется в различных областях применения благодаря своей эффективности и доступности. Его применение основывается в первую очередь на его окисляющих свойствах.
В традиционной медицине
В косметологии
Препарат используется на коже, склонной к излишней жирности и появлению акне, черных точек, благодаря способности уничтожать возбудителей инфекции. Для этого 5 капель 3% раствора добавляют к 50 мл тоника. Косметологи советуют его наносить не более 2 раз в неделю.
Людям с веснушками и пигментными пятнами вещество также подойдет за счет его отбеливающего свойства. Чтобы провести процедуру, применяют специальные маски. Взять ст. л. 20% творога, сырой желток и 5 капель перекиси. Все ингредиенты перемешиваются до однородной структуры, а затем кисточкой наносятся на кожный покров. Слегка массируют, оставляя маску на 15 мин. По истечении времени масса смывается, а на лицо накладывают увлажняющий крем.
Применение в быту
Благодаря полезным свойствам Н2О2 можно не только устранить желтые пятна, разводы с белой материи и удалить налет на кафельной плитке, но и избавиться от грибка и плесени.
Чтобы почистить плитку в ванной комнате, взять 40 мл пероксида, ч. л. жидкого мыла и полстакана пищевой соды. Компоненты хорошо перемешать и нанести на влажную губку, которой оттереть проблемные участки. Если загрязнений много, нужно оставить массу на 10 минут, чтобы они растворились.
Для очистки материала берут 3% раствор, который вливают на пятна. Оставляют на 20-30 минут, а затем смывают с поверхности.
Перекись водорода в народной медицине
4 Польза или вред?
Если человек хорошо переносит пероксид и правильно им пользуется, он не должен вызвать каких-либо неблагоприятных последствий.
Нельзя употреблять вещество внутрь, это опасно появлением отравления. При полоскании рта иногда теряется чувствительность языка и могут гипертрофироваться его сосочки.
Также не стоит использовать при наличии у человека индивидуальной непереносимости. Это может повлечь за собой развитие аллергической реакции.
5 Форма выпуска и возможные противопоказания препарата
Изготавливается в виде 3% раствора для наружного местного нанесения.
6 Метод Неумывакина: что это?
Это лечение с успехом применяется в нетрадиционной медицине. Профессор Неумывакин считал перекись панецеей от всех заболеваний. Принцип действия он объяснял укрепляющим эффектом лекарства: при взаимодействии с кровью и ферментом каталазой оно распадается до воды и кислорода, который разжижает кровь, нормализует обменные процессы и улучшает деятельность органов и систем.
Если ожидаемый эффект не достигался, профессор считал, что организм чрезмерно зашлакован. Поэтому он рекомендовал проводить полную очистку.
Метод не признан официальной медициной, так как его противники утверждают, что перекись не только неэффективна, но и может причинить опасность при использовании не по назначению.
В нашей следующей статье мы поговорим об особенностях применения каустической соды.
Что такое перекись водорода с точки зрения химика
Что такое перекись водорода с точки зрения химика
Наверное, не найдется среди читателей ни одного человека, который бы хоть раз в жизни не пользовался перекисью водорода, поэтому в ответ на вопрос: «Что собой представляет эта жидкость?», каждый сможет хотя бы описать ее – бесцветная, без запаха, почти как вода. В принципе, все это верно. Но мы в основном сталкиваемся с аптечным раствором перекиси водорода в концентрации 3%. Чистую перекись мало кто видел, не было надобности. В быту и в медицинских целях она никогда не используется.
Перекись водорода – очень близкая родственница воды, и по своей химической формуле отличается от нее только одним лишним атомом кислорода – Н 2О 2. Но этот лишний атом придает перекиси свойства, очень сильно отличающие ее от обычной воды.
Если посмотреть на структурную формулу перекиси водорода, мы увидим, что два атома кислорода соединены непосредственно друг с другом. Связь эта крайне непрочна, поэтому молекула перекиси неустойчива. Чистая, неразбавленная перекись водорода способна разлагаться на воду и кислород со взрывом. В разбавленных водных растворах она значительно устойчивее.
Молекула перекиси водорода не представляет собой линейную последовательность атомов водорода и кислорода. Связи между атомами водорода и кислорода расположены под прямым углом к связи между атомами кислорода, причем в нескольких вариантах. Графически молекулу перекиси можно изобразить так:
Такая структура молекулы перекиси водорода обусловливает ее нестабильность, что и используется как в промышленности, так и в медицине. В результате разрыва связей между атомами перекись водорода распадается на воду и кислород. Некоторые соединения металлов (например, меди, железа, марганца) действуют как катализаторы, то есть способствуют быстрейшему разложению перекиси водорода, причем даже в очень малых количествах. Поэтому при хранении перекиси для предотвращения ее распада (что происходит со взрывом) добавляются вещества-стабилизаторы.
Как и ближайшая химическая родственница вода, перекись водорода хорошо растворяет многие соли, с водой (а также со спиртом) смешивается в любых соотношениях. Следует отметить, что кислая среда препятствует распаду перекиси водорода, поэтому, опять же, при хранении больших объемов перекиси ее подкисляют серной или фосфорной кислотой (естественно, это касается только промышленного использования перекиси).
При нагревании или воздействии света разложение перекиси усиливается, хранить бутылочку с ней (чаще всего сейчас в аптеках перекись продают в прозрачных пластиковых флаконах) желательно в прохладном темном месте.
Отличается перекись водорода от воды и по своим физическим свойствам. Ее температура замерзания близка к воде, при 0,5 °С перекись превращается в лед. Причем, в отличие от воды, при этом сжимается, а не расширяется. При замерзании образуются белые кристаллы, и после размораживания перекись не теряет своих свойств. Закипает перекись при температуре 67 °С.
Перекись водорода – очень сильный окислитель, то есть она легко отдает свой лишний (по сравнению с более устойчивым соединением – водой) атом кислорода. Так, если капнуть чистой или высококонцентрированной перекисью на бумагу, опилки или иные горючие вещества, они воспламенятся (напомню, что огонь – это энергия, выделяющаяся при окислении). Именно это свойство – высокая степень окисления – и обусловливает широкое применение перекиси, прежде всего в промышленности. Большая часть производимой ежегодно перекиси (а это более 100 тысяч тонн) используется в химической промышленности и энергетике. Схематически формулу окислительного распада перекиси водорода можно изобразить так:
Н 2О 2 = Н 2О + О – (на окисление).
Такая формула характерна для кислой среды. В щелочной среде формула будет выглядеть так:
Н 2О 2 = О 2 + 2Н + (на восстановление).
Самым простым способом получения перекиси водорода является воздействие на пероксид бария (ВаО 2) разбавленной серной кислотой. В результате образуется перекись и нерастворимая в воде соль, удаляемая путем фильтрования. Но основную массу перекиси получают методом взаимодействия с водой надсерной кислоты (H 2S 2O 8) или некоторых ее солей.
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРес
Читайте также
Перекись водорода
Перекись водорода Перекись водорода – простое химическое соединение. Это вода с одним дополнительным атомом кислорода – Н2О2, окисляющее вещество, которое, подобно озону, способно высвободить один атом кислорода в присутствии другого вещества. Такая реакция
Перекись водорода
Перекись водорода Перекись водорода – простое химическое соединение. Это вода с одним дополнительным атомом кислорода – Н2О2, окисляющее вещество, которое, подобно озону, способно высвободить один атом кислорода в присутствии другого вещества. Такая реакция
Глава 12 Перекись водорода и атеросклероз
Глава 12 Перекись водорода и атеросклероз Хорошо помню, как лет пять назад один из моих пациентов просто огорошил меня вопросом: «Ирина Александровна, а что, действительно, перекись водорода так полезно пить?» Некоторое время я просто слова вымолвить не могла. Потом
Перекись водорода в природе
Перекись водорода в природе Перекись водорода – это совсем не искусственное соединение, которое можно получить только путем химических реакций в лабораторных условиях. Природа вокруг нас содержит это соединение в значительных количествах. Перекись содержится в
Перекись водорода – лекарство
Перекись водорода – лекарство Проста, дешева, но невыгодна Принимая те или иные лекарства для лечения наших болезней, мы по большей части не особенно задумываемся, как они устроены, что входит в их состав, как они разрабатывались. Даже если бы захотели это выяснить,
Перекись водорода и другие заболевания
Перекись водорода и другие заболевания Я подробно рассказал о некоторых группах заболеваний. Но это не значит, что перекись водорода эффективна только в этих случаях. Оказывая сильный целительный эффект, перекись может способствовать излечению многих других болезней.
Что такое перекись водорода
Что такое перекись водорода Наверное, не найдется среди читателей ни одного человека, который бы хоть раз в жизни не пользовался перекисью водорода, поэтому в ответ на вопрос: «Что собой представляет эта жидкость?», каждый сможет хотя бы описать ее – бесцветная, без
Перекись водорода
Перекись водорода Перекись водорода – простое химическое соединение. Это вода с одним дополнительным атомом кислорода – Н2О2, окисляющее вещество, которое, подобно озону, способно высвободить один атом кислорода в присутствии другого вещества. Такая реакция называется
Перекись водорода
Перекись водорода Перекись водорода – прекрасное очистительное средство: уничтожает в организме все вредное (в том числе бактерии, вирусы), что мешает организму функционировать. В то же время перекись – прекрасное средство от любой болезни.Терапевтический эффект:
И снова перекись водорода…
И снова перекись водорода… Когда я знакомился с научной литературой последних лет, у И. И. Дедова с соавторами (2004), прочитал, что «…средств, излечивающих сахарный диабет и артериальную гипертензию в настоящее время не существует, однако соответствующая терапия может
Перекись водорода
Перекись водорода Общие сведения о перекиси водорода Перекись водорода — хорошо известный препарат. Сведения о целебных свойствах этого препарата появились в медицинской литературе уже в начале XX века. Однако вскоре их сочли неподтвержденными и
Целебная перекись водорода
Целебная перекись водорода Формы выпуска и применение Перекись водорода выпускается в разных формах и концентрациях. В нашей стране производят в основном пергидроль и гидроперит.Пергидроль, или Solutio Нуdrogenii реroxidi diluta, — самая распространенная форма раствора перекиси
Перекись водорода в быту
Перекись водорода в быту Налицо широкий спектр возможностей для использования перекиси водорода в повседневной жизни, быту, кулинарии и сельском хозяйстве.Примечание. В рецептах и советах по применению Н2О2 имеется в виду 3 %-ный раствор перекиси водорода, который
ГЛАВА 1 ЧТО ТАКОЕ ПЕРЕКИСЬ ВОДОРОДА?
ГЛАВА 1 ЧТО ТАКОЕ ПЕРЕКИСЬ ВОДОРОДА? ОПИСАНИЕ ПЕРЕКИСИ ВОДОРОДА Перекись водорода (Н202) — бесцветная прозрачная жидкость, обладающая выраженным бактерицидным и спороцидным действием. Выпускается перекись водорода в виде 27,5–40 %-ных растворов (пергидроль), рабочие
Строение молекулы и физические свойства
Пероксид представлен в виде бесцветной жидкости с «металлическим» вкусом и специфическим запахом. Вязкая консистенция обусловлена развитой системой водородных связей в молекулярной структуре.
Основные физические свойства перекиси водорода:
Молекула вещества является полярной, поскольку её строение несимметричное. Соединение может неограниченно растворяться в воде, эфире и спирте. Чистое вещество неустойчиво и способно самопроизвольно разлагаться со взрывом.
Химические особенности
Перекись обладает слабыми кислотными свойствами, поэтому она диссоциирует по двум ступеням:
Вещество по степени кислотности немного сильнее H2O. Некоторые пероксиды металлов можно рассматривать как его соли. В кислой среде перекись служит окислителем, а в щелочной — восстановителем.
Способы получения вещества
Сначала пероксид водорода получали в промышленности с помощью электролиза серной кислоты или раствора сульфата аммония в H2SO4. В результате реакции получалась надсерная кислота. После гидролиза вещества образовывались пероксид и серная кислота.
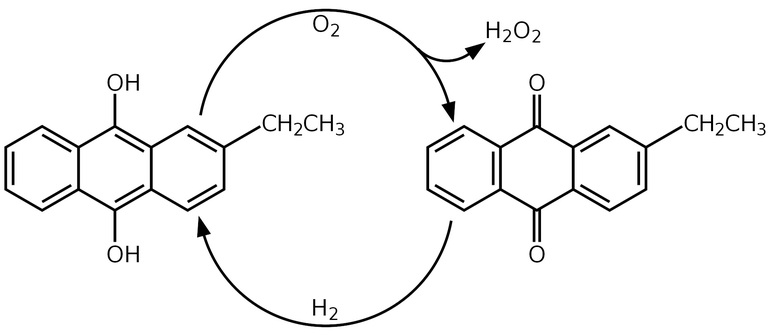
В середине XX века открыли новый способ получения перекиси водорода. Антрахиноновый процесс был разработан компанией BASF. При этом методе водород окисляется кислородом воздуха, после чего образуются антрахиноны и пероксид водорода. Реакцию проводят в растворе алкилантрагидрохинонов в бензоле, который служит катализатором. В него также добавляют вторичные спирты. На завершительной стадии процесса катализатор убирают, а из получившейся смеси продуктов выделяют пероксид водорода путём перегонки при сниженном давлении.
В лабораторных условиях вещество получают с помощью пероксида бария и соляной кислоты. Уравнение взаимодействия соединений: BaO2+2HCl → BaCl2+H2O2. Получившийся хлорид бария осаждают в виде сульфата. Пероксид водорода также можно извлечь при помощи каталитического окисления изопропилового спирта.
В некоторых источниках есть информация, что нужное вещество может образоваться при взаимодействии пероксида бария с серной кислотой, однако такую технологию обычно не используют. Поскольку осадок сульфата бария формируется на зёрнах его пероксида, реагент покрывается нерастворимой оболочкой, которая замедляет реакцию и выход нужного продукта.
Меры предосторожности
Во время работы с концентрированным раствором перекиси необходимо соблюдать меры безопасности. Хотя вещество нетоксично, при попадании в дыхательные пути или на кожный покров и слизистые оно вызывает сильные ожоги. Недостаточно чистый пероксид высокой концентрации может быть взрывоопасен. Всю работу с веществом нужно проводить в «беспылевых» условиях и при отсутствии ионов металлов.
Растворы перекиси водорода относятся к 3-му классу опасности. Вещество может вызывать деструктивные изменения, которые схожи с действием щелочей. Летальная доза пергидроля (название раствора концентрации 30%) составляет 50−100 мл.
Упаковку с аптечным средством необходимо хранить в тёмном месте. При транспортировке нужно избегать встряхивания вещества и других механических воздействий, которые могут привести к его разложению.
Сферы использования
Пероксид водорода может быть разной концентрации. Поскольку растворы обладают различными свойствами, их часто используют в промышленности и быту:
Перекись широко используется в области косметологии. Ею обесцвечивают волосы и отбеливают зубы. Поскольку процесс основан на окислении, локоны часто портятся, поэтому вещество не советуют применять обладателям тонких и повреждённых прядей. С зубами не наблюдается дефектов, поскольку с прозрачной эмалью эффект отбеливания достигается за счёт разницы в отражении света дентином.
Применение в области медицины
Широкое применение перекиси водорода нашли в медицине. Средство с бактерицидным механизмом действия предназначено для внешнего использования. Перед применением необходимо тщательно изучить инструкцию к лекарству.
Формы выпуска пероксида водорода:
Препаратом лечат гнойные раны и воспалённые слизистые оболочки. Средство используется при носовых и капиллярных кровотечениях, а также для промывки и глубокой очистки ран. Медицинским раствором обрабатывают ротовую полость и горло при ангине, стоматите или тонзиллите. Средство также избавляет кожный покров от пигментных пятен. С помощью лекарства убирают серные пробки при чистке ушей. Препарат применяется в гинекологии для лечения различных женских патологий.
При лёгкой механической очистке ватный тампон смачивают в 3%-м растворе и обрабатывают им поражённые участки кожи. Для компрессов применяют перекись с концентрацией 1 процент. Продолжительность процедуры не должна превышать 30 мин. Для обработки участков кожи с пигментными пятнами используют пергидроль. Ротовую полость или органы половой системы обрабатывают 0,25%-м раствором.
Применение перекиси водорода противопоказано при индивидуальной непереносимости вещества. В редких случаях негативные последствия могут проявиться в жжении во время процедуры и аллергии в виде красных пятен на коже. При длительной терапии после обработок ротовой полости может возникнуть гипертрофия сосочков языка. Если соблюдать дозировку и схему применения перекиси водорода в соответствии с инструкцией, тогда получится избежать побочных действий.
Bookitut.ru
Что такое перекись водорода с точки зрения химика
Наверное, не найдется среди читателей ни одного человека, который бы хоть раз в жизни не пользовался перекисью водорода, поэтому в ответ на вопрос: «Что собой представляет эта жидкость?», каждый сможет хотя бы описать ее – бесцветная, без запаха, почти как вода. В принципе, все это верно. Но мы в основном сталкиваемся с аптечным раствором перекиси водорода в концентрации 3%. Чистую перекись мало кто видел, не было надобности. В быту и в медицинских целях она никогда не используется.
Перекись водорода – очень близкая родственница воды, и по своей химической формуле отличается от нее только одним лишним атомом кислорода – Н2О2. Но этот лишний атом придает перекиси свойства, очень сильно отличающие ее от обычной воды.
Если посмотреть на структурную формулу перекиси водорода, мы увидим, что два атома кислорода соединены непосредственно друг с другом. Связь эта крайне непрочна, поэтому молекула перекиси неустойчива. Чистая, неразбавленная перекись водорода способна разлагаться на воду и кислород со взрывом. В разбавленных водных растворах она значительно устойчивее.
Молекула перекиси водорода не представляет собой линейную последовательность атомов водорода и кислорода. Связи между атомами водорода и кислорода расположены под прямым углом к связи между атомами кислорода, причем в нескольких вариантах. Графически молекулу перекиси можно изобразить так:
Такая структура молекулы перекиси водорода обусловливает ее нестабильность, что и используется как в промышленности, так и в медицине. В результате разрыва связей между атомами перекись водорода распадается на воду и кислород. Некоторые соединения металлов (например, меди, железа, марганца) действуют как катализаторы, то есть способствуют быстрейшему разложению перекиси водорода, причем даже в очень малых количествах. Поэтому при хранении перекиси для предотвращения ее распада (что происходит со взрывом) добавляются вещества-стабилизаторы.
Как и ближайшая химическая родственница вода, перекись водорода хорошо растворяет многие соли, с водой (а также со спиртом) смешивается в любых соотношениях. Следует отметить, что кислая среда препятствует распаду перекиси водорода, поэтому, опять же, при хранении больших объемов перекиси ее подкисляют серной или фосфорной кислотой (естественно, это касается только промышленного использования перекиси).
При нагревании или воздействии света разложение перекиси усиливается, хранить бутылочку с ней (чаще всего сейчас в аптеках перекись продают в прозрачных пластиковых флаконах) желательно в прохладном темном месте.
Отличается перекись водорода от воды и по своим физическим свойствам. Ее температура замерзания близка к воде, при 0,5 °С перекись превращается в лед. Причем, в отличие от воды, при этом сжимается, а не расширяется. При замерзании образуются белые кристаллы, и после размораживания перекись не теряет своих свойств. Закипает перекись при температуре 67 °С.
Перекись водорода – очень сильный окислитель, то есть она легко отдает свой лишний (по сравнению с более устойчивым соединением – водой) атом кислорода. Так, если капнуть чистой или высококонцентрированной перекисью на бумагу, опилки или иные горючие вещества, они воспламенятся (напомню, что огонь – это энергия, выделяющаяся при окислении). Именно это свойство – высокая степень окисления – и обусловливает широкое применение перекиси, прежде всего в промышленности. Большая часть производимой ежегодно перекиси (а это более 100 тысяч тонн) используется в химической промышленности и энергетике. Схематически формулу окислительного распада перекиси водорода можно изобразить так:
Н2О2 = Н2О + О– (на окисление).
Такая формула характерна для кислой среды. В щелочной среде формула будет выглядеть так:
Н2О2 = О2 + 2Н+ (на восстановление).
Самым простым способом получения перекиси водорода является воздействие на пероксид бария (ВаО2) разбавленной серной кислотой. В результате образуется перекись и нерастворимая в воде соль, удаляемая путем фильтрования. Но основную массу перекиси получают методом взаимодействия с водой надсерной кислоты (Н2S2О8) или некоторых ее солей.
Что такое перекись водорода с точки зрения химика
Перекись
Водорода
Что такое перекись водорода с точки зрения химика
Наверное, не найдется среди читателей ни одного человека, который бы хоть раз в жизни не пользовался перекисью водорода, поэтому в ответ на вопрос: «Что собой представляет эта жидкость?», каждый сможет хотя бы описать ее – бесцветная, без запаха, почти как вода. В принципе, все это верно. Но мы в основном сталкиваемся с аптечным раствором перекиси водорода в концентрации 3%. Чистую перекись мало кто видел, не было надобности. В быту и в медицинских целях она никогда не используется.
Перекись водорода – очень близкая родственница воды, и по своей химической формуле отличается от нее только одним лишним атомом кислорода – Н2О2. Но этот лишний атом придает перекиси свойства, очень сильно отличающие ее от обычной воды.
Если посмотреть на структурную формулу перекиси водорода, мы увидим, что два атома кислорода соединены непосредственно друг с другом. Связь эта крайне непрочна, поэтому молекула перекиси неустойчива. Чистая, неразбавленная перекись водорода способна разлагаться на воду и кислород со взрывом. В разбавленных водных растворах она значительно устойчивее.
Молекула перекиси водорода не представляет собой линейную последовательность атомов водорода и кислорода. Связи между атомами водорода и кислорода расположены под прямым углом к связи между атомами кислорода, причем в нескольких вариантах. Графически молекулу перекиси можно изобразить так:
Такая структура молекулы перекиси водорода обусловливает ее нестабильность, что и используется как в промышленности, так и в медицине. В результате разрыва связей между атомами перекись водорода распадается на воду и кислород. Некоторые соединения металлов (например, меди, железа, марганца) действуют как катализаторы, то есть способствуют быстрейшему разложению перекиси водорода, причем даже в очень малых количествах. Поэтому при хранении перекиси для предотвращения ее распада (что происходит со взрывом) добавляются вещества-стабилизаторы.
Как и ближайшая химическая родственница вода, перекись водорода хорошо растворяет многие соли, с водой (а также со спиртом) смешивается в любых соотношениях. Следует отметить, что кислая среда препятствует распаду перекиси водорода, поэтому, опять же, при хранении больших объемов перекиси ее подкисляют серной или фосфорной кислотой (естественно, это касается только промышленного использования перекиси).
При нагревании или воздействии света разложение перекиси усиливается, хранить бутылочку с ней (чаще всего сейчас в аптеках перекись продают в прозрачных пластиковых флаконах) желательно в прохладном темном месте.
Отличается перекись водорода от воды и по своим физическим свойствам. Ее температура замерзания близка к воде, при 0,5 °С перекись превращается в лед. Причем, в отличие от воды, при этом сжимается, а не расширяется. При замерзании образуются белые кристаллы, и после размораживания перекись не теряет своих свойств. Закипает перекись при температуре 67 °С.
Перекись водорода – очень сильный окислитель, то есть она легко отдает свой лишний (по сравнению с более устойчивым соединением – водой) атом кислорода. Так, если капнуть чистой или высококонцентрированной перекисью на бумагу, опилки или иные горючие вещества, они воспламенятся (напомню, что огонь – это энергия, выделяющаяся при окислении). Именно это свойство – высокая степень окисления – и обусловливает широкое применение перекиси, прежде всего в промышленности. Большая часть производимой ежегодно перекиси (а это более 100 тысяч тонн) используется в химической промышленности и энергетике. Схематически формулу окислительного распада перекиси водорода можно изобразить так:
Н2О2 = Н2О + О–(на окисление).
Такая формула характерна для кислой среды. В щелочной среде формула будет выглядеть так:
Н2О2 = О2 + 2Н+(на восстановление).
Самым простым способом получения перекиси водорода является воздействие на пероксид бария (ВаО2) разбавленной серной кислотой. В результате образуется перекись и нерастворимая в воде соль, удаляемая путем фильтрования. Но основную массу перекиси получают методом взаимодействия с водой надсерной кислоты (H2S2O8) или некоторых ее солей.