Что является щелочью в быту
Что такое щелочь, в какие реакции вступают самые известные из них
Химия – наука, изучающая различные реакции, протекающие в природе, а также взаимодействия одних соединений с другими. Основными веществами здесь являются кислоты и щелочи, реакции между которыми обычно называются нейтрализацией. Они приводят к образованию растворимой в воде соли.
Что такое щелочь
Гидроксиды щелочных (металлы первой группы главной (А) подгруппы в периодической таблице химических элементов Д. И. Менделеева) и щелочноземельных (металлы второй группы главной (А) подгруппы, включая кальций) металлов, которые бурно взаимодействуют с водой и полностью в ней растворяются, называются щелочами. Так как они способны разрушать органический материал (кожу, древесину, бумагу), их называют едкими. Например, гидроксид калия (KOH) – едкий калий, бария (Ba(OH)2) – едкий барий и так далее.
Физические свойства сильных оснований
Исходя из определения, что такое щелочь, можно добавить, что эти гидроксиды также представляют собой твердые гигроскопичные (способные поглощать из воздуха пары воды) вещества белого цвета. К самым сильным щелочам относятся гидроксиды цезия CsOH и радия Ra(OH)2. Реакции щелочей чаще всего сопровождаются выделением тепла (экзотермические). Также к физическим свойствам таких оснований можно отнести их способность растворяться в некоторых органических соединениях, например, в спиртах: метаноле и этаноле.
Химические свойства
Растворы щелочей способны вступать в различные реакции.
Сильные основания обладают способностью взаимодействовать с кислотными и амфотерными оксидами:
При реагировании с амфотерными металлами (Zn, Al и прочие) также возможно образование как расплава, так и соответствующей комплексной соли. Причем обе реакции сопровождаются выделением газообразного водорода:
Также щелочи способны реагировать с солями, в результате чего образуется другое основание и другая соль. Условием протекания реакции является то, что в результате одно из образовавшихся веществ должно быть не растворимо в воде:
NaOH + CuSO4 = Na2SO4 + Cu(OH)2.
Как уже было упомянуто ранее, щелочи и кислоты вступают в реакцию нейтрализации, образуется соль и вода:
NaOH + HCl = NaCl + H2O.
Щелочи вступают в реакцию с другими основаниями только, если это гидроксиды амфотерных металлов:
NaOH + Al(OH)3 = Na[Al(OH)4].
Некоторые из них могут вступать во взаимодействие со многими органическими веществами: эфирами, амидами, многоатомными спиртами:
2C2H6O2 + 2NaOH = C2H4O2Na2 + 2H2O (продукт реакции – алкоголят натрия).
Как получают сильные основания
Щелочи получают разными способами как в промышленности, так и в лабораториях.
В промышленной индустрии существуют несколько методов получения щелочей: пиролиз, известковый, ферритный, электролиз, который делится на диафрагменный, мембранный и ртутный методы на жидких и твердых катодах.
Это электролиз растворов хлоридов натрия и калия, после чего на аноде и катоде выделяются хлор и водород, и получаются соответствующие гидроксиды:
При пиролизе в 1000 градусов на первом этапе происходит образование оксида натрия:
На втором этапе полученный охлажденный оксид растворяют в воде, в результате чего и получается необходимая щелочь:
В лабораториях также применяется электролиз. Еще щелочи могут получиться путем воздействия на соответствующие металлы водой или взаимодействия солей этих металлов с другими основаниями, в результате чего получается необходимая щелочь и нерастворимый в воде второй продукт реакции – соль.
2Cs + 2H2O = 2CsOH + H2.
В результате действия воды на оксид лития получается щелочь:
Li2O + 2H2O = 2LiOH + H2.
Применение
Опираясь на само определение того, что такое щелочь, можно понять, что они находят широкое применение не только в промышленности, но и в быту:
Меры предосторожности
Становится очевидным, что такие щелочи, как гидроксиды натрия, лития, калия, цезия и прочие, способны сильно повреждать и обжигать кожу и слизистые оболочки глаз даже при попадании туда мельчайших частиц соединения. Чтобы предотвратить это, необходимо носить защитные очки, резиновые перчатки, а также спецодежду, которая обработана специальными веществами, не позволяющими материалу взаимодействовать со щелочами.
Статья по химии на тему «Щелочи в быту»
Щелочи, это кристаллические основания, которые отлично растворяются в воде. Они мылкие на ощупь и являются сильными катализаторами для воздействия на различные материалы, в том числе на фарфор или стекло. Поэтому хранить их в сосудах, которые состоят из этих материалов категорически запрещено. Чаще всего для этого используют пластмассовую тару.
Каустическая сода или едкий натр, научное название – гидроксид натрия. Кристаллообразное вещество светлого желтого или полностью белого цвета, в промышленности изготавливается в виде гранул. Отлично растворяет различные жиры и обладает сильнейшим моющим эффектом. Очищает масляные пятна с разных изделий, очищает канализационные трубы от жировых наростов.
Гашеная известь или по-научному – гидроксид кальция. Чаще применяется в строительной индустрии для побелки и штукатурки стен и потолков.
Нашатырный спирт или раствор аммиака – жидкость с резким раздражающим неприятным запахом, которая негативно воздействует на слизистые глаз и носа. В быту применяется как 25-ти процентный раствор. С его помощью можно стирать шерстяные изделия и удалять пятна, которые имеют органическое происхождение: смолы, жиры, молоко. В последнее время широко используется в составах средств для мытья окон. Так как аммиак имеет отличные моющие свойства, он не оставляет разводов на поверхности стекла. Также слабый раствор нашатырного спирта используют для очистки и придания блеска изделиям из золота и серебра, для этого раствор нужно подогреть, а потом опустить туда украшения на некоторое время. Аммиак способен образовывать соединения с металлами, которые растворяются в воде.
Щелочи: понятие, свойства и применение
К щелочам принято относить гидроксиды щелочных и щелочно-земельных металлов.
Все щелочи — это основания, но не наоборот, нельзя считать определения «основание» и «щелочь» синонимами.
Правильное химическое название щелочей — гидроксид (гидроокись), например, гидроокись натрия, гидроксид калия. Часто употребляются также названия, которые сложились исторически. Ввиду того, что щелочи разрушают материалы органического происхождения — кожу, ткани, бумагу, древесину, их называют едкими: например, едкий натр, едкий барий. Однако понятием «едкие щелочи» химики определяют гидроксиды щелочных металлов — лития, натрия, калия, рубидия, цезия.
Свойства щелочей
Щелочи — твердые вещества белого цвета; гигроскопичные, водорастворимые. Растворение в воде сопровождается активным выделением тепла. Вступают в реакции с кислотами, образуя соль и воду. Эта реакция нейтрализации является важнейшей из всех свойств щелочей. Кроме этого, гидроксиды реагируют с кислотными оксидами (образующими кислородосодержащие кислоты), с переходными металлами и их оксидами, с растворами солей.
Гидроксиды щелочных металлов растворяются в метиловом и этиловом спиртах, способны выдерживать температуры до +1000 °С (за исключением гидроксида лития).

Если сравнивать щелочи по химической активности, то она увеличивается при движении по столбцу таблицы Менделеева сверху вниз.
Концентрированные щелочи разрушают стекло, а расплавы щелочей — даже фарфор и платину, поэтому растворы щелочей не рекомендуется хранить в сосудах с пришлифованными стеклянными пробками и кранами, так как пробки и краны может заклинить. Хранят щелочи, обычно, в полиэтиленовых емкостях.
Именно щелочи, а не кислоты, вызывают более сильные ожоги, так как их сложнее смыть с кожи и они проникают глубоко в ткань. Смывать щелочь надо неконцентрированным раствором уксусной кислоты. Работать с ними необходимо в средствах защиты. Щелочной ожог требует немедленного обращения к врачу!
Применение щелочей
— В качестве электролитов.
— Для производства удобрений.
— В медицине, химических, косметических производствах.
— В рыбоводстве для стерилизации прудов.
В магазине «ПраймКемикалсГрупп» вы найдете самые востребованные щелочи по выгодным ценам.
Едкий натр
Самая популярная и востребованная в мире щелочь.
Применяется для омыления жиров в производстве косметических и моющих средств, для изготовления масел в процессе нефтепереработки, в качестве катализатора и реактива в химических реакциях; в пищепроме.
Едкое кали
Применяется для производства мыла, калийных удобрений, электролитов для батареек и аккумуляторов, синтетического каучука. Также — в качестве пищевой добавки; для профессиональной очистки изделий из нержавеющей стали.
Гидроксид алюминия
Востребован в медицине как отличный адсорбент, антацид, обволакивающее средство; ингредиент вакцин в фармацевтике. Кроме этого, вещество применяется в очистных сооружениях и в процессах получения чистого алюминия.
Гидроокись кальция
Популярная щелочь с очень широким спектром применения, которую в быту знают под названием «гашеная известь». Используется для дезинфекции, смягчения воды, в производстве удобрений, едкого натра, «хлорки», строительных материалов. Применяется для защиты деревьев и деревянных сооружений от вредителей и огня; в пищепроме как пищевая добавка и реактив при производстве сахара.
Гидроокись лития
Востребованное соединение в химпроме как сырье; в стекольной, керамической, 
Гидроокись бария
Применяется в химпроме как катализатор, а также в пищепроме для очистки жиров, сахара.
В аналитической химии применяются фиксаналы щелочей, которые можно купить у нас:
— стандарт-титр Натрий гидроокись (Натрий гидроксид) 0,1 H
— стандарт-титр Калий гидроокись (Калий гидроксид) 0,1 Н
Каустическая сода: свойства, применение в быту
Сейчас в продаже встречается пищевая, каустическая и кальцинированная сода. Каждый вариант имеет свою сферу применения. Пищевая сода используется в кулинарии, а кальцинированная – в качестве дезинфицирующего средства и в промышленном производстве.
Каустическая сода является наиболее опасной щелочью из тех, которые могут применяться в быту. При работе с этим веществом нужно соблюдать особую осторожность, т.к. оно может вызывать не только ожоги кожи при попадании на нее, но и поражение органов легочной системы при случайном вдыхании паров.
Что такое каустическая сода, какими свойствами обладает?
У этой соды есть еще немало названий, в т.ч. натр едкий очищенный, каустик, гидроксид натрия. Химическая формула данного вещества – NaOH. Это соединение отличается высокой химической активностью в отношении органических веществ.
Эта щелочь представляет собой кристаллическое вещество белого цвета без резкого запаха. Оно может быть полностью растворено в воде. Данная реакция сопровождается выделением большого количества тепла и ядовитых паров. Можно указать следующие главные свойства каустической соды:
В расплавленном состоянии эта сода способна выделять взрывоопасный газ, который может воспламеняться при реакции с аммиаком. Кроме того, данное вещество отличается высокой степенью летучести, поэтому должно храниться в плотно закрытой таре. Едкий натр относится ко 2 классу опасности.
Применение в быту
Сейчас данная щелочь часто используется в быту. Ее применение для чистки канализации позволяет быстро устранить даже сильные засоры, вызванные накоплением органических соединений на трубах. Также данное вещество нередко используется для устранения нагара и накипи с посуды. Использование каустической соды оправдано и при борьбе с некоторыми болезнями и паразитами растений. Применение щелочи в быту встречается при изготовлении домашнего мыла.
Устранение накипи и нагара с посуды
Многокомпонентный состав, в который входит каустик, может легко устранить с посуды нагар и накипь. Для этого в емкость нужно налить примерно 10 л воды. На это количество следует добавить примерно 200 г соды. Кроме того, необходимо измельчить на терке примерно 20 г хозяйственного мыла, не включающего ароматизаторы и добавки. Его нужно добавить в емкость и перемешать до полного растворения.
В последнюю очередь в посуду, которую необходимо очистить от накипи или нагара, добавляется 150 г канцелярского клея. Все составляющие следует тщательно перемешать и довести до кипения. После этого нужно уменьшить огонь и кипятить посуду еще 2 часа. Этого достаточно для удаления даже толстого слоя накипи или нагара.
После этого нужно состав вылить и промыть посуду проточной водой с использованием моющего средства. Обязательно следует хорошо ополоснуть емкость. Нужно учитывать, что данное средство не подходит для устранения нагара и накипи с алюминиевой посуды и при наличии тефлонового покрытия. Этот метод очистки может применяться только для эмалированной, чугунной и стальной посуды.
Изготовление домашнего мыла и моющих средств
Каустик является основой для изготовления домашнего мыла и моющих средств. Данный процесс несложен. Помимо очищенного едкого натра, потребуются растительное и эфирное масла и дистиллированная вода.
Сначала в емкость следует налить 300 мл дистиллированной воды, а затем растворить в ней 140 г каустика. После этого в смесь вводится 1 л теплого растительного масла. Его нужно вливать в раствор постепенно, размешивая деревянной лопаткой до получения однородной консистенции. После этого нужно добавить несколько капель эфирного масла.
Можно использовать сразу несколько эфирных масел для лучшей ароматизации состава. Дополнительно в состав мыла можно включать настои трав и различные порошкообразные вещества, которые будут выступать в качестве скраба. Готовый состав следует разлить по формочкам и положить в сухое прохладное место на 4-5 дней. После этого нужно вынуть мыло из емкостей и дать ему подсохнуть.
Кроме того, едкий натр можно использовать в качестве моющего средства. Это вещество разрешается применять для стирки некоторых видов тканей. Для этого следует в стиральную машину добавить 3 ст.л. очищенного каустика и положить грязное белье. Температура стирки должна быть не меньше 40°C. При ручной стирке нужно растворять в 10 л воды не более 3 ч.л. средства. При необходимости можно замачивать белье в растворе, но не более чем на 2 часа.
Очищенная сода также используется для мытья полов. Для этого следует в 5 л воды растворить 3 ст.л. каустика. Раствором нужно хорошо обработать пол. После этого обязательно следует дополнительно промыть поверхность чистой водой.
Устранение засоров
Наиболее часто сода каустическая чешуированная применяется для устранения засоров в канализационных трубах. При использовании данного вещества с такой целью следует строго следовать инструкции по применению, чтобы не повредить трубы и не усугубить ситуацию. Способ использования зависит от того, применяется средство для очистки канализации в частном или в многоквартирном доме.
Если засор случился в частном доме, нужно правильно развести каустическую соду для промывки канализации. Для этого следует 2 кг едкого натра смешать с 4 л холодной воды. Полученную смесь необходимо вылить в трубы.
После этого нужно оставить смесь в канализации на несколько часов. Из отверстия слива может появиться пена. Не исключено шипение. Это указывает на то, что протекает реакция расщепления жира и других органических загрязнений. В данный период следует отказаться от использования раковиной, ванной и туалетом. После того как засор устранится и жидкость уйдет, нужно промыть канализацию примерно 15 л горячей воды.
Каустической сода для прочистки труб в многоквартирном доме не требует ее предварительного растворения. В канализацию нужно засыпать примерно 150 г соды и залить 2 л кипятка. Следует подождать не менее 10-15 минут. После этого необходимо залить еще не менее 2 л горячей воды. На данное время нужно избегать использования туалета, ванны и раковины. Когда канализация прочистится, ее следует промыть 15-20 л теплой воды.
В ряде случаев, когда загрязнение отличается многослойностью, соду можно использовать в сочетании с уксусом. Для достижения положительного результата следует сначала налить в сливное отверстие 125 мл уксуса. После этого нужно добавить в него такое же количество соды. Желательно закрыть отверстие слива, т.к. в ходе реакции выделится много пены. Примерно через 2 часа следует промыть слив кипятком.
Эту соду можно использовать и для очищения выгребных ям. Сначала нужно приготовить раствор из расчета 2-4 кг каустика на 10 л воды. После выкачки содержимого ямы следует добавить в нее полученный объем раствора и перемешать содержимое. Примерно через час нужно слить в выгребную яму не менее 20 л кипятка. Обязательно требуется использовать средства личной защиты. Кроме того, необходимо учитывать, что температура раствора может повыситься до 60°C. После первичной очистки раствор следует откачать. При необходимости нужно залить свежий раствор и повторить процедуру.
Обработка растений от паразитов
В случае надобности можно использовать данное средство для устранения некоторых паразитов и болезней растений, в т.ч.:
Однако применять вещество нужно с особой осторожностью, т.к. повышенная концентрация каустика может стать причиной ожогов листьев.
Для обработки деревьев и кустарников требуется использовать раствор, приготовленный из расчета 5 ст.л. каустика на 10 л воды. Обрабатывать растения нужно не полностью, а только там, где находятся наибольшие очаги инфекции. Последнюю обработку следует проводить не менее чем за 30 дней до сбора урожая.
Раствор едкого натра нередко применяется для обработки теплиц по окончании сезона. Такая обработка элементов парников позволяет уничтожить споры грибков и болезнетворные бактерии. Это снизит риск заражения растений, которые будут высаживаться в теплице в будущем сезоне. При обработке конструкции применяется раствор такой же концентрации, что и при опрыскивании растений.
Применение в промышленности
Данное вещество активно применяется при производстве многих видов товаров широкого потребления. Едкий натр используется в пищевой промышленности. Он обозначается как добавка Е-524 и часто применяется при изготовлении мороженого, напитков и шоколада. Кроме того, растворы соды используются для очищения оборудования.
В текстильной промышленности это вещество применяется для отбеливания тканей и производства шелка. Кроме того, едкая сода используется при изготовлении картона и бумаги. Данное вещество является важнейшей составляющей при производстве моющих средств. Сода каустическая необходима для изготовления щелочных аккумуляторов для автомобилей и биодизельного топлива.
Это химическое вещество используется в оборонной промышленности для устранения углекислого газа и для производства аппаратов для дыхания.
Правила безопасности
При работе со щелочью нужно придерживать ряда правил предосторожности. Необходимо обеспечить приток воздуха в помещение для качественного проветривания.
Нужно использовать перчатки, очки и одежду, которые будут защищать кожу и глаза от попадания едкого вещества. Желательно использовать ватно-марлевую повязку или респиратор. Обязательно нужно проследить, чтобы каустик не контактировал с металлами, т.к. это может стать причиной нежелательных реакций.
При использовании соды необходимо соблюдать рекомендованные пропорции приготовления растворов. Это особенно важно в случае, если планируется использовать средство для чистки посуды и стирке.
Хранить едкий натр можно только в таре, которая не вступает в реакцию с данным веществом. Лучше всего использовать заводскую упаковку. При этом нужно учитывать, что сода отличается летучестью, поэтому тара, в которой она будет храниться, должна быть плотно закрытой. Хранить средство нужно в месте, недоступном для детей и животных.
Что делать при ожоге каустической содой?
Концентрированная сода может становиться причиной сильнейших химических ожогов. Повреждаться могут глубокие кожные слои. При сильном поражении возможно развитие некротического поражения тканей. При попадании данного вещества на кожу нужно быстрее промыть пораженный участок большим количеством воды. Промывать кожу следует не менее 20 минут. Не рекомендуется использовать влажные полотенца, т.к. это приведет к втиранию едкого вещества в более глубокие слои.
После этого необходимо обработать кожные покровы борной кислотой, раствором уксуса или лимонного сока. Это позволит уменьшить вред от воздействия концентрированного раствора. Затем нужно наложить на пораженную область повязку, пропитанную водой, и принять обезболивающее средство. При формировании волдырей необходимо обратиться за медицинской помощью.
Более опасным является попадание концентрированного раствора в глаза. Это может привести к потере зрения из-за критического поражения сетчатки. При попадании средства в глаза следует промыть их холодной проточной воды и как можно быстрее обратиться к врачу. При своевременно оказанной помощи есть возможность сохранить органы зрения.
Пары щелочи могут приводить к ожогам дыхательных путей. В этом случае человеку требует срочная медицинская помощь, т.к. высока вероятность летального исхода из-за асфиксии. Крайне опасно случайное проглатывание раствора щелочи. Это может стать причиной тяжелых ожогов слизистой оболочки ротовой полости, пищевода и желудка. В этом случае нужно срочном промыть ротовую полость водой и вызвать скорую помощь.
Где купить?
Приобрести данную соду можно в хозяйственных магазинах. Кроме того, она часто встречается в отделах, где продаются чистящие средства. Можно приобрести вещество и через интернет. Цена за 1 кг в большинстве случаев не превышает 100 руб.
Читайте также:
Мыльно-содовый раствор для очищения и обеззараживания поверхностей издавна и по сей день считается лучшим домашним…
Щелочь
Производство широкого спектра потребительских товаров зависит от использования щелочей 
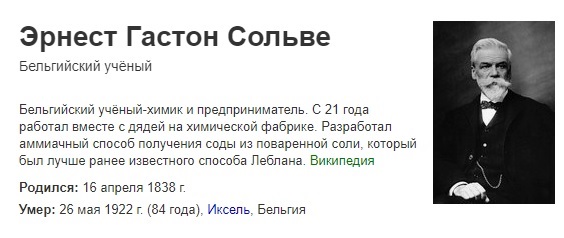
Немного исторических моментов из истории получения щелочи.
Лебланский способ производства доминировал в мировом производстве до конца 19-го века, но после первой мировой войны был полностью вытеснен другим методом конверсии соли, который был усовершенствован в 1860-х годах Эрнестом Солве из Бельгии. В конце XIX века появились электролитические методы производства каустической соды, объемы которых быстро росли.
По методу Солве, аммиачно-содовый процесс производства кальцинированной соды протекал следующим образом: поваренная соль в виде сильного рассола химически обрабатывалась для устранения примесей кальция и магния и затем насыщалась рециркулирующим газом аммиака в башнях. После, аммиачный рассол насыщался газом с использованием газообразного диоксида углерода при умеренном давлении в башне другого типа. Эти два процесса дают бикарбонат аммония и хлорид натрия, двойное разложение которого дает желаемый бикарбонат натрия, а также хлорид аммония. Затем бикарбонат натрия нагревают до разложения его до необходимого карбоната натрия. Аммиак, вовлеченный в процесс, почти полностью восстанавливается путем обработки хлоридом аммония с известью, с получением аммиака и хлорида кальция. Восстановленный аммиак затем повторно используют в описанных выше процессах.
В нескольких местах в мире существуют значительные запасы минеральной формы кальцинированной соды, известной как природная щелочь. На таких месторождениях производят большую часть природной щелочи в мире из обширных месторождений в подземных шахтах.
Природный натрий металлический.
Прочитайте статью Щелочи (источник «Энциклопедический словарь химика»)и получите больше представления о том что такое щелочь, или посмотрите видеоролик об этом химическом реактиве Щелочи.
Использование щелочи в окружающей нас среде
Щелочь снискала широкое применение в нашей жизни. Благодаря щелочи можно в той или иной форме добиться смягчения воды и удалить из нее примеси, такие как марганец, фториды и органические танины. В тяжелых отраслях промышленности используют щелочь в виде извести для поглощения и нейтрализации оксидов серы в выбросах в атмосферу, тем самым уменьшая вероятность выпадения кислотных осадков. Диоксид серы, производимый промышленными предприятиями и выпускаемый в атмосферу, возвращается на землю в виде кислотных дождей или серной кислоты. Такие территории, подвергшихся воздействию кислотных дождей, обрабатываются с помощью авиации препаратами, в состав которых входит щелочь. Это позволяет контролировать и нейтрализовывать критический уровень рН воды и почвы на участках, где произошли такие техногенные выбросы. Внесение щелочи в отходы и сточные воды, поддерживая правильный уровень рН в окислительных процессах при их разложении. Стабилизирует образования осадка в сточных водах и уменьшает запах или образования патогенных бактерий. Обработанный негашеной известью ил из сточных водоемов, соответствует экологическим нормам, что делает его пригодным в дальнейшем в использовании в качестве удобрения на сельскохозяйственных землях.
Промышленное применение щелочи
В промышленных и горных работах применение щелочей в сточных водах помогает нейтрализовать вредные соединения и произвести их очистку. Обработка избыточной щелочью, повышает рН воды до 10,5-11 и может дезинфицировать воду и удалять тяжелые металлы. Щелочи, такие как известь, являются ключевыми в химическом производстве карбида кальция, лимонной кислоты, нефтехимии и магнезии. В бумажной промышленности карбонат кальция является каустифицирующим агентом для отбеливания. Сталелитейная промышленность зависит от извести в качестве компонента для удаления примесей, таких как газообразный монооксид углерода, кремния, марганца и фосфора.
Моющие средства образованные щелочью
Щелочные моющие средства помогают при очистке поверхностей с сильными загрязнениями. Эти экономичные, водорастворимые щелочи с рН от 9 до 12,5 могут нейтрализовать кислоты в различных типах грязи и отложениях.
Щелочь в производстве стекла и керамики
Щелочь является основным сырьем в производстве стекла. Известняк, а также песок, кальцинированная сода, известь и другие химикаты, обжигаются при чрезвычайно высоких температурах и превращаются в расплавленную массу. Стеклодувы и гончары используют щелочи для глазурей и флюсов, которые реагируют с кислотами с образованием силикатов (стекла) при нагревании. Концентрированные щелочи создают более насыщенный цвет в глазури.
Литература о щелочи
«Среди многочисленных веществ, которыми химики с давних времен пользовались в своих лабораториях, почетное место всегда занимали едкие щелочи — едкое кали и едкий натр. Сотни различных химических реакций осуществляются в лабораториях, на заводах и в быту при участии щелочей. С помощью едких кали и натра можно, например, сделать растворимыми большинство нерастворимых веществ, а самые сильные кислоты и удушливые пары можно благодаря щелочам лишить всей их жгучести и ядовитости.
Едкие щелочи — очень своеобразные вещества. На вид это беловатые, довольно твердые камни, ничем как будто не примечательные. Но попробуйте взять едкое кали или натр и зажать его в руке. Вы почувствуете легкое жжение, почти как от прикосновения к крапиве. Долго держать в руке едкие щелочи было бы нестерпимо больно: они могут разъесть кожу и мясо до кости. Вот почему их называют «едкими», в отличие от других, менее «злых» щелочей — всем известных соды и поташа. Из соды и поташа, кстати сказать, почти всегда и по лучались едкие натр и кали.
У едких щелочей сильнейшее влечение к воде. Оставьте кусок совершенно сухого едкого кали или натра на воздухе. Через короткое время на его поверхности неизвестно откуда появится жидкость, потом он весь станет мокрым и рыхлым и под конец расползется бесформенной массой, как кисель. Это из воздуха щелочь притягивает к себе пары воды и образует с влагой густой раствор. Кому впервые приходится погрузить пальцы в раствор едкой щелочи, тот с удивлением заявляет: — Как мыло! И это совершенно правильно. Щелочь — скользкая, как мыло. Больше того: мыло потому и «мыльно» на ощупь, что его изготовляют с помощью щелочей. Раствор едкой щелочи и на вкус напоминает мыло.
Но химик узнаёт едкую щелочь не по вкусу, а по тому, как это вещество ведет себя с краской лакмус и с кислотами. Бумажка, про питанная синей краской лакмус, мгновенно краснеет, когда ее опус кают в кислоту; а если этой покрасневшей бумажкой дотронуться до щелочи, то она тотчас же опять становится синей. Едкая щелочь и кислота не могут мирно существовать рядом ни одной секунды. Они тотчас же вступают в бурную реакцию, шипя и разогреваясь, и уничтожают друг друга до тех пор, пока в растворе не останется ни крупинки щелочи или ни капли кислоты. Только тогда наступает успо коение. Щелочь и кислота «нейтрализовали» друг друга, говорят в таких случаях. От соединения их между собой получается «нейтральная» соль — ни кислая, ни едкая. Так, например, от соединения жгучей соляной кислоты с едким натром получается обыкновеннейшая поваренная соль.»
Отличительные признаки щелочи.
Из выше прочитанного мы уже знаем, что противоположностью щелочи является кислота. Вместо горького вкуса 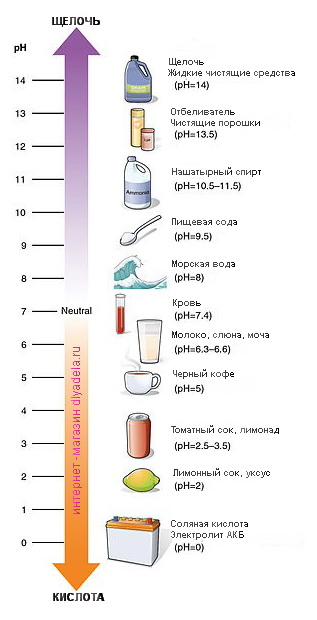
Почему вещество щелочное?
Таким образом, нам уже известно, что рН уровень представляет собой шкалу, значения которой колеблятся от 0-14 и указывают, является ли вещество щелочью или кислотой. Однако мы действительно не знаем, почему. Давайте рассмотрим этот вопрос более детально.
Уровень рH вещества зависит от того, как атомы расположены и объединены в веществе. Чистая вода находится прямо в середине шкалы и имеет pH 7. Это означает, что она содержит равное количество атомов водорода (H +) и гидроксидных атомов (OH-). Когда вещество имеет больше атомов водорода (Н +), это кислота. Когда вещество имеет больше гидроксидных атомов (OH-), оно является щелочным.
Где купить щелочь?
Купить щелочь в Новосибирске со степенью очистки ЧДА (чистая для анализов) в магазине «Для дела» можно на странице заказов: едкий натр NaOH или едкий кали KOH. Для иногородних покупателей товар может быть отправлен Почтой РФ или транспортными компаниями.