Что является субстратом для реакции энергетического обмена
Энергетический обмен
Обмен веществ
Энергетический обмен
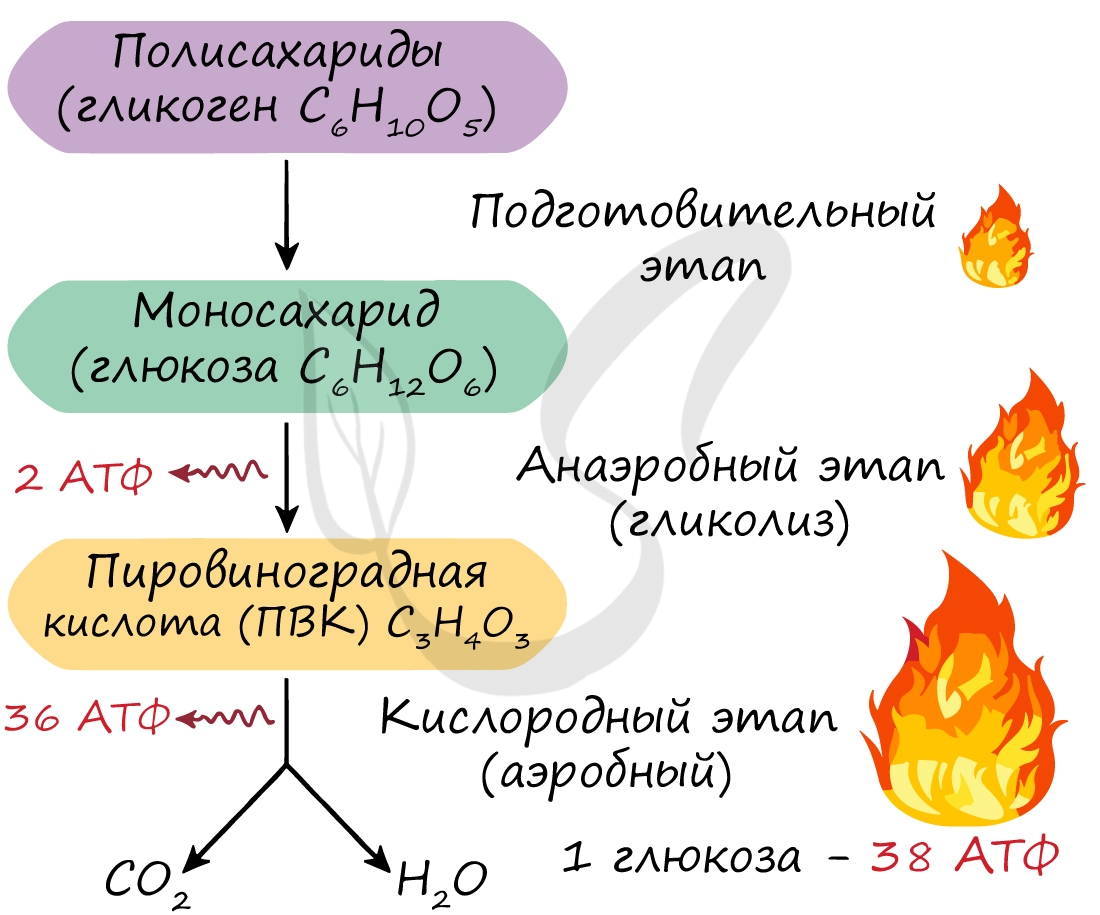
Возможно три этапа диссимиляции: подготовительный, анаэробный и аэробный. Среда обитания определяет количество этапов диссимиляции. Их может быть три, если организм обитает в кислородной среде, и два, если речь идет об организме, обитающем в бескислородной среде (к примеру, в кишечнике).
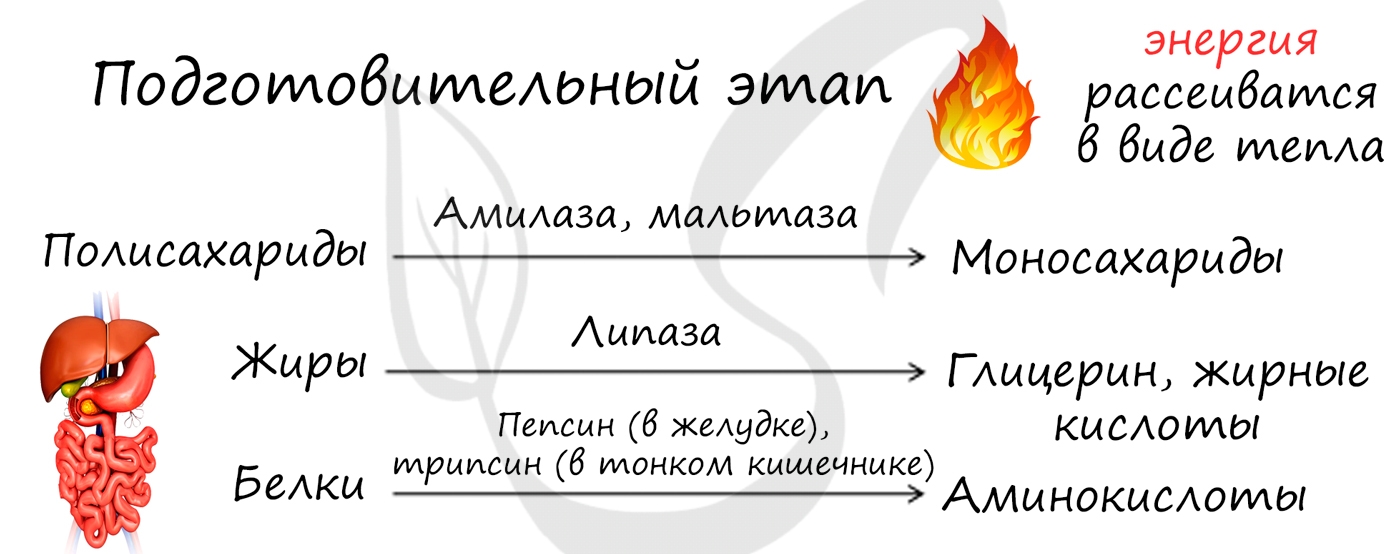
Подготовительный этап осуществляется ферментами в ЖКТ. В результате действия ферментов сложные вещества превращаются в более простые: полимеры распадаются на мономеры. Это сопровождается разрывом химических связей и выделением энергии, большая часть которой рассеивается в виде тепла.
Этот этап является последним для организмов-анаэробов, обитающих в условиях, где кислород отсутствует. На этапе гликолиза происходит расщепление молекулы глюкозы: образуется 2 молекулы АТФ и 2 молекулы пировиноградной кислоты (ПВК). Происходит данный этап в цитоплазме клеток.
Таким образом, суммарно с одной молекулы глюкозы можно получить 38 АТФ (гликолиз + кислородный этап).
Кислородный этап протекает на кристах митохондрий (складках, выпячиваниях внутренней мембраны), где наибольшая концентрация окислительных ферментов. Главную роль в этом процессе играет так называемый цикл Кребса, который подробно изучает биохимия.
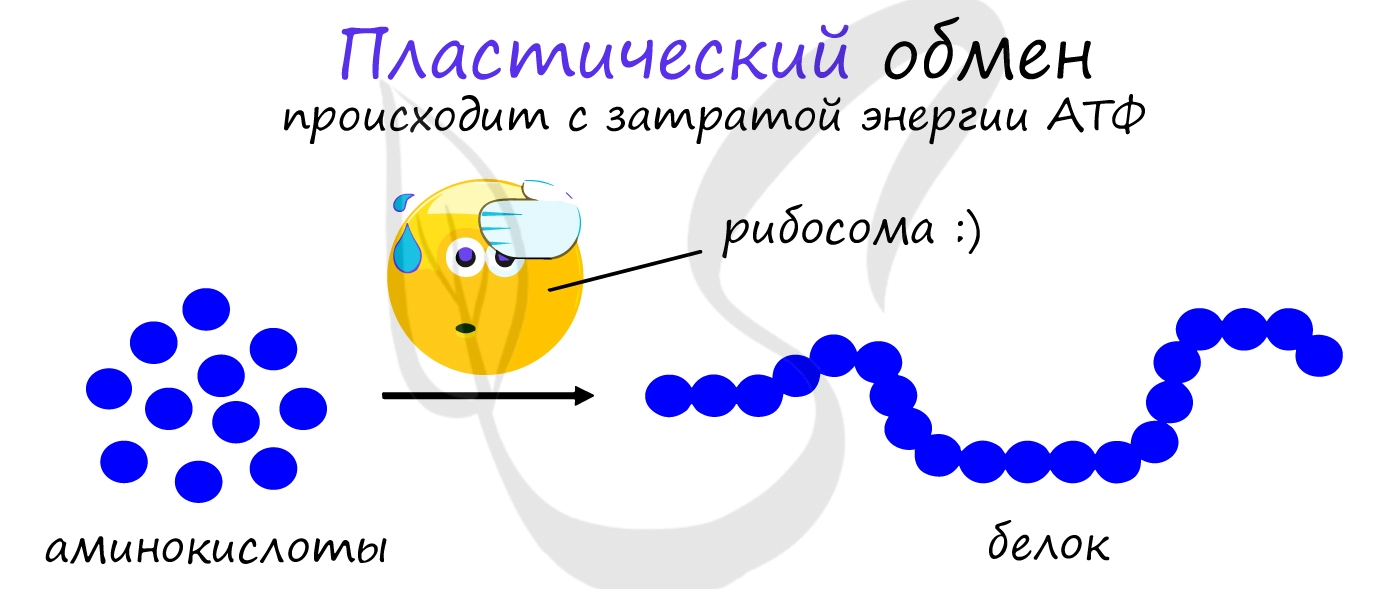
Пластический обмен
АТФ является универсальным источником энергии в клетке: энергия макроэргических связей АТФ используется для реакций пластического обмена (ассимиляции), протекающих с затратой энергии: синтеза белка на рибосоме (трансляции), удвоению ДНК (репликации) и т.д.
В результате пластического обмена в нашем организме происходит синтез белков, жиров и углеводов.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Энергетические субстраты
Содержание
Энергетические субстраты [ править | править код ]
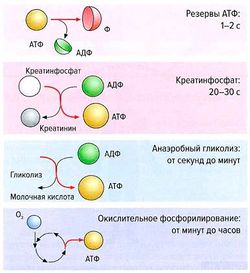
Работа мышц требует постоянного поступления АТФ для поддержания цикла формирования поперечных связей. При этом миозин выступает в роли АТФазы и расщепляет АТФ на АДФ и неорганический фосфат (Ф). Мышцы имеют очень ограниченные резервы АТФ (этого запаса может хватить только на 4-6 с сократительной активности), но могут регенерировать АТФ за очень короткое время за счет присоединения фосфатной группы к АДФ.
Процесс быстрой регенерации АТФ в мышцах происходит при переносе фосфатной группы с креатинфосфата на АДФ с образованием АТФ и креатинина (такой способ ресинтеза АТФ называют анаэробно-алактатным энергообеспечением). Поскольку наличный запас креатинфосфата в мышечной клетке невелик (его хватает на 6-10 с интенсивной работы), для более длительного функционирования мышц необходим синтез нового АТФ в ходе анаэробного гликолиза (анаэробно-гликолитическое энергообеспечение), при котором 1 моль глюкозы расходуется на синтез 2 молей АТФ, либо в ходе окислительного фосфорилирования в митохондриях (аэробное энергообеспечение), при котором за счет окисления 1 моля глюкозы синтезируется 34 моля АТФ. Наряду с глюкозой в качестве источника энергии мышцы могут использовать триглицериды в процессе бета-окисления жирных кислот.
Регенерация аденозинтрифосфата из креатинфосфата [ править | править код ]
Резервов креатинфосфата в мышцах достаточно для регенерации АТФ в течение не более 10 с. Продукт метаболизма креатина — креатинин — затем выводится в кровь и попадает в мочу. Суточная продукция креатинина зависит от мышечной массы, поэтому уровень креатинина в плазме у мужчин выше, чем у женщин. Плазменный уровень креатинина также сильно зависит от общей тренированности. В норме у нетренированных лиц он составляет 0,5-1,2 мг/дл для мужчин и 0,5-1 мг/дл для женщин. Из организма креатинин выводится почками, повышение его концентрации в плазме крови может говорить о нарушении функции почек, однако значительное повышение уровня креатинина наблюдают только при тяжелой почечной патологии.

Анаэробный синтез аденозинтрифосфата в процессе гликолиза [ править | править код ]
Мышечные волокна способны накапливать глюкозу в виде гликогена. Гликоген представляет собой сильно разветвленную молекулу, что обеспечивает быстрый доступ расщепляющих ферментов к фрагментам молекулы гликогена и быстрое высвобождение запасов глюкозы. Однако для длительной мышечной активности (> 20 мин) мышцы должны получать АТФ в ходе окисления липидов, т. к. запасы мышечного гликогена истощаются. Именно по этой причине считается, что для профилактики и борьбы с ожирением нужны длительные циклические нагрузки аэробного характера.
Аэробный синтез аденозинтрифосфата в процессе окислительного фосфорилирования [ править | править код ]
При наличии кислорода пируват подвергается окислительному фосфорилированию в цикле трикарбоновых кислот до С02 и Н20. При этой реакции возможно синтезировать больше АТФ, чем при гликолизе — из 1 моля глюкозы образуется 34 моля АТФ, — однако этот процесс более медленный: скорость образования АТФ в аэробном процессе почти в 2 раза ниже, чем в процессе анаэробного гликолиза.
Важность наличия различных систем синтеза АТФ определяется различным временем регенерации АТФ (рис.). Так, на коротких дистанциях (60, 100 м) особую роль играет креатинфосфат, процессы анаэробного гликолиза достигают максимума через 30 с — 1 мин после начала нагрузки и сохраняют активность к концу средних дистанций (200, 400 м), а на длинных дистанциях наибольшее поступление АТФ обеспечивает окислительное фосфорилирование, которое достигает максимума через 1-3 мин. На время регенерации АТФ также оказывают влияние общая тренированность и питание.
Синтез аденозинтрифосфата в процессе β-окисления жирных кислот [ править | править код ]
Другим источником получения энергии в мышцах является β-окисление жирных кислот. Свободные жирные кислоты поступают в мышцы из крови и накапливаются в них в виде триглицеридов. Триглицериды являются эфирами глицерина и трех жирных кислот различной длины.
По сравнению с очень малыми запасами гликогена в организме (около 500 г) запасы жира составляют 12 кг, однако выход АТФ из гликогена практически в 2 раза превышает эффективность окисления жирных кислот. Таким образом, последний вариант получения АТФ «выгоден», когда можно удовлетворить большие потребности в энергии и сохранить при этом «ценные» запасы гликогена. Сэкономленные запасы гликогена могут использоваться при дополнительном краткосрочном повышении нагрузки, например при промежуточном или конечном спурте при беге.
В ходе окисления жирных кислот для разрушения ненасыщенных двойных связей в цепи жирных кислот необходимо больше кислорода, однако это играет второстепенную роль в энергетическом балансе организма.
Энергетический обмен в мышцах [ править | править код ]
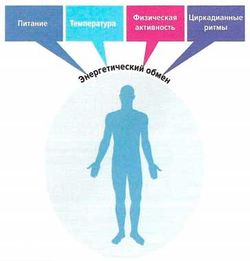
С точки зрения физики энергия имеет такую же размерность, как работа, а работа — это сила, умноженная на расстояние. Количество работы, выполняемой за единицу времени, называют мощностью. Энергетический обмен (преобразование энергии в организме) — это мощность термодинамических процессов, поскольку он выражает выполненную работу (или потраченную энергию) за единицу времени. Основными проявлениями энергетического обмена в организме являются мышечная работа и выделяющееся тепло. Организм человека подчиняется закону сохранения энергии, в соответствии с которым количество поглощенной энергии (в различных формах) и образовавшейся энергии (главным образом в виде тепла и механической работы) равны. Сбалансированный процесс поглощения и отдачи энергии организмом называют энергетическим обменом. Измерение энергетического обмена играет большую роль для оценки объема физической нагрузки (например, при изучении физиологии спорта и труда). На энергетический обмен влияет множество факторов (рис.).
Энергетический обмен при физической нагрузке [ править | править код ]
Энергетический обмен даже при минимальной физической нагрузке становится в 1,5-2 раза выше, чем в условиях покоя. Чем сильнее повышается энергетический обмен при выполнении физической нагрузки, тем короче то время, которое человек способен такую нагрузку выполнять. Максимальное увеличение скорости обменных процессов у человека может быть примерно 30-кратным (по сравнению с основным обменом), но время удержания такой нагрузки не превышает 6 с. Если скорость метаболических процессов увеличена в 10 раз по сравнению с основным обменом, то такую циклическую нагрузку нетренированный человек способен удерживать 3-4 мин, а спортсмен, тренированный на выносливость, — до 6 мин. Считается, что именно в таком режиме реализуются максимальные аэробные возможности человека.

Энергетические субстраты — что это и какое они оказывают влияние на человека
Человек — уникальное творение природы со сложными механизмами, которые недоступны для воспроизведения искусственным путем. Мы можем разобраться в действии этих сложных механизмов и необходимых условиях для их бесперебойного функционирования.
Поразительно, сколько факторов влияет на благополучие органов, в том числе на сердце. Сердце проделывает колоссальную работу и требует регулярной подпитки, которую обеспечивают энергетические субстраты (ЭС).
Что это
Ежедневно сердце — насос, перекачивающий огромные объемы крови, совершающий регулярную механическую работу. Но он также играет роль котла, куда подбрасываются дрова для сгорания, выделяющие колоссальные объемы энергии.
Дрова — это субстраты, сгорающие в присутствии кислорода. Выделяемая энергия участвует в создании Аденозин Три-Фосфатной молекулы, служащая генератором для питания всех механизмов.
Указанная выше молекула чрезвычайно важна для работоспособности человека. Представьте пример — сорокалетний мужчина, среднего роста, обладающий массой тела сорок килограмм. Его сердце в сутки образовывает около тридцати килограмм АТФ.
Для обеспечения продуктивного выделения аденозина, требуется исполнение всего трех условий:
Постоянная, бесперебойная транспортировка ЭС;
Непрерывная, устойчивая доставка кислорода.
Продуктивное, результативное функционирование митохондрии.
Работа комбинации описанных трех параметров гарантирует продуктивность всех процедур, действующих в организме.
Роль в синтезе АТФ
Первый пункт в описанном ранее списке, указывает на потребность энергосубстратов для обеспечения химической реакции. Сердце использует длинноцепочечные жирные кислоты, сокращенно ДЦ-ЖК, а также глюкоза и лактат (по-другому, анион молочной кислоты) в качестве субстратов.
Люди, находящиеся в состоянии покоя, при формировании три-фосфата, создают приблизительно шестьдесят, семьдесят процентов ДЦ-ЖК, и пятнадцать, двадцать глюкозы-лактата. Как было сказано, требуется О2 для синтеза, так как энерго-субстраты конкурируют между собой за окисление в митохондриях. Интересно, что вначале окисляется то “топливо», которое продуцируется в большей концентрации.
Из этого делаем вывод — энергосубстрат служит ключом в формировании аденозинового вещества, используемого для поддержания процессов жизнедеятельности. Поддержка мышечных тканей требует непрекращаемых затрат данной субстанции, но запас строго ограничен, хватает максимум на десять секунд высокоинтенсивной деятельности мышц.
Чтобы ткань мышечная функционировали длительный срок, обеспечивается синтезирование нового три-фосфата с помощью анаэробно-гликолического энергообеспечения, или просто аэробного энергообеспечения. Простым языком:
1-й метод гарантирует выделение 1 моль глюкозы, расходуемой на продуцирование 2-х молей 3-фосфата.
Суть 2-го в окислении C6H12O6, благодаря которому продуцируется 34моль 3-фосфата.
Дополнительно мышца может брать необходимый заряд из жирных кислот при бета-окислении. Второй метод гарантирует создание большего количества молекулы, составляющей энергозапас.
Стадии энергообмена
Обмен энергетический (сокращенно ЭО) — поэтапное разложение сложных соединений органического типа. Оно совершается при выбросе энергии, которую мгновенно запасают три-фосфаты. Позже данный резерв применится для гарантии жизнедеятельности, а также на биосинтез и т.д.
Существует ровно 3 стадии энергообмена:
Подготовительная — биополимеры расщепляются на мономеры.
Бескислородная или гликолиз — распад глюкозы на пировиноградное соединение.
Кислородная — разложение пировиноградного соединения на углекислый газ и обычную воду.
Давайте узнаем подробнее об этих этапах.
Подготовительный
Расщепливается поступающая вместе с пищевыми волокнами органика, на обычный мономер. Белки становятся аминокислотами, углеводы — сахарами, жир — жирной кислотой. В этот момент выбрасывается заряд, но не транспортируется в припасы, а рассеивается, как тепло.
Расщепляются полимеры в ЖКТ, при участии ферментов. Затем попадают в кровь, благодаря кишечнику. Далее транспортируется по всей системе к органам, клеткам и т.д.
Однако не все полимеры распадаются в пищевом тракте, иногда это случается в лизосомах, после попадание продуктов распада в кровеносную с-му.
Образованные компоненты применяются для энерго- и пластического обмена. В 1-ом случае результат — разложение, во 2ом синтезируются клетки.
Бескислородный
Происходит в цитоплазме клеток и задействует гликолиз — окисление и распад C6H12O6 до пировинограда, называемого пируватом. В состав C6H12O6 входит шесть углеродных атомов, в момент гликолиза возникает распадение состава на две компонента пирувата, в котором есть три углеродных атома. Одновременно частично отслаивается водород, позже он примет участие в последней стадии.
Гликолиз выделяет заряд, запасаемый 3-кислотой, но резерв совсем маленький, ведь глюкоза создает только два моля аденозина.
Кислородный
Состоит из 2-х небольших этапов:
Цикла Кребса — зарождается и выбрасывается углекислый газ. Он протекает в митохондрие, точнее в ее матриксе, с помощью ферментов. Этот подэтап также дает только 2моль АТФ.
Окислительного фосфолирования — происходит в кристе. Помимо ферментов, участвуют коферменты, создающие дыхательную цепь. Этот подэтап выбрасывает наивысший объем молекул АТФ — 32-34.
На что влияет нехватка энергосубстратов
Любая активность будет нарушена при дефиците ЭС, так как они участвуют при синтезировании 3-кислот. Люди ощущают слабость при усилении нагрузок, не могут качественно выполнять работу.
Чаще недостаток ощущают спортсмены при слишком высокой нагрузке. Интенсивные тренировки истощают человека, не дают возможности восполнить недостающее и он становится неспособным функционировать в том же темпе.
Для восполнения чаще используются специальные препараты, но подбирают время, когда спортсмен действительно вызвал собственными действиями адаптационные изменения и требуется дополнительная помощь
Энергосубстрат в эритроцитах
Углеводы не способны к синтезу внутри зрелых эритроцитов, они только эксплуатируются для других целей. Главным энерго-субстратом, эксплуатируемым эритроцитами, является глюкоза.
Она поступает в видоизмененной форме, облегченной и усваивается после диффузии, обеспеченной ГЛЮТ-2.
Дополнительно эритроцитами эксплуатируется фруктоза, инозины, ксилиты, маннозы и сорбиты.
Субстраты при парентеральном питании
Подобный вид питания задействуется, если пациент не в силах самостоятельно принимать пищу. Бывает двух видов — частичным и полным. Суть в том, что препараты с необходимыми питательными веществами вводят внутривенно. Компоненты не всасываются кишечником, как это бывает в привычной процедуре обмена, а поступают сразу в кровеносную с-му.
ПП состоит из двух основных групп — донаторы энергии и донаторы пластической материи. В состав 1-й группы входят ЭС, чаще это глицерол, принимающий участие при синтезировании липидов и гликогена.
Обмен веществ и энергии
Процесс распада сложных веществ на более простые называется катаболизмом. Так, поступающие в пищей белки, жиры, углеводы под действием ферментов пищеварительного тракта распадаются на более простые составные части (аминокислоты, жирные кислоты и моносахариды). При этом высвобождается энергия. Обратный процесс, т. е. синтез сложных соединений из более простых называется анаболизмом. Он идет с затратой энергии. Из образовавшихся в результате пищеварения аминокислот, жирных кислот и моносахаридов в клетках синтезируются новые клеточные белки, фосфолипиды мембран и полисахариды.
Существует понятие амфиболизм, когда одно соединение разрушается, но при этом синтезируется другое.
Интенсивность метаболизма определяется потребностью клетки в тех или иных веществах или энергии, регуляция осуществляется четырьмя путями:
1) Суммарная скорость реакций определенного метаболического пути определяется концентрацией каждого из ферментов этого пути, значением рН среды, внутриклеточной концентрацией каждого из промежуточных продуктов, концентрацией кофакторов и коферментов.
2) Активностью регуляторных (аллостерических) ферментов, которые обычно катализируют начальные этапы метаболических путей. Большинство из них ингибируется конечным продуктом данного пути и этот вид ингибирования называется «по принципу обратной связи».
4) Гормональная регуляция. Ряд гормонов способны активировать или ингибировать многие ферменты метаболических путей.
Живые организмы представляют собой термодинамически неустойчивые системы. Для их формирования и функционирования необходимо непрерывное поступление энергии в форме, пригодной для многопланового использования. Для получения энергии практически все живые существа на планете приспособились подвергать гидролизу одну из пирофосфатных связей АТФ. В связи с этим одна из главных задач биоэнергетики живых организмов это восполнение использованных АТФ из АДФ и АМФ.
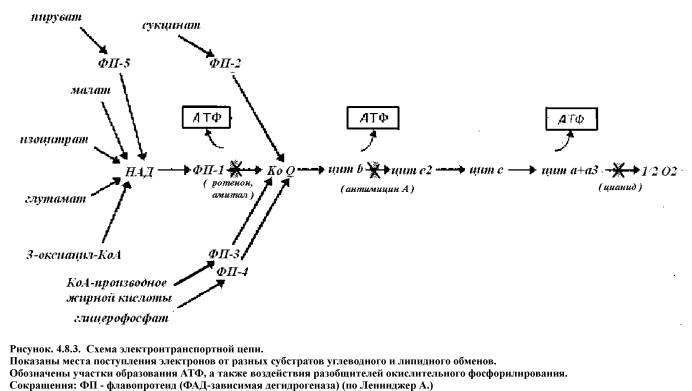
Это процесс потребление клетками тканей организма кислорода, который участвует в биологическом окислении. Такой вид окисления называют аэробным окислением. Если конечным акцептором в цепи переноса водорода выступает не кислород, а другие вещества (например пировиноградная кислота), то такой тип окисления называют анаэробным.
Т. о. любое соединение может отдавать электроны только соединению с более высоким окислительно-восстановительным потенциалом. В дыхательной цепи каждое последующее звено имеет более высокий потенциал, чем предыдущее.
Дыхательная цепь состоит из:
2. ФАД- зависимой дегидрогеназы;
ФАД и ФМН-зависимые дегидрогеназы содержат в качестве кофермента фосфорный эфир витамина В2 ( ФАД ).
В цитохроме с порфириновая плоскость ковалентно связана с белком через два остатка цистеина, а в цитохромах b и а , она ковалентно не связано с белком.
В цитохроме а+ а3 (цитохромоксидазе) вместо протопорфирина содержатся порфирин А, который отличатся рядом структурных особенностей. Пятое координационное положение железа занято аминогруппой, принадлежащей остатку аминосахара, входящего в состав самого белка.
В отличии от гема гемолгобина атом железа в цитохромах может обратимо переходить из двух в трехвалентное состояние это обеспечивает транспорт электронов (См. подробнее приложение 1 «Атомная и электронная структура гемопротеинов «).
Механизм работы электронтранспортной цепи
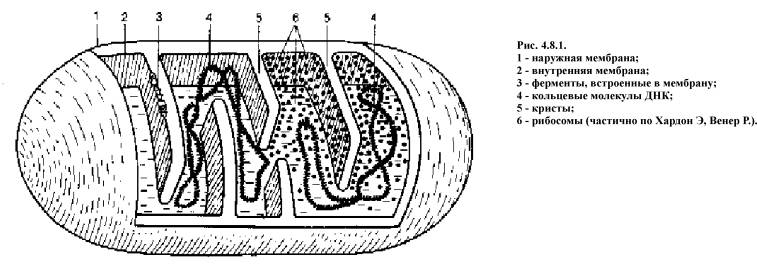
Наружная мембрана митохондрии (рис. 4.8.1) проницаема для большинства мелких молекул и ионов, внутренняя почти для всех ионов (кроме протонов Н) и для большинства незаряженных молекул.
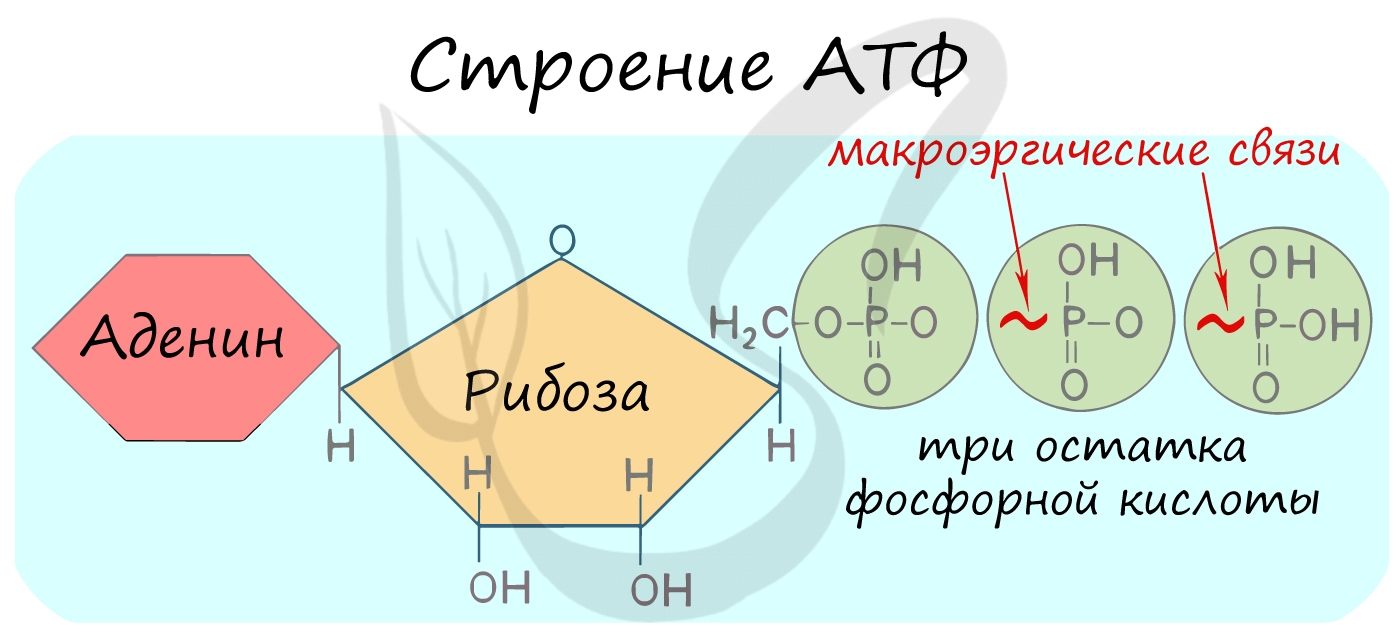
Такая молекула содержит в себе три макроэргических связи. Макроэргической или богатой энергией называют химическую связь, при разрыве которой высвобождается более 4 ккал/моль. При гидролитическом расщеплении АТФ до АДФ и фосфорной кислоты высвобождается 7,3 ккал/моль. Ровно столько же тратится для образования АТФ из АДФ и остатка фосфорной кислоты и это один из основных путей запасания энергии в организме.
В процессе транспорта электронов по дыхательной цепи высвобождается энергия, которая тратится на присоединение остатка фосфорной кислоты к АДФ с образованием одной молекулы АТФ и одной молекулы воды. В процессе переноса одной пары электронов по дыхательной цепи высвобождается и запасается в виде трех молекул АТФ 21,3 ккал/моль. Это составляет около 40 % высвободившейся при электронном транспорте энергии.
Такой способ запасания энергии в клетке называется окислительным фосфорилированием или сопряженным фосфорилированием.
Молекулярные механизмы этого процесса наиболее полно объясняет хемоосмотическая теория Митчелла, выдвинутая в 1961 году.
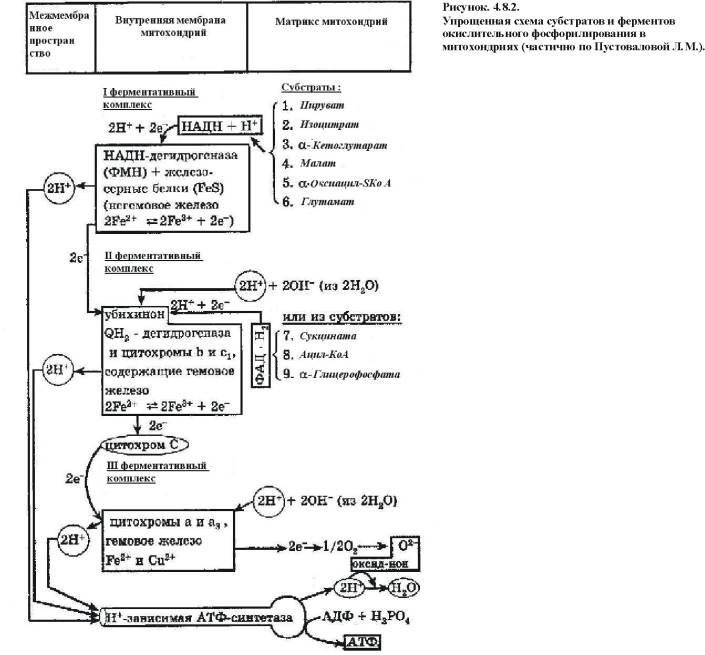
Механизм окислительного фосфорилирования (рис.4.8.2.):
1) НАД-зависимая дегидрогеназа расположена на матриксной поверхности внутренней мембраны митохондрий отдает пару электронов водорода на ФМН-зависимую дегидрогеназу. При этом из матрикса пара протонов переходит также на ФМН и в результате образуется ФМН Н2. В это время пара протонов, принадлежащих НАД выталкивается в межмембранное пространство.
2) ФАД-зависимая дегидрогеназа отдает пару электронов на Ко Q а пару протонов выталкивает в межмембранное пространство. Получив электроны Ко Q принимает из матрикса пару протонов и превращается в Ко Q Н2.
3) Ко Q Н2 выталкивает пару протонов в межмембранное пространство, а пара электронов передается на цитохромы и далее на кислород с образованием молекулы воды.
В итоге при переносе пары электронов по цепи из матрикса в межмембранное пространство перекачивается 6 протонов (3 пары), что ведет к созданию разницы потенциалов и разницы рН между поверхностями внутренней мембраны.
4) Разница потенциалов и разница рН обеспечивают движение протонов через протонный канал обратно в матрикс.
5) Такое обратное движение протонов ведет к активации АТФ-синтазы и синтезу АТФ из АДФ и фосфорной кислоты. При переносе одной пары электронов (т.е. трех пар протонов) синтезируется 3 молекулы АТФ (рис. 4.7.3.).
Образовавшаяся АТФ из матрикса в цитоплазму переносится ферментами транслоказами, при этом в обратном направлении в матрикс переносится одна молекула АДФ и одна молекула фосфорной кислоты. Понятно, что нарушение транспорта АДФ и фосфата тормозит синтез АТФ.
Скорость окислительного фосфорилирования зависит в первую очередь от содержания АТФ, чем быстрее она расходуется, тем больше накапливается АДФ, тем больше потребность в энергии и следовательно активнее идет процесс окислительного фосфорилирования. Регуляцию скорости окислительного фосфорилирования концентрацией в клетке АДФ называют дыхательным контролем.
1. Бышевский А. Ш., Терсенов О. А. Биохимия для врача // Екатеринбург: Уральский рабочий, 1994, 384 с.;
2. Кнорре Д. Г., Мызина С. Д. Биологическая химия. – М.: Высш. шк. 1998, 479 с.;
3. Ленинджер А. Биохимия. Молекулярные основы структуры и функций клетки // М.: Мир, 1974, 956 с.;
4. Пустовалова Л.М. Практикум по биохимии // Ростов-на Дону: Феникс, 1999, 540 с.;
5. Степанов В. М. Молекулярная биология. Структура и функции белков // М.: Высшая школа, 1996, 335 с.;
6. Скулачев В. П. Энергетика биологических мембран // М.: Наука, 1989, 565 с.;
7. Карякин А. В., Арчаков А. И. Межмембранный перенос электронов // Успехи современной биологии, 1981, Т. 91, вып. 1, с. 74-89;
© И н с т и т у т Ф и з и к и
им. Л.В.Киренского 1998-2007
[an error occurred while processing this directive]