Чувствительность in vitro что это
In vivo — in vitro — in silico
In vivo — in vitro — in silico
Кремний (Si), химический элемент IV группы периодической системы Менделеева; атомный номер 14, атомная масса 28,086. Кремний — полупроводник, нашедший широкое применение в электронике для изготовления элементов полупроводниковых схем (от простейших транзисторов до сверхбыстрых современных процессоров).
Автор
Редакторы
Статья является введением к теме «Сухая биология» — в ней раскрывается смысл понятия in silico, а так же обсуждается его взаимосвязь с такими устоявшимися терминами как in vivo и in vitro.
Открывая этот новый раздел, хочется сказать несколько вводных слов, так как у большинства читателей наверняка может возникнуть вопрос: «что такое „in silico“?».
За последние несколько десятилетий развитие компьютерной техники достигло небывалых размахов. И как следствие компьютеризация захватила многие отрасли науки и техники. Биология также не является исключением. Если раньше компьютер рассматривался лишь как средство обработки экспериментальных данных, характер которых мог быть чрезвычайно разнообразным, от статистических исследований численности популяций, до обработки данных рентгеноструктурного анализа, то со временем стала развиваться идея полностью компьютерного эксперимента. Теперь компьютер стал рассматриваться как среда проведения эксперимента, т.е. имея на входе определенные исходные параметры, мы можем получить некие результаты моделирования, описывающие поведение исследуемой нами системы. Для обозначения всего, что связано с компьютерными экспериментами, в 90-е годы XX века даже возник полушутливый латинизм — in silico (от in silicon, т.е. «в кремнии» — подробнее см. 1–2), который дополнил ряд уже имеющихся еще с конца позапрошлого столетия классических определения характера экспериментальной среды — in vivo («вживую» — т.е. непосредственно в биологической системе), in vitro («в стекле», то есть в среде искусственно созданной — в пробирке), см. рис. 1. Термины in vivo и in vitro хорошо прижились среди экспериментаторов, однако смысл их использования достаточно относителен. Так, под in vivo молекулярный биолог, изучающий аспекты синтеза белка, может подразумевать колонию искусственно выращенных клеток, а под in vitro — систему бесклеточного синтеза в пробирке. При этом, для физиолога, изучающего механизмы проведения нервного импульса, in vivo — это целый организм, а in vitro — культура нервной ткани. В свою очередь, подход in silico также многоуровневый и включает в себя задачи по моделированию поведения отдельных молекул, биохимических процессов и даже функционированию отдельных физиологических систем.
Рисунок 1. Многоуровневый подход в изучении биологических систем: in vivo — т.е. в живом объекте (а), in vitro — т.е. в искусственно смоделированной среде (б), in silico — т.е. в полностью смоделированной на компьютере биологической системе (в).
Учитывая тематику нашего сайта, в разделе «Сухая биология» мы будем помещать материалы, в основном посвященные современным методам молекулярного моделирования. Молекулярное моделирование — это один из аспектов понятия in silico, который представляет из себя набор вычислительных методов, позволяющих с разной степенью физичности на атомарном уровне изучать молекулярные системы разной сложности. Методы молекулярного моделирования можно разбить на определенные группы, которые объединяют различные подходы, позволяющие решать задачи разного характера. К первой такой группе можно отнести все методики анализа биологических текстов (аминокислотных и нуклеотидных последовательностей), а также работу с соответствующими базами данных — ныне эта область получила специальное определение — биоинформатика. Следующая группа методов объединяет методики изучения эволюции молекулярных систем с использование эмпирических силовых полей. Набор подходов, позволяющих определять пространственную структуру белковых молекул, учитывая имеющиеся структурные шаблоны белков с гомологичными аминокислотными последовательностями, получил название моделирование на основании гомологии. Наконец, специальные подходы, позволяющие изучать взаимодействия типа лиганд-рецептор или фермент-субстрат, относятся к области молекулярного докинга. Обо всем этом вы узнаете подробнее на страницах раздела «Сухая биология».
ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ К АНТИБИОТИКАМ:
МЕТОДЫ, РЕЗУЛЬТАТЫ, ОЦЕНКА
Решедько Галина Константиновна,
к.м.н., ассистент кафедры клинической фармакологии
Смоленской государственной медицинской академии
214019, г.Смоленск, ул.Крупской, 28, а/я № 5.
Тел.: +7(0812) 61 13 01, 61 13 27, Факс: (0812) 61 12 94,
E-Mail: galina@antibiotic.ru
Содержание
Резюме
В лекции рассмотрены основные методы определения чувствительности in vitro микроорганизмов к антимикробным препаратам (диско-диффузионный, Е-тестов, методы разведения). Отражены подходы к эмпирическому и этиотропному назначению антибиотиков в клинической практике. Обсуждены вопросы интерпретации результатов определения чувствительности с клинической и микробиологической точек зрения.
В настоящее время в клинической практике существуют два принципа назначения антибактериальных препаратов: эмпирическое и этиотропное. Эмпирическое назначение антибиотиков основано на знаниях о природной чувствительности бактерий, эпидемиологических данных о резистентности микроорганизмов в регионе или стационаре, а также результатах контролируемых клинических исследований. Несомненным преимуществом эмпирического назначения химиопрепаратов является возможность быстрого начала терапии. Кроме того, при таком подходе исключаются затраты на проведение дополнительных исследований.
|
Однако при неэффективности проводимой антибактериальной терапии, при нозокомиальных инфекциях, когда затруднительно предположить возбудителя и его чувствительность к антибиотикам стремятся проводить этиотропную терапию. Этиотропное назначение антибиотиков предполагает не только выделение возбудителя инфекции из клинического материала, но и определение его чувствительности к антибиотикам. Получение корректных данных возможно только при грамотном выполнении всех звеньев бактериологического исследования: от взятия клинического материала, транспортировки его в бактериологическую лабораторию, идентификации возбудителя до определения его чувствительности к антибиотикам и интерпретации полученных результатов.
|
Методы определения чувствительности к антибиотикам
Методы определения чувствительности бактерий к антибиотикам делятся на 2 группы: диффузионные и методы разведения.
Рисунок 1. Определение чувствительности микроорганизмов диско-диффузионным методом.
Определение чувствительности микроорганизма с помощью Е-теста проводится аналогично тестированию диско-диффузионным методом. Отличие состоит в том, что вместо диска с антибиотиком используют полоску Е-теста, содержащую градиент концентраций антибиотика от максимальной к минимальной (рис. 2). В месте пересечения эллипсовидной зоны подавления роста с полоской Е-теста получают значение минимальной подавляющей концентрации (МПК).
Рисунок 2. Определение чувствительности микроорганизмов с помощью Е-тестов.
Несомненным достоинством диффузионных методов является простота тестирования и доступность выполнения в любой бактериологической лаборатории. Однако с учетом высокой стоимости Е-тестов для рутинной работы обычно используют диско-диффузионный метод.
Рисунок 3. Определение значения МПК методом разведения в жидкой питательной среде.
Интерпретация результатов определения чувствительности
На основании получаемых количественных данных (диаметра зоны подавления роста антибиотика или значения МПК) микроорганизмы подразделяют на чувствительные, умеренно резистентные и резистентные (рис. 4). Для разграничения этих трех категорий чувствительности (или резистентности) между собой используют так называемые пограничные концентрации (breakpoint) антибиотика (или пограничные значения диаметра зоны подавления роста микроорганизма).
Рисунок 4. Интерпретация результатов определения чувствительности бактерий в соответствии со значениями МПК.
Существуют два подхода к интерпретации результатов определения чувствительности: микробиологический и клинический. Микробиологическая интерпретация основана на анализе распределения значений концентраций антибиотика, подавляющих жизнеспособность бактерий. Клиническая интерпретация основана на оценке эффективности антибактериальной терапии.
Чувствительные микроорганизмы (susceptible)
Клинически к чувствительным относят бактерии (с учетом параметров, полученных in vitro), если при лечении стандартными дозами антибиотика инфекций, вызываемых этими микроорганизмами, наблюдают хороший терапевтический эффект.
При отсутствии достоверной клинической информации подразделение на категории чувствительности базируется на совместном учете данных, полученных in vitro, и фармакокинетики, т.е. на концентрациях антибиотика, достижимых в месте инфекции (или в сыворотке крови).
Резистентные микроорганизмы (resistant)
К резистентным (устойчивым) относят бактерии, когда при лечении инфекции, вызванной этими микроорганизмами, нет эффекта от терапии даже при использовании максимальных доз антибиотика. Такие микроорганизмы имеют механизмы резистентности.
Микроорганизмы c промежуточной резистентностью (intermediate)
Клинически промежуточную резистентность у бактерий подразумевают в случае, если инфекция, вызванные такими штаммами, может иметь различный терапевтический исход. Однако лечение может быть успешным, если антибиотик используется в дозировке, превышающей стандартную, или инфекция локализуется в месте, где антибактериальный препарат накапливается в высоких концентрациях.
С микробиологической точки зрения к бактериям с промежуточной резистентностью относят субпопуляцию, находящуюся в соответствии со значениями МПК или диаметра зон, между чувствительными и резистентными микроорганизмами. Иногда штаммы с промежуточной резистентностью и резистентные бактерии объединяют в одну категорию резистентных микроорганизмов.
Необходимо отметить, что клиническая интерпретация чувствительности бактерий к антибиотикам является условной, поскольку исход терапии не всегда зависит только от активности антибактериального препарата против возбудителя. Клиницистам известны случаи, когда при резистентности микроорганизмов, по данным исследования in vitro, получали хороший клинический эффект. И наоборот, при чувствительности возбудителя может наблюдаться неэффективность терапии.
В определенных клинических ситуациях, когда недостаточно результатов исследования чувствительности обычными методами, определяют минимальную бактерицидную концентрацию.
Значение МБК используют при терапии антибиотиками, обладающими бактериостатическим действием, или при отсутствии эффекта от антибактериальной терапии у особой категории больных. Частными случаями для определения МБК могут быть, например, бактериальный эндокардит, остеомиелит или генерализованные инфекции у пациентов с иммунодефицитными состояниями.
В заключение хотелось бы отметить, что на сегодняшний день не существует методов, которые позволили бы с абсолютной достоверностью прогнозировать клинический эффект антибиотиков при лечении инфекционных болезней. Однако, данные результатов определения чувствительности могут служить хорошим ориентиром клиницистам для выбора и коррекции антибактериальной терапии.
Таблица 1. Критерии интерпретации чувствительности бактерий
Активность антибактериальных средств in vitro
Грамотрицательные неферментирующие микроорганизмы широко распространены в окружающей среде. Одной из серьезных проблем является диагностика вызванных ими инфекций, связанная с объективными трудностями их выделения и идентификации. Второй проблемой является то, что для них характерна полирезистентность к антимикробным препаратам, включая те, которые обычно активны против Pseudomonas aeruginosa.
В данном исследовании определялась антибактериальная активность in vitro различных препаратов по отношению к 177 выделенным в клинике штаммам неферментирующих бактерий (кроме Pseudomonas aeruginosa и Acinetobacter spp.). МПК определялась методом разведений в агаре. Использовали среду Мюллера-Хинтона. Оценивали активность ампициллина, пиперациллина, пиперациллин/тазобактама, сульбактама, цефоперазона, цефоперазон/сульбактама, цефтазидима, цефепима, азтреонама, имипенема, меропенема, колистина, гентамицина, амикацина, триметоприм/сульфаметоксазола, хлорамфеникола, эритромицина, рифампицина, норфлоксацина, ципрофлоксацина и миноциклина.
У 7 изолятов: Sphingobacterium multivorum(2), Sphingobacterium spiritivorum(1), Empedobacter brevis(1), Weeksella virosa(1), Bergeyella zoohelcum(1) и Oligella urethralis (1), вместо чувствительности к цефоперазону или сульбактаму определяли чувствительность к амоксициллин/клавуланату и ампициллин/сульбактаму.
Полирезистентность к антибактериальным препаратам была характерна для таких возбудителей, как Stenotrophomonas maltophilia, Burkholderia cepacia, Chryseobacterium spp., Myroides spp., Achromobacter xylosoxidans и Ochrobactrum anthropi.
В то же время, такие микроорганизмы, как Pseudomonas stutzeri, Shewanella putrefaciens-algae, Sphingomonas paucimobilis, Pseudomonas oryzihabitans, Bergeyella zoohelcum, Weeksella virosa и Oligella urethralis часто были чувствительны к большинству из тестируемых антибиотиков.
Учитывая, что различные виды возбудителей, образующих группу грамотрицательных неферментирующих микроорганизмов, демонстрируют различные показатели антибиотикорезистентности, для выбора оптимальной схемы лечения требуется проведение микробиологического исследования с идентификацией возбудителя и выявления показателей его антибиотикорезистентности. Феномен полирезистентности, характерный для ряда возбудителей, требует активной разработки новых антибактериальных средств или поиска новых комбинаций антибиотиков, обладающих синергизмом бактерицидного действия по отношению к данным микроорганизмам.
«In vitro» activity of different antimicrobial agents on Gram-negative nonfermentative bacilli, excluding Pseudomonas aeruginosa and Acinetobacter spp. (Vay C.A., Almuzara M.N., Rodriguez C.H., Pugliese M.L., Lorenzo Barba F., Mattera J.C., Famiglietti A.M. Rev. Argent Microbiol., 2005;37(1):34-45).
Код вставки на сайт
Активность антибактериальных средств in vitro
Грамотрицательные неферментирующие микроорганизмы широко распространены в окружающей среде. Одной из серьезных проблем является диагностика вызванных ими инфекций, связанная с объективными трудностями их выделения и идентификации. Второй проблемой является то, что для них характерна полирезистентность к антимикробным препаратам, включая те, которые обычно активны против Pseudomonas aeruginosa.
В данном исследовании определялась антибактериальная активность in vitro различных препаратов по отношению к 177 выделенным в клинике штаммам неферментирующих бактерий (кроме Pseudomonas aeruginosa и Acinetobacter spp.). МПК определялась методом разведений в агаре. Использовали среду Мюллера-Хинтона. Оценивали активность ампициллина, пиперациллина, пиперациллин/тазобактама, сульбактама, цефоперазона, цефоперазон/сульбактама, цефтазидима, цефепима, азтреонама, имипенема, меропенема, колистина, гентамицина, амикацина, триметоприм/сульфаметоксазола, хлорамфеникола, эритромицина, рифампицина, норфлоксацина, ципрофлоксацина и миноциклина.
У 7 изолятов: Sphingobacterium multivorum(2), Sphingobacterium spiritivorum(1), Empedobacter brevis(1), Weeksella virosa(1), Bergeyella zoohelcum(1) и Oligella urethralis (1), вместо чувствительности к цефоперазону или сульбактаму определяли чувствительность к амоксициллин/клавуланату и ампициллин/сульбактаму.
Полирезистентность к антибактериальным препаратам была характерна для таких возбудителей, как Stenotrophomonas maltophilia, Burkholderia cepacia, Chryseobacterium spp., Myroides spp., Achromobacter xylosoxidans и Ochrobactrum anthropi.
В то же время, такие микроорганизмы, как Pseudomonas stutzeri, Shewanella putrefaciens-algae, Sphingomonas paucimobilis, Pseudomonas oryzihabitans, Bergeyella zoohelcum, Weeksella virosa и Oligella urethralis часто были чувствительны к большинству из тестируемых антибиотиков.
Учитывая, что различные виды возбудителей, образующих группу грамотрицательных неферментирующих микроорганизмов, демонстрируют различные показатели антибиотикорезистентности, для выбора оптимальной схемы лечения требуется проведение микробиологического исследования с идентификацией возбудителя и выявления показателей его антибиотикорезистентности. Феномен полирезистентности, характерный для ряда возбудителей, требует активной разработки новых антибактериальных средств или поиска новых комбинаций антибиотиков, обладающих синергизмом бактерицидного действия по отношению к данным микроорганизмам.
Лекарство в пробирке: доклинические исследования in vitro
Лекарство в пробирке: доклинические исследования in vitro
Чем дальше, тем больше доклинические исследования базируются на экспериментах не только на животных, но и на более простых и неодушевленных системах: например, на клетках. Но вытеснит ли когда-нибудь in vitro подход in vivo? Рисунок в полном размере.
Автор
Редакторы
Рецензент
Доклинические исследования (доКИ) лекарств нужны в первую очередь для подтверждения безопасности новых препаратов, чтобы в последующих клинических исследованиях не пострадали люди. Для этого ученые используют как животные модели, так и культуры клеток. И пусть пока доКИ не обходятся без экспериментов in vivo, работа с клеточными культурами уже сейчас является их неотъемлемой частью. В этой статье спецпроекта о будущем доклинических исследований мы совершим «путешествие к центру организма» — речь здесь пойдет именно о клетках.
Будущее доклинических исследований
Ни для кого не секрет, что биологические исследования и разработка лекарств — сложный и ответственный процесс. При этом в ходе отбора лучших молекул-кандидатов ученые должны заботиться не только о действенности, но и о безопасности новых препаратов. Так до того, как созданное лекарство получит человек, его изучают в других моделях: от компьютерных программ и клеточных культур до разных видов животных.
Спецпроект о доклинических исследованиях (доКИ) стал своеобразным приквелом к циклу статей о клинических испытаниях (КИ): что нужно сделать и изучить перед тем, как проводить клинические исследования с участием людей? Можно ли обойтись без экспериментов на животных? Почему правильные доКИ не менее значимы для разработки лекарства, чем КИ? Мы постараемся в доступной форме осветить сложные вопросы планирования и регулирования доклинических исследований; принципы этичности работы с лабораторными животными; узнаем, когда и чем можно их заменить; и заглянем в ближайшее будущее биомедицинской отрасли.
Независимый рецензент статьи — Георгий Шаронов, с.н.с. Института биоорганической химии. Основной областью научных интересов Шаронова Г.В. является механизм действия рецепторов и передачи сигнала через плазматическую мембрану. В этих исследованиях особое внимание уделяется роли липидов и цитоскелета.
Партнер спецпроекта — российские аффилированные лица компании «Филип Моррис Интернэшнл», ФМИ (PMI Affiliates in Russia), которая активно ведет исследования в области биомедицины, системной биологии и биотехнологий.
Каждый из нас еще из школьного курса биологии помнит мантру: клетка — элементарная единица живого. Но в контексте этой статьи для нас важно, что клетки также можно использовать в самых разных научных исследованиях. Все эксперименты с клетками проводят в специальной лабораторной посуде — пробирках или планшетах, — а потому и сами такие исследования носят название in vitro, что дословно переводится «в стекле».
Ученые прошли долгий и тернистый путь, чтобы научиться работать с клетками. С появления первых микроскопов и методов визуализации клеток прошло уже не одно столетие, и за это время был достигнут невероятный прогресс. История культивирования состоит из множества достижений и порой чрезвычайно неслучайных случайностей: чего только стóит открытие Флемингом пенициллина [1] или получение стволовых клеток из соматических (рис. 1).
Эта захватывающая история была пересказана в статье «Бессмертные клетки Генриетты Лакс» [2].
«По классике», в основе доКИ лежат эксперименты с живыми организмами: этот подход носит название in vivo. В этой статье мы собираемся рассказать про более ранний этап, когда работа идет на клетках (in vitro). Но кроме того в доКИ возможно применение и компьютерных подходов и даже искусственного интеллекта (in silico) — об этом мы поговорим в одной из будущих статей спецпроекта. В таком случае исследования проводят на виртуальных органах, системах организма, тканях или просто молекулах при помощи специальных компьютерных программ. Подробнее о «биологии без капли реактива» читайте в статьях «In vivo — in vitro — in silico» [8] и «12 методов в картинках: сухая биология» [9].
А также рекомендуем ознакомиться с классификацией доКИ (например, с делением на регуляторные и поисковые исследования) в первой статье этого спецпроекта: «От живого к неживому. Доклинические исследования сегодня и завтра» [10].
Как клеточные культуры помогают создать новое лекарство
О том, что такое доКИ и из каких этапов они состоят, мы уже рассказали в первой статье нашего спецпроекта «От живого к неживому. Доклинические исследования сегодня и завтра» [10], с которой мы и рекомендуем ознакомиться читателю. А о том, что происходит дальше, вы можете прочесть в спецпроекте по клиническим исследованиям (например, в статье «С миру по нитке: как соединились компоненты клинического исследования» [11]).
Для тех, кто еще не сориентировался, уточняем: стадии (до)клинических исследований предшествует собственно поиск или разработка лекарственного вещества, о чем мы подробно уже рассказывали и к чему рекомендуем обратиться читателям: «Драг-дизайн. Как в современном мире создаются новые лекарства» [12], «Поиск лекарственных мишеней» [13], «Виртуальные тропы реальных лекарств» [14] и «Три поколения лекарств» [15].
ДоКИ проводят как in vitro (на клетках), так и in vivo (на животных) с целью определить токсикологические и фармакологические свойства будущего лекарства. Поисковые доКИ часто проводят целиком на компьютере (in silico) — например, чтобы идентифицировать молекулы, способные повлиять на работу того или иного молекулярного пути; мы еще поговорим об этом подробнее в четвертой статье спецпроекта.
На первый взгляд всё достаточно просто, но обольщаться не стоит — большинство молекул-кандидатов, найденных на этапе скрининга, отправляются в помойное ведро: в среднем, только одно из 5000 соединений, вошедших в доКИ, становится одобренным препаратом.
Какое место культуры клеток занимают в доКИ? Пока не главенствующее. Несмотря на то, что количество исследований, проведенных в пробирке, стремительно увеличивается, согласно современному законодательству, доКИ не могут полностью проводиться in vitro. Их основу в настоящее время составляют модели in vivo как наиболее релевантные и надежные, хотя подход in vitro крайне привлекателен с точки зрения этики и экономической выгоды. Очевидно, что выращивать клетки куда менее затратно и более гуманно, чем мышей, кроликов и тем более — собак или приматов (о гуманности и этичности испытаний на животных см. врезку). А ведь для исследований «в стекле» можно брать и человеческие клетки, и даже целые ткани.
3R: этичные животные модели
Несомненно, работа с клетками куда гуманнее, чем эксперименты на животных. Но поскольку без моделей in vivo пока не обойтись, их стараются сделать менее травмирующими и более гуманными. В частности, создан свод правил, нацеленных на снижение числа используемых животных, улучшение условий их содержания, а также замену культурами клеток, низкоорганизованными животными, растениями и микроорганизмами. Эти правила обозначают аббревиатурой 3R: reduction, refinement и replacement — сокращение, усовершенствование и замена (рис. 2). Мы писали об этом подробно в первой статьей спецпроекта [10], но повторим тут ключевые принципы:
Рисунок 2. Концепцию 3R предложили Билл Рассел и Рекс Берч в 1959 году. Сегодня она стала мировым стандартом и регулируется биоэтическими комиссиями научно-исследовательских организаций, а также благотворительными организациями, например, в Великобритании — Фондом для замены животных в медицинских экспериментах, который регламентирует этические вопросы использования животных в рамках концепции 3R.
Помимо подтверждения свойств конкретных молекул (что осуществляется, как правило, в рамках регуляторных доКИ), клеточные модели активно применяют и в поисковых (фундаментальных) работах. Например, созданы клеточные линии для изучения Т-клеточного ответа [16], которые можно использовать в широчайшем спектре биомедицинских разработок: от новых вакцин до легендарной CAR-T-терапии [17].
Какие клетки используют в доКИ: клеточные линии
В доклинических исследованиях используют не отдельные клетки, а их культуры, выделенные из живых организмов (например, из человека, растения или животного) и помещенные в искусственную среду, где они могут расти какое-то время.
Добыча клеток
Для того чтобы начать работу in vitro, сперва нужно получить сами клетки. Естественно, в организме, будь то человек или животное, они не находятся в «свободном плавании» — их окружает и связывает, формируя в определенную структуру, так называемый внеклеточный матрикс [18]. Его можно разорвать либо механически, либо ферментативно, но чаще всего делают и то, и то. Сперва ткань измельчают, а затем добавляют ферменты: трипсин, коллагеназу или протеазы, в последнее время — и ДНКазы с целью разрушения выпадающей из разрушенных клеток ДНК (табл. 1).
| Фермент | Назначение |
|---|---|
| Коллагеназа | Может гидролизовать коллаген и широко используется для выделения клеток из тканей животных |
| Гиалуронидаза | Часто используется в сочетании с коллагеназой и катализирует гидролиз 1,4-β-D-гликозидных связей |
| ДНКаза | Добавляется в клеточные суспензии, чтобы свести к минимуму слипание клеток из-за ДНК, высвобождаемой поврежденными клетками |
| Эластаза | Используется для расщепления тканей, содержащих большое количество эластина |
| Трипсин | Протеаза, расщепляющая связи между аминокислотами аргинином и лизином. Часто сочетается с другими ферментами (например, эластазой и/или коллагеназой) для диссоциации тканей |
Стоит также упомянуть метод культуры эксплантатов, подходящий для получения первичных опухолевых линий, в котором клетки сами мигрируют (прямо скажем, уползают) из фрагмента ткани и прикрепляются к новому субстрату. Чтобы так получилось, небольшие кусочки опухоли (размером 2–5 мм) выращивают в культуральной среде, куда и переползают клетки. Главное преимущество эксплантатов — сохранение нативной архитектуры и организации микросреды [19], то есть более точное соответствие условиям in vivo. В настоящее время культуру сóлидных опухолей, основанную на эксплантатах, применяют для доклинической оценки новых терапевтических средств. Но есть у этого подхода и минусы — возможное изменение фенотипа клеток из-за неправильной ориентации эксплантата в культуре.
Свежевыделенные клетки, которые прошли один цикл роста и готовы к переносу в новый субстрат, называют первичной культурой. Как только клетки формируют полный монослой и пересеваются из нее, первичная культура становится клеточной линией, где со временем начинают главенствовать наиболее сильные клетки-представители. Этим обусловлена повышенная однородность клеток внутри линий. Если же клетки генетически идентичны (например, получены путем клонирования), речь будет идти уже не просто о линии, а о клеточном штамме.
По-другому, пассируются, то есть попадают в новую среду, дающую им возможность расти дальше.
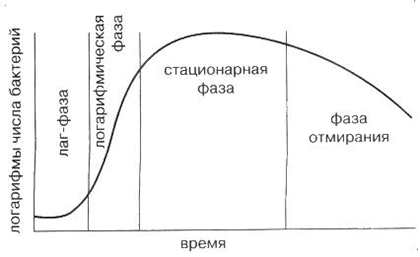
Цикл жизни клетки в культуре
Рисунок 3. Кривая роста клеток. Первое время после посева (лаг-фаза) клетки только адаптируются к условиям среды и растут медленно. После этого наступает фаза активного деления (логарифмический рост), которая сопровождается быстрым потреблением питательных веществ. Наконец, когда все компоненты среды использованы, либо клетки сформировали плотный монослой, наступает стационарная фаза. В этот период рост клеток снижается, и для дальнейшего роста и пролиферации их необходимо пассировать, то есть пересеять в свежую питательную среду.
Когда клетки формируют полный монослой, то есть занимают всё место в планшете или чашке Петри, приходит время пересевать их в другую емкость. Необходимость пересева или пассирования объясняется просто: клеткам нужна питательная среда для жизни, и когда их становится слишком много, питания может начать не хватать на всех. Увеличение во времени популяции клеток и их борьбу за питательные вещества хорошо иллюстрирует кривая клеточного роста (рис. 3).
Все клеточные линии принято также делить на конечные и непрерывные (они же — бессмертные). Первые способны делиться в искусственной среде ограниченное количество раз, в ходе развития стареют и затем — гибнут. С непрерывными всё куда интереснее. В процессе роста сами по себе или под воздействием внешних факторов они трансформируются, после чего могут делиться бесконечно долго. К непрерывным линиям относятся также и раковые клетки, и стволовые. Какие же клетки лучше и у кого их берут? Давайте разбираться.
Первичные vs перевиваемые — какие клетки лучше?
Первичные культуры клеток получают непосредственно из живого организма. Например, забор материала могут проводить во время оперативных вмешательств. Выделение самих клеток из образцов ткани осуществляется в стерильных ламинарах, которые обеспечивают определенный уровень биобезопасности (BSL 2) и соблюдение асептических условий работы с культурой. Как только их пассируют (пересевают), они перестают быть первичными, превращаясь в клеточную линию. Так, источником бессмертных и диплоидных (конечных) клеточных линий являются именно первичные культуры клеток.
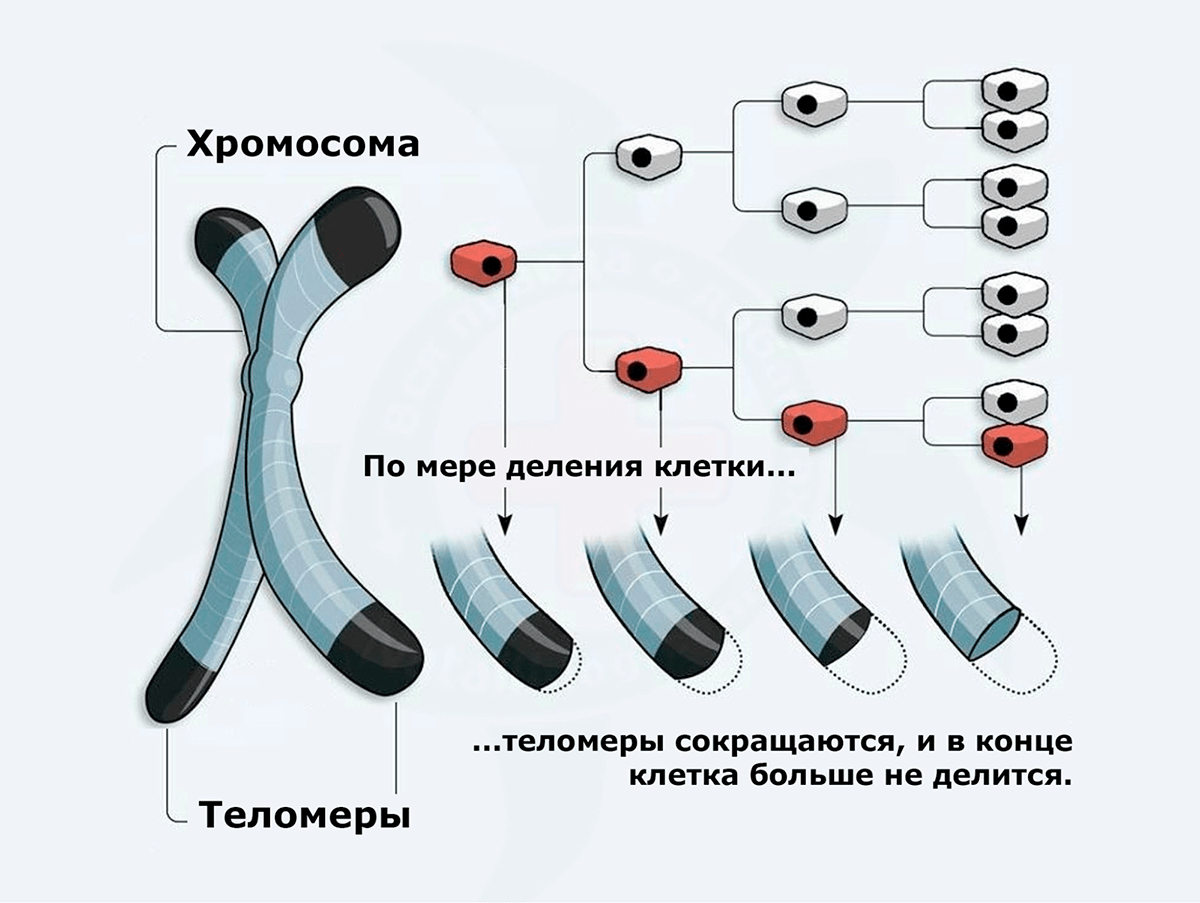
Этот процесс также носит название репликативного старения. Клетки, полученные из первичных культур, способны делиться ограниченное число раз из-за постепенного сокращения теломер (специальных участков ДНК на концах хромосом, защищающих клетки от мутаций) (рис. 4). В конце концов, теломеры и вовсе исчезают, а клетка активирует программу апоптоза — самоубийства в миниатюре [20]. Количество делений до «момента Х» носит название предела Хейфлика: обычно это 50–52 деления.
Рисунок 4. Теломеры: что наши клетки теряют с каждым поколением?
Зачем же нужны такие клетки, которые со 100%-ной вероятностью погибнут? Срок годности у них действительно небольшой, однако мы уже говорили, что в течение своей недолгой жизни такие клетки лучше всего сохраняют характеристики, которыми они обладали непосредственно в организме, то есть in vivo. Это значит, что с помощью первичных культур, взятых у человека, можно получать более релевантные данные, чем при работе на клетках животных. Это и есть самый важный и неоспоримый плюс первичных культур.
Что делать, если клеток много и все они разные? Сортировка
При подготовке первичных культур не всегда получается выделить только один тип клеток, поэтому нужно понимать, как их отсортировать. Среди основных методов сортировки выделяют центрифугирование, проточную цитометрию и магнитную сепарацию.
Бессмертные (или непрерывные) клеточные линии способны к делению вне организма неопределенно долгое время — не зря их называют иммортализованными, или постоянными. Обычные клетки не обладают способностью к бесконтрольному постоянному делению, так откуда берутся постоянно делящиеся клеточные линии? Хотя такое перерождение может происходить с клетками и само собой (например, после обработки мутагенами и вирусами), при работе с клеточными культурами исследователи добиваются этого намеренно.
В иммортализованных клеточных линиях лимит Хейфлика преодолевают, искусственно активируя теломеразу — фермент, удлиняющий теломеры и позволяющий клеткам избежать судьбы своих стареющих родственников. Практически клетки становятся бессмертными (то есть приобретают способность делиться бесконечно долго).
Кстати, теломераза активна и у раковых клеток. Однако их теломеры могут удлиняться и другим путем — с помощью гомологичной рекомбинации. Мы писали об этом в статье «Теломеры и новые мишени протоонкогенной терапии» [23].
Рисунок 5. Генриетта Лакс умерла от рака, но по стечению обстоятельств стала невольным источником биоматериала, давшего начало культуре клеток HeLa, давно применяемой в научных целях.
Непрерывной считается культура клеток, которая пассировалась не менее 70 раз с трехдневными промежутками. Клетки таких культур идентичны по форме и обычно приобретают гетероплоидный набор хромосом (число хромосом любое, кроме нормального), что характерно для опухолей. Иммортализованные клеточные линии получают как из здоровых тканей животных или человека, так и из опухолевых. Однако стоит отметить, что некоторые из них могут обладать онкогенной активностью, и это ограничивает их применение. Все непрерывные клеточные линии хорошо охарактеризованы и содержатся в специальных банках клеток.
При разговоре о бессмертных культурах клеток нельзя не упомянуть знаменитую клеточную линию НеLа — одну из наиболее известных и часто используемых перевиваемых культур. HeLa получил в феврале 1951 года Джордж Гай от больной раком шейки матки женщины по имени Генриетта Лакс, почившей спустя восемь месяцев. В результате наблюдений Гай отметил, что нормальные клетки женщины умирали, а раковые активно делились бесконечное количество раз. В лаборатории Гая культура изучаемых раковых клеток была названа HeLa — по инициалам пациентки (рис. 5). Подробнее эту захватывающую историю можно прочитать в статье «Бессмертные клетки Генриетты Лакс» [2].
Иммортализованные клеточные линии имеют ряд недостатков, поскольку сильно отличаются от клеток в ткани (начать хотя бы с числа хромосом). Однако они просты в использовании, гомогенны и хорошо охарактеризованы — и потому часто используются в доКИ.
Диплоидные (конечные) культуры клеток получают из клеточных линий первичных культур, выделенных из тканей эмбриона человека и животных: они, в отличие от бессмертных линий, имеют двойной набор хромосом (точно такой же, как у донора). В первых 50–60 пассажах эти клетки сохраняют диплоидность и жизнеспособность и редко «подхватывают» вирусы, а поэтому их широко используют в медицине и биологии. Также большой плюс таких культур — неонкогенность. Не зря изначально их создавали для производства вакцин, которое требовало много безопасного субстрата для размножения вакцинных штаммов вирусов.
Рецепт создания клеточной линии
С первого взгляда процесс не выглядит замысловатым: взять клетки, поместить их в среду и пересевать по мере необходимости. Однако всё не так просто. Например, при заборе опухолевых клеток для создания перевиваемой непрерывной клеточной линии лишь 1–2% клеточной популяции дает начало будущей культуре. Главная сложность размножения клеток в лабораторных условиях — неспособность к росту вне организма, а также потребность в уникальной и никому неведомой комбинации ростовых факторов.
Для получения первичных культур можно брать ткани и эмбрионов, и взрослых. Очень важно при заборе органа сохранять его капсулу (для примера — эмбрион выделяют вместе с маткой). Поскольку внешняя часть органа контаминируется при извлечении, ученые используют только его внутреннюю составляющую.
Так как же появляются на свет клеточные линии? В специальные стерильные емкости (чашки Петри или планшеты) с питательной средой высевают раковые или же нормальные клетки, добавляют факторы роста и ставят всё это в термостат, где клетки делятся в оптимальных для них условиях. В дальнейшем их пассируют, чтобы избавиться от нежизнеспособных «особей», а жизнеспособные клетки, напротив, пересевают в новые планшеты. После множества пассажей получают приспособленные расти в чашках клеточные линии, обладающие уникальными свойствами. Для сохранения их подвергают заморозке (криоконсервации) в сосудах с жидким азотом.
Нужно ли готовить клетки самим?
Очень часто для доКИ клетки закупают у специализированных компаний, занимающихся продажей клеточных линий, реактивов и приборов для лабораторий. «Покупные» культуры обычно поставляются в двух видах: замороженными или во флаконе с монослоем клеток. При работе с приобретенными культурами крайне важно поддерживать стерильность, так как новая культура может поставляться без антибиотиков, а потому легко заражаться.
Более подробно ознакомиться с системой создания банков клеток и их практического применения в промышленности можно в статье «Наработка антител для доклинических и клинических испытаний» [24].
Помимо коммерческих банков клеток, существуют еще коллекции, играющие более широкую роль: это не столько хранилища, пригодные для быстрого коммерческого использования, сколько собрания всех описанных клеточных линий. Так, в России с 1978 г. существует на базе девяти организаций коллекция клеточных культур, предназначенная для сбора клеточных линий; их криоконсервации; паспортизации (рис. 6); депонирования; создания информационного банка данных; и распространения клеточных образцов:
Какие клетки можно использовать в доКИ?
Для проведения доКИ можно использовать как первичные, так и иммортализованные (перевиваемые) культуры клеток. Обычно это уже готовые клеточные линии, хранящиеся в специальных банках, для которых описаны надежные и валидированные методы работы с ними. Первичные культуры используют реже — срок их жизни ограничен, а кроме того, в таком случае приходится доказывать пригодность этой линии для получения релевантных и воспроизводимых результатов. Тем не менее выбор клеток всегда зависит от множества факторов, в том числе от природы заболевания, против которого разрабатывают лекарство, и от свойств самого лекарства. Полностью стандартизировать подходы к разработке лекарств невозможно, ведь ученые каждый раз работают над новой, уникальной задачей. Однако используемая линия всегда должна удовлетворять общим требованиям, предъявляемым к доклиническим моделям.
Куда более строгие стандарты накладывают на клеточные линии для производства лекарств. Здесь все правила сформулированы Международной конференцией по гармонизации технических требований к регистрации лекарств для медицинского применения (ICH) в релевантном руководстве ICH, руководстве ICH по вирусной безопасности, руководстве получения и установления характеристик клеточных субстратов (ICH Q5D), а также в правилах проведения исследований биологических лекарственных средств Евразийского экономического союза.
У кого берут клетки для доклинических исследований?
Для проведения доКИ используют множество разных клеточных линий, материал для которых берут у человека, других млекопитающих, рыб и даже насекомых (табл. 2). Одни из первых клеток, использованных в доКИ, получили из почки африканской зеленой мартышки: их использовали для разработки инактивированной полиомиелитной вакцины [25]. Позже в работу пошли клетки из куриных эмбрионов, почек собак, грызунов (в основном кроликов и хомяков) и т.д.
| Вид | Орган/ткань | Название клеточной линии |
|---|---|---|
| Крыса | Гепатома | HTC |
| Невринома Гассерова узла | NGUK-1 | |
| Мышь | Гепатома | BWTG 3, MH-22a |
| Глиобластома | EPNT-5 | |
| Лимфома | L 1210, EL-4 | |
| Миелома | Clone M-3, NSO/1 P3/NS1/1-Ag4-1(NS-1), P3X63Ag8.653 | |
| Мышцы скелетные, нейробластома | Sp2/0-Ag14, C2C12, NB41A3 Neuro-2a | |
| Рабдомиосаркома | NB41A3 Neuro-2a, A-7, MCH-7, MCH-82 | |
| Саркома | J-774 | |
| Соединительная ткань | A-9, L TomNIIVS | |
| Фибробласты | McCoy B | |
| Фибросаркома | Wehi 164 | |
| Обезьяна (африканская зеленая мартышка) | Почка | BGM, BSC-1, CV-1, Vero, Vero (V), Vero 76, Vero C1008 |
| Собака | Почка | MDCK (NBL-2) MDCK, клон L-9 |
| Человек | Амнион | AMN |
| Гипернефрома | HN | |
| Глиобластома | GL-6, T 98G | |
| Кишечник, аденокарцинома | Caco-2, HuTu 80, SW 837 | |
| Кишечник, карцинома | COLO 320, HSR, HT-29 | |
| Кожно-мышечная ткань нормального эмбриона | ChEF 392/1 (ЧЭФ 392/1) | |
| Легкое, карцинома | А 549 | |
| Легкое эмбриона | ФЛЭЧ 385/13, ФЛЭЧ 985/12, ФЛЭЧ 997/11, ФЛЭЧ 1097/30, ЛЭЧ-4(81) | |
| Легкое эмбриона (трансформированные клетки) | WI-38 VA 13 subline 2RA | |
| Лейкемия В-лимфобластная | CCRF-SB | |
| Лейкемия миелогенная | K-562, KG-1, THP-1 | |
| Лейкемия промиелоцитарная | HL-60 | |
| Лейкемия Т-лимфобластная | Jurkat, MOLT-3, MOLT-4, Т-1387 | |
| Лейкоциты | RPMI 1788 | |
| Лимфома Беркитта | Daudi NAMALVA P3H3, P3HR-1(P3J-HR1K), Raji | |
| Матка, карцинома | HeLa gniiem, HeLa-КD, HeLa S 3, HeLa TK, HeLa v, М-HeLa, М-HeLa клон 11 | |
| Мезенхимные стволовые клетки: костный мозг эмбриона, мышца конечности эмбриона, крайняя плоть ребенка | FetMSC, M-FetMSC, FRSN, FRSN-1 | |
| Миелома | RPMI 8226, IM-9 | |
| Молочная железа, аденокарцинома | MCF-7, BT-20 | |
| Молочная железа, карцинома | ZR-75-1 | |
| Мочевой пузырь, карцинома | Т-24 | |
| Нейробластома | IMR-32, SK-N-MC | |
| Остеосаркома | MG-63, U-2 OS, Hos (TE85, clone F5) | |
| Печень, аденокарцинома | SK-HEP-1 | |
| Печень, карцинома | Hep G2 | |
| Поджелудочная железа, аденокарцинома | AsPC-1, Capan-2 | |
| Подкожно-жировая клетчатка | ATRC-70 | |
| Рабдомиосаркома | RD | |
| Фибросаркома | HT-1080 | |
| Эпидермис, карцинома | A 431 | |
| Эмбриональные стволовые клетки | SC5 | |
| Яичник, тератокарцинома | PA-1 |
Каковы же требования к донорам клеток? При заборе клеток у человека важно знать его возраст, пол, физическое состояние, отсутствие инфекций (ВИЧ, гепатиты В и С, сифилис), также необходимо указывать этническое и географическое происхождение донора. Например, при использовании диплоидных культур фибробластов не просто важно, а необходимо учитывать возраст человека, так как от этого сильно зависит продолжительность жизни клеток in vitro. При использовании линии животных клеток значение имеет вид, порода, условия разведения и так далее.
Проверка лекарства in vitro. Возможно ли это?
Остановимся подробнее на оценке безопасности новых лекарств на моделях in vitro — фармакологических и токсикологических исследованиях. Более подробно обо всех видах тестирования, принятых в доКИ, можно прочитать в первой статье спецпроекта — «От живого к неживому. Доклинические исследования сегодня и завтра» [10].
Фармакология in vitro: фармакодинамика и фармакокинетика
Фармакологические исследования помогают понять, что происходит с лекарством при попадании в организм (фармакокинетика) и с организмом — при приеме этого препарата (фармакодинамика).
Фармакодинамика может быть:
На этапе фармакодинамических исследований оценивают перекрестное взаимодействие лекарств и их совместимость. Например, так установили, что антимикробные препараты могут усиливать действие антибиотиков [26]. Этим часто пользуются в современной медицинской практике. Например, стоматологи пациентам с хроническим пародонтитом наряду с антибактериальными препаратами (чаще пенициллинового ряда) назначают и метронидазол.
В исследованиях первичной фармакодинамики модели in vitro обычно используют, когда хотят изучить связывание нового вещества с молекулярной мишенью, а также оценить пролиферацию клеток. Так, например, в ходе доКИ комбинированного контрацептивного препарата «Зоэли» было изучено сродство действующего вещества к рецепторам прогестерона. Причем эти исследования проводились на различных чувствительных к гормонам клеточных линиях, источником которых были крысы, кролики и человек (HeLa). В итоге установили антиандрогенную активность препарата, подтвердив это позже в исследованиях in vivo. Таким образом исследования на клетках были релевантны и показали, что препарат выполняет свою функцию в полном объеме.
Исследования вторичной фармакодинамики, напротив, могут быть нацелены на то, чтобы доказать, что препарат не обладает активностью на ненужные мишени: ферменты, рецепторы и ткани в целом. Так, доКИ in vitro известного гипотензивного препарата «Эдарби» показали, что он не только блокирует связывание ангиотензина II (этим и вызван его эффект), но и повышает чувствительность тканей к инсулину пропорционально дозе. Это значит, что при назначении препарата пациентам, страдающим диабетом, необходимо контролировать уровень глюкозы и при необходимости корректировать дозировку гипогликемических средств.
В область фармакодинамики входит и фармакологическая безопасность, когда исследуют нежелательные эффекты от приема препарата на физиологию. Исследования затрагивают воздействие препарата на сердечно-сосудистую, дыхательную, центральную нервную системы (это обязательно для любого препарата), желудочно-кишечный тракт, выделительную и прочие системы. Крайне важно пройти эти тесты в доКИ, ведь будет, мягко говоря, обидно вылечить пациента от одного заболевания, но при этом вызвать другое.
В рамках фармакокинетических исследований с помощью моделей in vitro чаще всего оценивают метаболизм препарата. В основном он происходит в печени — в гепатоцитах, ведь в их микросомах содержатся основные ферменты лекарственного метаболизма (цитохром Р450, трансферазы, флавин-содержащие монооксигеназы). Изучение метаболизма тестируемого вещества можно провести на первичной культуре гепатоцитов, срезах печени или же на перевиваемых культурах (лучше всего отображают метаболизм клеточные линии гепатомы человека).
Изучение токсичности на моделях in vitro
Исторически тесты токсикологической безопасности проводят на теплокровных животных. Чтобы оценить воздействие одного вещества на организм, ученым, как правило, требуются сотни подопытных животных, а стоимость такого «удовольствия» доходит до 1 млн долларов. Не удивительно, что исследователи пытаются максимально сократить количество используемых лабораторных животных и заменить их моделями in vitro. В настоящее время даже созданы специальные организации, контролирующие внедрение новых методов — например, Европейский центр по утверждению альтернативных методов.
На клеточном уровне можно выделить три основных механизма токсического действия лекарственных препаратов: повреждение мембран клеток, нарушение метаболизма и нарушение деления клеток. Все эти механизмы можно оценить на моделях in vitro. Исследование токсичности можно проводить как на первичных, так и на перевиваемых культурах клеток.
Из постоянных клеточных линий человека используют: клетки немелкоклеточного рака легких, эпителиальные клетки синовиальной жидкости, карцинома печени, глиобластома-астроцитома, аденокарцинома толстого кишечника, Т-клеточная лимфома, карцинома матки, гепатома печени, колоректальная аденокарцинома человека и др. Распространенные животные культуры клеток включают: фибробласты мышей, клетки опухоли Эрлиха, клетки гепатомы крыс и т.д. Среди первичных культур чаще используют гепатоциты для оценки гепатотоксичности. Как правило, применяется та клеточная линия, которая содержит клетки органа, оцениваемого по токсическому эффекту тестируемого вещества (табл. 3) [30].
| Токсический эффект | Клеточная культура |
|---|---|
| Цитотоксичность | Фибробласты человека и мыши, клетки эпителия, HeLa — карциномы матки и другие |
| Нарушение функции органов дыхания | Клетки карциномы легких SQ-5 |
| Кардиотоксичность | Эндотелиоциты, кардиомиоциты |
| Нейротоксичность | Нейроны куриного эмбриона, клетки астроглии крыс, клетки NB-1 — нейробластомы |
| Гепатотоксичность | Hep-G2 с гепатомы человека, клетки гепатомы крыс HTC, гепатоциты человека, гепатоциты крыс и мышей |
| Гематотоксичность | HL-60 — лейкозные лейкоциты, клетки крови, эритроциты периферической крови мышей BALB |
| Нефротоксичность | Эпителиоидные клетки эмбриональной почки, клетки почек быка MDBK |
| Иммунотоксичность | Клетки тимуса, селезенки, клетки крови |
| Дерматотоксичность | Эмбриональные фибробласты, кератиноциты человека, кератиноциты кролика и крысы |
Для исследования цитотоксичности на клеточной линии проводят несколько тестов, основанных на подсчете количества клеток, оценке их метаболизма и целостности мембраны. Наверное, проще и эффективнее для изучения метаболизма препарата — микротитрационный МТТ-тест (рис. 7). С его помощью можно наглядно оценить жизнеспособность клеток по ярко-фиолетовой окраске, которую приобретают живые и здоровые клетки, окисляющие своими бодрыми митохондриями добавляемый в среду тетразол. Если клетка жива и ее митохондрии активны, окраска будет яркой, и чем активнее метаболизм, тем насыщеннее цвет.
Для тех же целей можно измерить активность лактатдегидрогеназы (ЛДГ) в среде. Почему ее? ЛДГ — это внутриклеточный фермент, содержащийся практически во всех клетках человека и животных, а поэтому при нарушении клеточной мембраны (например, из-за повреждения токсином) ЛДГ будет выходить из клеток наружу. Это довольно простой и наглядный тест, позволяющий оценивать «самочувствие» клеток в реальном времени.
Еще один путь — окраска клеток трипановым синим (рис. 8). Этот краситель не проходит через мембрану, однако если та повреждена — краска проникает в ядро и расцвечивает его оттенками синего, показывая, что клетка «прохудилась» и, скорее всего, уже нежизнеспособна.
Рисунок 7. МТТ-тест. По яркости окраски раствора в ячейках планшета можно оценить количество жизнеспособных клеток. Чем интенсивнее цвет, тем больше количество жизнеспособных клеток.
Рисунок 8. Трипановый синий при повреждении мембраны клеток окрашивает клеточное ядро в интенсивный синий цвет. Такая картина говорит нам, что, как ни грустно, клетка уже мертва.
2D- и 3D-модели культур клеток
Традиционно клеточные линии культивируют в один слой в чашке Петри или на планшете (рис. 9), погруженными в питательную среду. Культура клеток получается однослойная, а чашка (стеклянная или пластиковая) служит субстратом для закрепления. Монослойное культивирование широко используются в биомедицинских исследованиях, в частности, с целью определения митотического потенциала клеток, изменения их функциональной активности под воздействием специфических факторов, для сравнения физиологических и биохимических характеристик клеток, полученных из нормальных и опухолевых тканей и, конечно, для проведения доКИ. Клетки, культивированные в монослое, морфологически отличаются от клеток in vivo: они более плоские и растянутые, а это может заметно изменить внутриклеточные процессы (рис. 10) [32].
Рисунок 9. Культивирование в монослое проводят в стерильной лабораторной посуде : чашках Петри (слева), матрасах (справа) или планшетах. Для поддержания жизнедеятельности культуры необходима плотная подложка (субстрат), обычно это пластик.
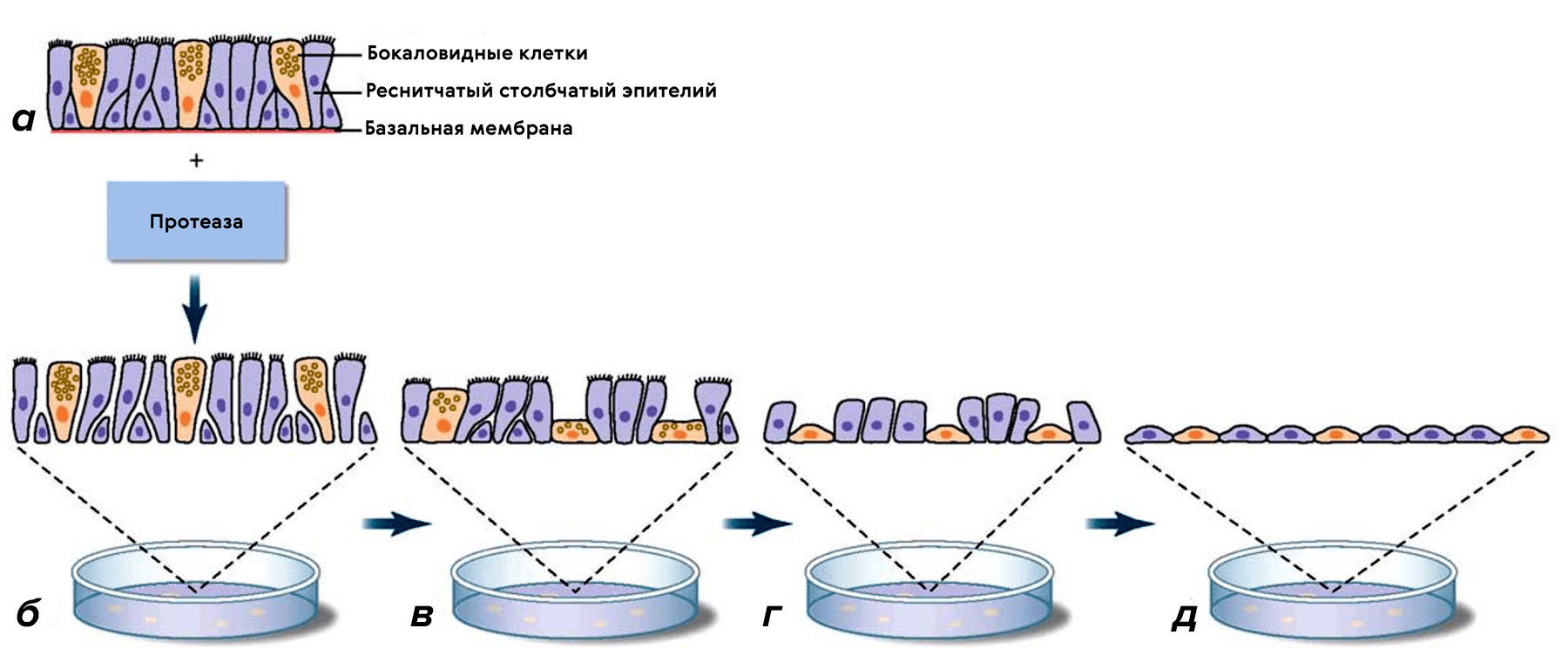
Рисунок 10. Клетки эпителиальной ткани в монослое меняют морфологию. а — Эпителий, полученный из нормальной слизистой оболочки. б — Диссоциированные эпителиальные клетки после обработки протеазой. в — Клетки теряют высоту, уплощаются через несколько дней культивирования. г — Столбчатые клетки теряют реснички, а бокаловидные клетки полностью уплощаются. д — Полное уплощение всех эпителиальных клеток происходит в течение 2–3 недель.
Клетки можно выращивать не только в монослое, но и в суспензии, когда они просто плавают в культуральной среде внутри биореактора — это идеально подходит для клеток крови, которые в организме существуют ровно в таком состоянии. Биореакторы бывают нескольких типов: с механическим перемешиванием; газо-вихревые реакторы, в которых всё перемешивает поток воздуха, продуваемый через среду; а также комбинированные. Суспендирование обеспечивается разными приемами, включая покрытие стенок реакторов гидрофобным материалом (чтобы клетки не прилипали) и использование питательной среды без ионов кальция (оказывается, кальций способствует адгезии клеток к субстрату).
3D-культуры
Как ни крути, 2D-культуры остаются плоскими, не отражающими всей совокупности межклеточных взаимодействий в организме. Так же картина, в сравнении со скульптурой, позволяет взглянуть лишь с одной стороны. В последнее время начинают использовать 3D-культуры, более сложные в обращении, но гораздо более реалистичные — что важно в том числе и для целей доКИ.
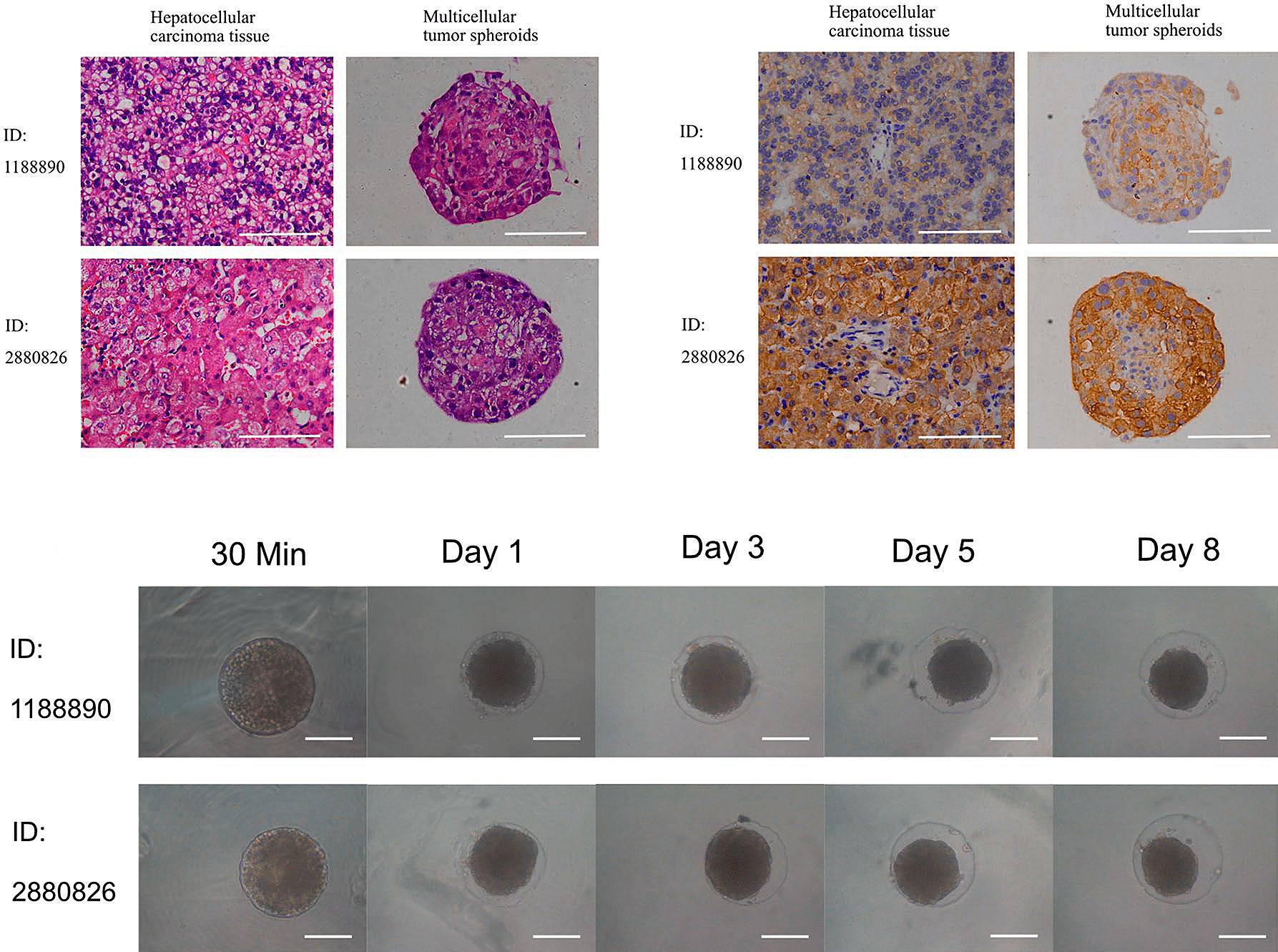
Базовая 3D-культура — это тканевые сфероиды (рис. 11): сгустки из живых клеток (1000 — 20 000 штук) диаметром 200–300 мкм [34]. Культивирование проводят либо в луночных планшетах с агаром, либо методом висячей капли, либо же применяют специальные (правда, довольно дорогие) планшеты. Сфероиды можно «строить» на специальном каркасе (скаффолде), имитирующем внеклеточный матрикс, куда засеваются клетки. Сфероиды часто используют в доклинических исследованиях как модели бессосудистых опухолевых узлов, микрометастазов или участков солидных опухолей (рис. 12).
О том, как именно создают сфероиды, можно прочитать в статье «Тумороиды — микроопухоли в пробирке» [35].
Рисунок 11. Сфероид — плотное скопление клеток, имитирующих среду in vivo
Рисунок 12. Сфероидная культура первичных клеток гепатоцеллюлярной карциномы человека, культивируемых в агарозных ячейках 96-луночных планшетов в разные моменты времени. На изображении хорошо видно уплотнение сфероидов к восьмому дню: это характерная особенность сфероидов. На таких моделях можно оценивать эффект и цитотоксичность противоопухолевых препаратов.
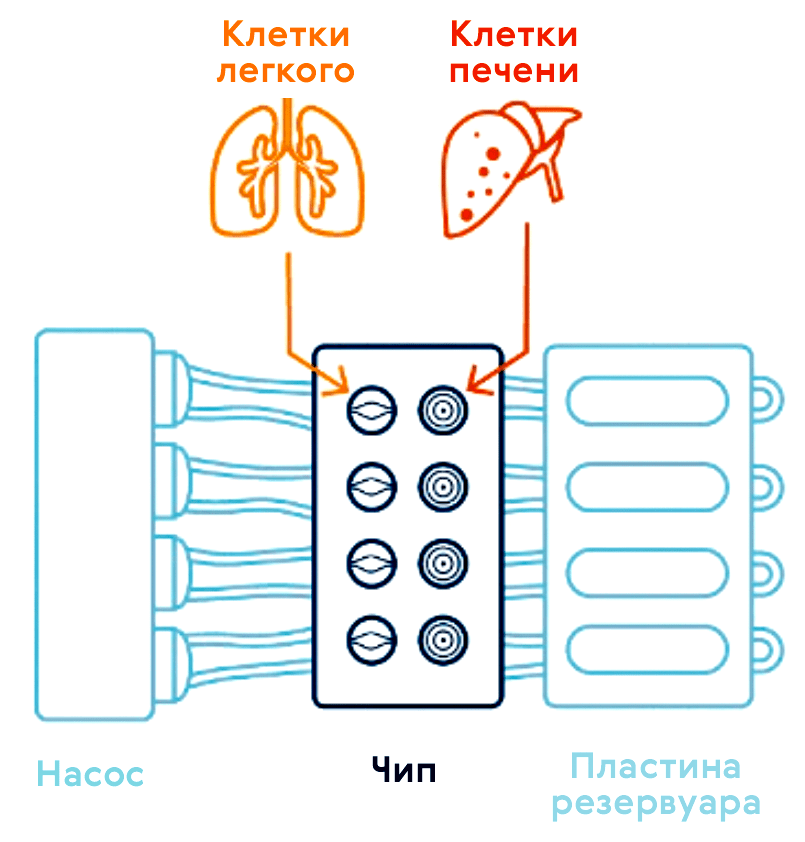
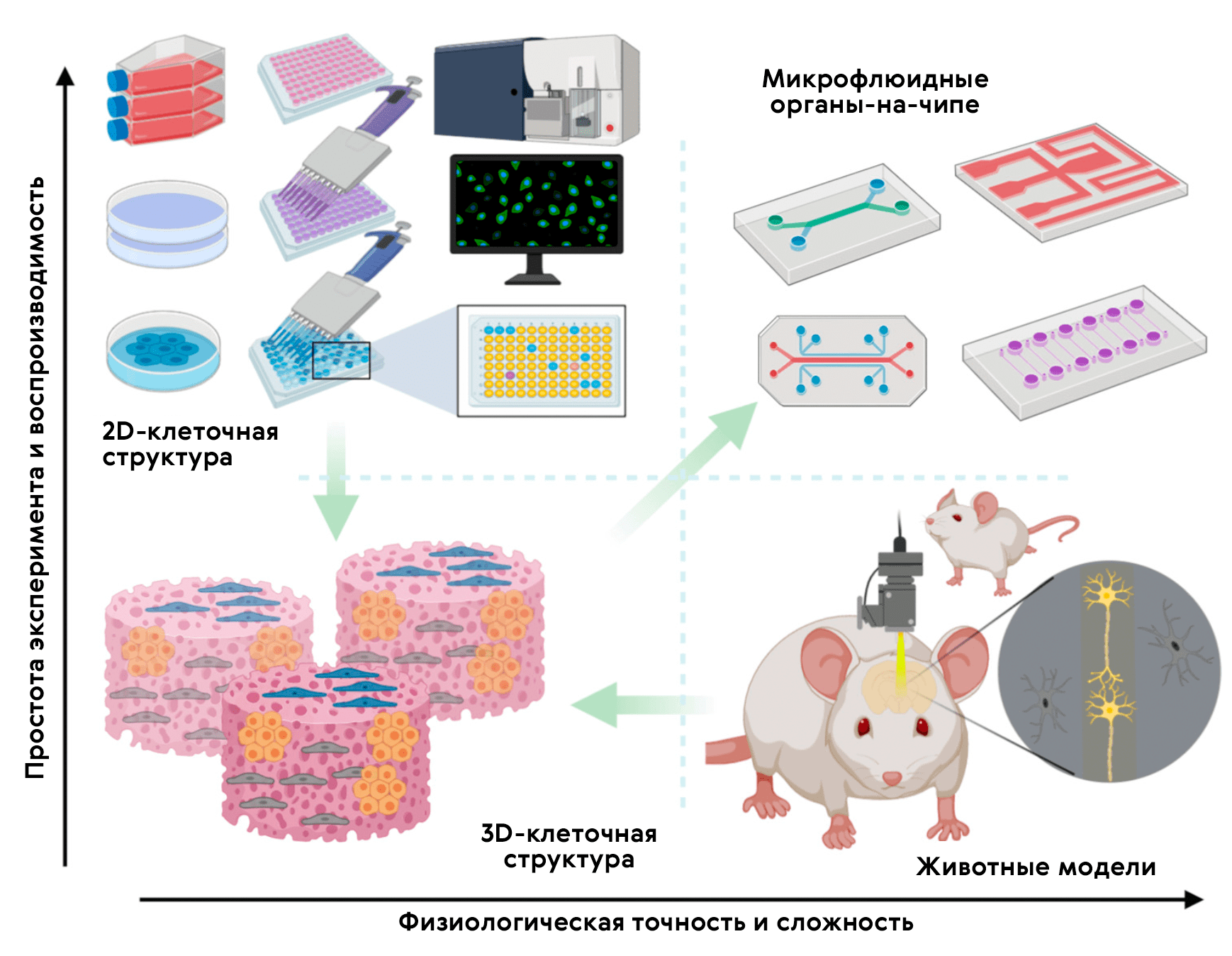
Существует еще одна многообещающая 3D-модель — органы-на-чипе (рис. 13 и 14; видео 1) [37], возникающая в наши дни на стыке микрофлюидики и клеточных технологий. Орган-на-чипе позволяет проводить реалистичные испытания новых лекарств и может предсказывать реакцию на множество стимулов, включая воздействие лекарственных препаратов и окружающей среды.
Рисунок 13. Орган-на-чипе. Схема тканей легкого и печени на чиповой платформе, объединяющей их в единую циркулирующую систему [38]. На рисунке 14 можно увидеть одну из культур клеток, применяемых в этих девайсах.
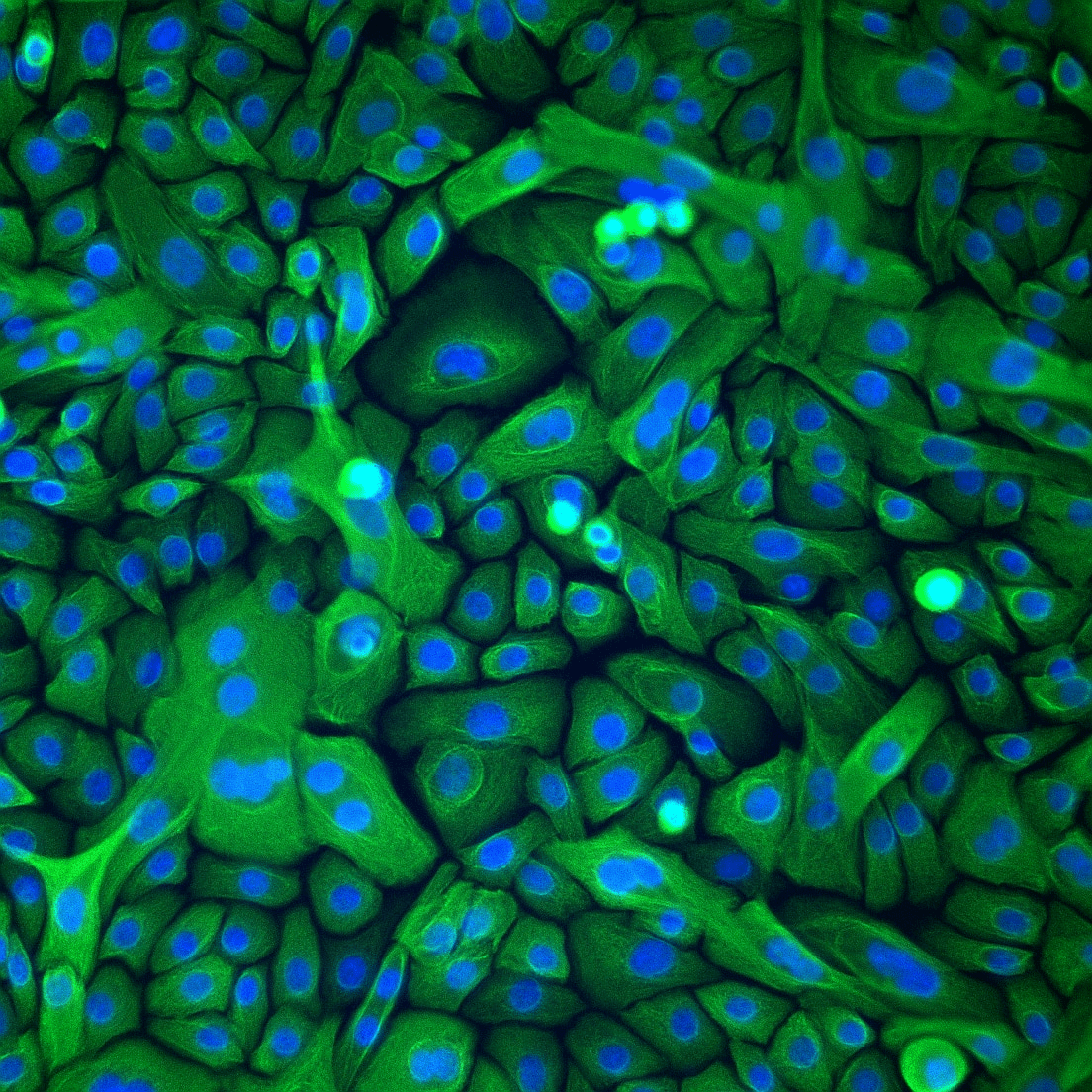
Рисунок 14. Первичная культура бронхов человека, на основе которой исследователи PMI Science создают 3D-органотипическую легочную ткань для органов-на-чипе. Зеленый цвет, в который окрашены клетки, показывает белок цитокератин 5, формирующий цитоскелет.
Видео 1. Орган на чипе — 3D-микрофлюидное устройство, содержащее каналы, заполненные живыми клетками и имитирующее работу системы органов человека.
Технологическая основа органа-на-чипе (рис. 15) — 3D-микрофлюидное устройство для культивирования клеток, разработанное для имитации физиологии органа [39]. Крошечные каналы позволяют нано-объемам жидкости транспортировать и распределять питательные вещества или лекарства по клеткам, населяющим микроскопические камеры девайса. Одна из разновидностей — опухоль-на-чипе, на которой удобно проводить скрининг препаратов [40].
Рисунок 15. Место органов-на-чипе в арсенале доклинических исследований. 2D-культуры in vitro предлагают быстрый и воспроизводимый способ анализа лекарственного препарата; однако им не хватает 3D-организации среды тканей. Стандартные 3D-культуры клеток могут обеспечить объемную среду для 3D-культивирования, но всё равно не позволяют контролируемо воспроизвести физиологию и патологию человеческого организма in vivo. Модели на животных позволяют проводить релевантный анализ in vivo, однако различия человека и прочих животных снижают точность и воспроизводимость экспериментальных результатов. Микрофлюидные органы-на-чипе позволяют прицельно культивировать клетки в органотипической микроархитектурной среде, представляя простую, но довольно физиологичную платформу не только для исследования биологии человека, но и для проведения доКИ.
Более подробно ознакомиться с методикой органа-на-чипе в рамках доКИ можно будет в следующей статье. А узнать про персонализированную медицину и органы-на-чипе в любых их проявлениях можно в следующих статьях «От медицины для всех — к медицине для каждого» [41], «Фармакогеномика: изучение генов на службе персонализированной медицины» [42], «Человек на чипе» [37], «Органы из лаборатории» [43].
Когда для 2D-культур включается красный свет?
Мы уже сказали, что монослойные культуры — пока что самый частый, хотя во многих случаях и не совсем адекватный выбор для доКИ. Они просты в использовании (замена среды и пассировка не вызывают трудностей), однако совершенно не повторяют трехмерную организацию живых тканей, а потому уже на старте снижают достоверность исследований in vitro [45]. И если в суспензиях еще возможно использование сокультур (когда к исследуемым клеткам добавляют другие, имитирующие расположение в натуральной ткани) [46], то для монослоя такой возможности нет вообще.
Когда это важно? Например, при разработке противоопухолевых препаратов, где монослой может дать попросту ложные результаты. Дело в том, что в организме опухоль — это очень плотный сгусток клеток, в центре которого постоянный дефицит кислорода и питательных веществ, но и лекарство туда проникает гораздо хуже (а значит, и эффекта от лечения может не быть). В монослое же все клетки одинаково доступны, и эта разница здесь совершенно принципиальна. Кроме того, клетки опухоли гетерогенны (в один момент времени находятся на разных стадиях клеточного цикла), что также меняет восприимчивость к лекарству. 3D-культуры позволяют создать нужные градиенты веществ и лекарства, а потому именно их предпочтительно использовать для поиска противоопухолевых лекарств [47].
Подтвердить это можно работой польских исследователей, которые in vitro воздействовали противоопухолевым препаратом — 5-фторурацилом — на раковые клетки человека в монослойном и сфероидном состоянии. Оказалось, что в 2D-системе выжило только 5% клеток, тогда как в 3D-среде живыми и здоровыми остались 75% [47]! Эффективность препарата в 3D-культуре была в 15 раз ниже, и если руководствоваться лишь данными на монослоях, можно уверовать, что было создано революционное лекарство от рака, которое на деле окажется просто пшиком.
Но и это еще не всё. Опухолевые клетки в организме выделяют сигнальные молекулы в среду и таким образом готовят специальные ниши для будущих метастазов: читайте об этом феномене в статье «Опухолевые разговоры, или Роль микроокружения в развитии рака» [48]. Поэтому лекарство обязано действовать не только на раковые клетки, но и на их микросреду. В монослойной культуре такого сделать просто нельзя. В результате тестирование противоопухолевых средств на 2D-моделях нередко приводит к ложно-успешным результатам (табл. 4). И, к сожалению, опухоли — не единственный пример, когда монослой так подводит исследователей.
| Показатель | 2D-модели | 3D-модели |
|---|---|---|
| Морфология | Вытянутые, плоские | Естественная форма в сфероидах |
| Пролиферация | Пролиферируют быстрее, чем in vivo | В зависимости от типа клеток могут пролиферировать либо быстрее, либо медленнее |
| Воздействие препарата и среды | Клетки одинаково подвержены | Не может проникать в центр сфероида |
| Стадия клеточного цикла | Одна | Разные |
| Экспрессия генов | Отличается от in vivo | Аналогична in vivo |
| Чувствительность к препарату | Чувствительны | Более устойчивы |
Что насчет вредных привычек? Исследования ФМИ
Научная платформа PMI Science, созданная компанией «Филип Моррис Интернэшнл», проводит исследования, направленные на разработку альтернативных бездымных продуктов, выбор которых по сравнению с продолжением курения сигарет может уменьшить риск развития заболеваний, связанных с курением, так как основной вред наносят продукты горения табака. В рамках платформы исследовательскую деятельность осуществляют более 900 экспертов, ученых и сотрудников научных лабораторий. В своих исследованиях они применяют различные подходы культивирования клеток, в том числе и 3D-системы. Так, исследователи построили 3D-клеточную модель дыхательных путей, в которой клетки показывали тот же профиль экспрессии генов, что и эпителиальные клетки трахеи и бронхов человека.
В PMI для создания и оценки воздействия бездымных аэрозолей используют 3D-культуры дыхательного эпителия человека разной локализации (носовые, оральные, десневые и бронхиальные), непосредственно подвергающиеся воздействию сигаретного дыма при его вдыхании. Причем модели культивируются с интерфейсом воздух—жидкость, что позволяет тестировать весь сигаретный дым и аэрозоли. Всё это осуществляется с помощью системы VITROCELL [51]. Недавно научная команда продемонстрировала, что эти 3D- системы in vitro являются надежными моделями для оценки бездымных продуктов с пониженным риском: реакция данных систем была идентична тканевым компонентам in vivo.
Всё сходится к тому, что 3D-культура клеток — гораздо более подходящая модель поведения и организации клеток in vivo. Но есть у нее, увы, и минусы по сравнению с хорошо зарекомендовавшим себя культивированием в монослое. Из-за своей новизны техника трехмерного культивирования еще не отлажена и сложна в обращении. Наконец, она просто дорогá [45].
Нюансы 3D-культивирования
В процессе 3D-культивирования клеток в рамках одного исследования материал часто берут от одного донора. Но будут ли результаты валидны, если доноров взять несколько? Ответ на него взялись найти ученые платформы PMI Science. Они сравнили морфологию и функцию 3D-культур эпителиальной ткани легких, полученных от разных доноров, и решили оценить реакцию каждой на воздействие разрабатываемых бездымных аэрозолей, исследуя их токсичность. Результаты исследования показали, что, независимо от морфологии культур легких, полученных от разных доноров, они всё же демонстрируют сходную реакцию на различные стимулы с точки зрения функциональности и метаболических возможностей [52].
Мышь или пробирка? Что перевесит на чаше весов доКИ?
Безусловно, основной моделью в доКИ остаются животные. С помощью экспериментов in vivo пока наиболее точно удается воссоздать процессы, происходящие при попадании новых лекарств в организм человека, а потому без них не обойтись.
Однако в последние десятилетия мы наблюдаем бум применения 3D-культур в тестировании терапевтических средств. С их появлением клеточные технологии становятся всё более популярными, поскольку растет релевантность получаемых с их помощью результатов. В ближайшем будущем прогрессивные модели in vitro продолжат вытеснять животных, занимая в доКИ всё более значимое место. В следующей статье спецпроекта мы поговорим об одной такой технологии, затронутой в этом материале лишь по касательной, — об органах-на-чипе.