Экспрессия опухолевых клеток что это
Диагностика экспрессии PD-L1
Что представляет собой лиганд программируемой клеточной гибели PD-L1?
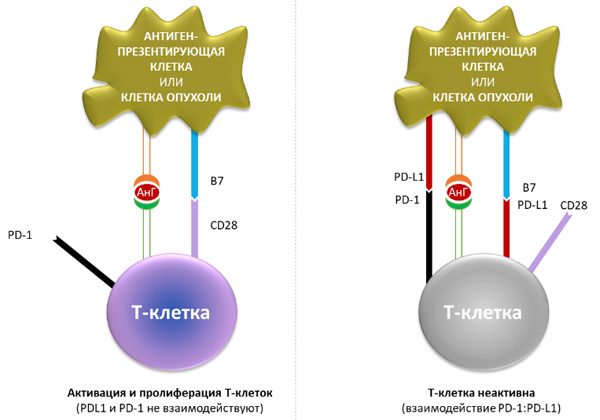
PD-L1 – лиганд рецептора программируемой клеточной гибели 1 (PD-1). Это трансмембранный белок с молекулярной массой 40 кДа, экспрессируемый на T- и B-лимфоцитах, NK-клетках, дендритных клетках, макрофагах, мезенхимальных стволовых клетках. PD-L1 способен связываться не только с рецептором PD-1, но и обладает сродством к CD80 (B 7.1) – белку, находящемуся на поверхности дендритных клеток, активированных B-клеток и моноцитов, который стимулирует активацию и выживаемость Т-лимфоцитов путем взаимодействия с CD28 на их поверхности. Лиганд PD-L1 способен угнетать этот процесс путем конкурентного связывания с CD80. На рисунке 1 представлены межклеточные взаимодействия (активирующие и ингибирующие сигналы) между Т-лимфоцитом и антигенпрезентирующей клеткой.
Рисунок 1. PD-1/PD-L1 сигнальный каскад в межклеточном взаимодействии иммунокомпетентных клеток. При связывании лиганда PD-L1 (лиганд рецептора программируемой клеточной смерти 1, также называемого PD-1) с рецепторами PD-1 и B7.1, находящимися на Т-лимфоцитах, происходит угнетение цитотоксической активности Т-лимфоцитов.
Роль PD-L1 в патогенезе злокачественных образований
Воздействие на сигнальный путь иммунной контрольной точки PD-1:PD-L1 лежит в основе иммунной терапии рака легкого, молочной железы, уротелиального рака и других злокачественных новообразований. Воздействие направлено на рецептор PD-1 и его лиганды PD-L1 и PD-L2. Наиболее важная роль в ускользании опухоли от иммунного ответа отводится взаимодействию рецептора PD-1 и лиганда PD-L1.
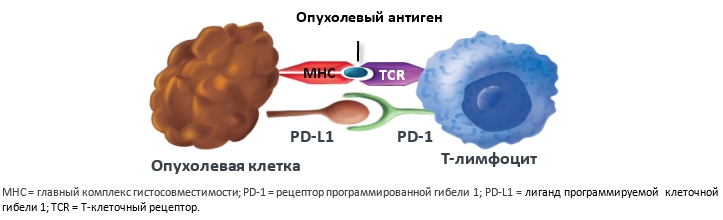
Длительная антигенная стимуляция, часто наблюдаемая при опухолевых заболеваниях, приводит к устойчивой экспрессии рецептора PD-1 на T-лимфоцитах и повышению экспрессии лигандов PD-L1 на опухолевых и иммунных клетках. Таким образом, опухоль вырабатывает механизм ускользания от иммунного ответа посредством гиперэкспрессии лиганда PD-L1, который, связываясь с рецептором PD-1 на T-лимфоцитах, нарушает их цитотоксическую активность (рис.2).
Рисунок 2. Сигнальный путь PD-1:PD-L1, инактивирующий действие Т-лимфоцитов.
Что нужно учитывать при выборе теста для оценки PD-L1 экспрессии?
Тест для определения экспрессии PD-L1 позволяет выделить группу пациентов с наибольшей вероятностью ответа на терапию ингибиторами иммунных контрольных точек. Важно учитывать, что для различных иммунных препаратов и показаний существуют отличия в методике проведения PD-L1 тестирования:
Вывод – перед проведением PD-L1 исследования необходимо удостовериться, что выбран правильный тест, на правильной культуре клеток и корректно интерпретировать полученные результаты.
Каким пациентам необходимо определение уровня PD-L1 экспрессии?
Анализ экспрессии PD-L1 в зависимости от планируемой к назначению терапии может быть рекомендован к назначению пациентам с:
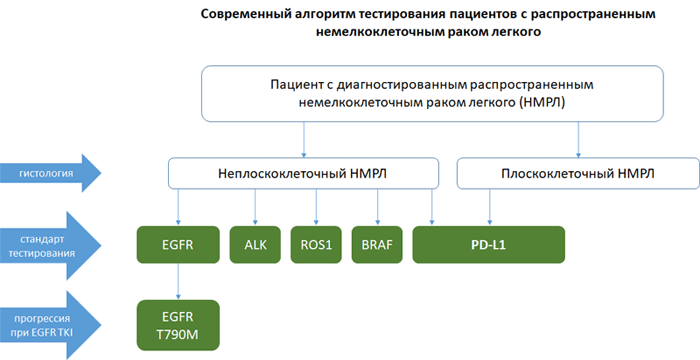
НМРЛ: методы определения экспрессии PD-L1
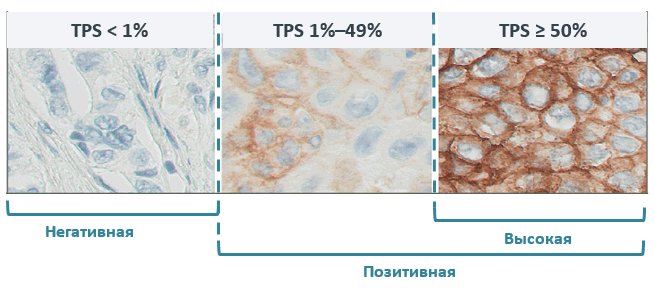
Экспрессия PD-L1 определяется методом иммуногистохимии. Оценка осуществляется путем подсчета соотношения опухолевых клеток с позитивным окрашиванием мембраны к общему количеству опухолевых клеток (TPS – tumor proportion score), результат выражается в процентах от 0 до 100.
В России зарегистрированы три диагностических набора для определения экспрессии PD-L1: производства Roche Diagnostics – PD-L1 sp142 и sp263, производства Dako – PD-L1 22C3. Тестирование проводится на платформах Ventana и Dako Autostainer Link 48 соответственно.
Экспрессия PD-L1 на опухолевых клетках
По уровню экспрессии PD-L1 выделяют следующие группы: отрицательная и позитивная экспрессия, в зависимости от количества окрашенных клеток.
Для тестирования может быть использован операционный или биопсийный материал первичной или метастатической опухоли, фиксированный в формалине и залитый в парафин. Обязательным требованием является наличие в исследуемом образце не менее 100 живых опухолевых клеток.
Определение уровня экспрессии PD-L1 и персонализированный подход к выбору терапии, основанный на результатах иммуногистохимического тестирования, позволяет сделать лечение пациентов с немелкоклеточным раком легкого более эффективным и безопасным в 1 линии терапии.
Алгоритм тестирования при распространенном НМРЛ
УРОТЕЛИАЛЬНЫЙ РАК: методы определения экспрессии PD-L1
Стандартом терапии 1 линии пациентов с раком уротелия продолжают быть химиотерапевтические режимы на основе цисплатина [4]. Однако по данным литературы до 50% больных не подходят для назначения данной терапии [5]. Ситуация с лечением изменилась с появлением иммунотерапевтических анти-PD-L1 препаратов [7]. Сейчас для назначения иммунотерапии в первой линии распространенного уротелиального рака пациентам, которые не могут перенести ципсплатин, рекомендовано проведение PD-L1 диагностики. Для остальных групп пациентов диагностика PD-L1 не требуется (при невозможности проведения любой платиносодержащей химиотерапии и у пациентов с прогрессированием заболевания в ходе или после окончания любой платиносодержащей химиотерапии или в течение 12 месяцев после неоадъювантной или адъювантной химиотерапии).
Какой метод используется для определения экспрессии PD-L1 у пациентов с уротелиальным раком?
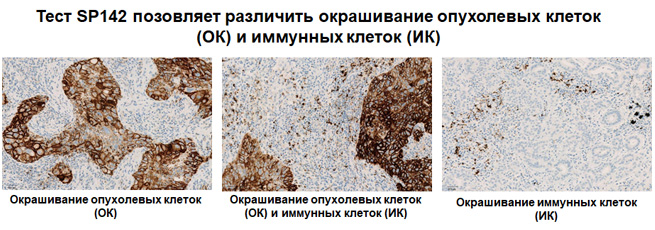
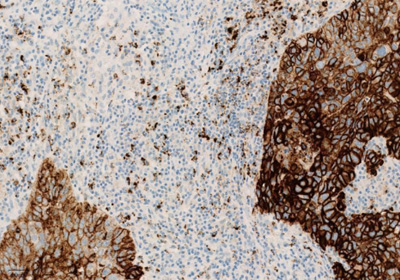
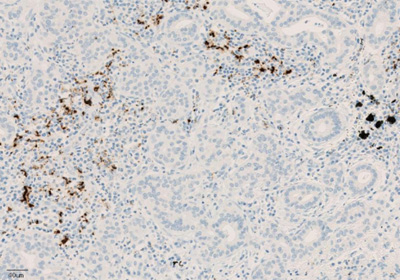
Экспрессия PD-L1 определяется методом иммуногистохимии. Для этих целей используется диагностический набор Ventana PD-L1 (SP142) Assay (Ventana Medical Systems, Inc.). Для тестирования используется ткань опухоли, фиксированная в формалине и залитая в парафиновый блок. PD-L1 статус у пациентов с уротелиальной карциномой определяется как часть площади опухоли, занятая PD-L1 экспрессирующими иммунными клетками, инфильтрирующими опухоль, любой интенсивности окрашивания.
Рисунок 3. Окрашивание опухолевых и иммунокомпетентных клеток, инфильтрирующих опухоль, с помощью ИГХ-анализа VENTANA PD-L1 (SP142).
Рисунок 4. Окрашивание иммунокомпетентных клеток, инфильтрирующих опухоль, с помощью ИГХ-анализа VENTANA PD-L1 (SP142).
Определение уровня экспрессии PD-L1 иммуногистохимическим методом позволяет выделить группу пациентов для назначения анти-PD-L1 терапии.
Какой уровень PD-L1 экспрессии является основанием для назначения иммуннотерапии при уротелиальном раке?
Наличие у пациентов экспрессии PD-L1 ≥5% на иммунокомпетентных клетках, инфильтрирующих ткань уротелиальной карциномы, по данным клинических исследований ассоциирована с увеличением частоты объективного ответа на иммунную терапию.
ТНРМЖ: методы определения экспрессии PD-L1
Тройной негативный рак молочной железы – самая агрессивная форма среди рака молочной железы [4]. Традиционно применяемая химиотерапия не позволяла достичь значимого увеличения продолжительности жизни свыше медианы в 18 месяцев. Появление анти-PD-L1 терапии, с одной стороны, позволило преодолеть медиану общей выживаемости в 2 года, а с другой стороны – для назначения терапии необходимо выделить группу PD-L1 позитивных пациентов. В отличие от уротелиального рака, назначение анти-PD-L1 терапии обязательно требует тестирования пациенток с тройным негативным раком молочной железы.
Какой метод используется для определения экспрессии PD-L1 у пациентов с ТНРМЖ?
При определении статуса PD-L1 для решения вопроса об иммунотерапии важно выбрать оптимальный метод. Тест VENTANA PD-L1 (SP142) позволяет идентифицировать пациентов с тройным негативным раком молочной железы (ТНРМЖ), которые могут получать анти-PD-L1 терпию.
Ткани пациентов с ТНРМЖ, окрашенные с использованием теста VENTANA PD-L1 (SP142), оценивают по окрашиванию инфильтрирующих опухоль иммунных клеток (IC). IC – это иммунные клетки, присутствующие в интратуморальной и прилегающей перитуморальной строме. В это понятие включены лимфоциты, макрофаги, дендритные клетки и полиморфноядерные лейкоциты. IC оценивают как долю области опухоли, которую занимают иммунные клетки с окрашиванием PD-L1 любой интенсивности.
Какой уровень PD-L1 экспрессии является основанием для назначения иммунной терапии при ТНРМЖ?
Наличие у пациентов экспрессии PD-L1 ≥1% на иммунокомпетентных клетках, инфильтрирующих ткань опухоли, по данным клинических исследований ассоциирована с увеличением общей выживаемости, выживаемости без прогрессирования и частоты объективного ответа на иммунную терапию.
О программе определения экспрессии PD-L1
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
Экспрессия маркеров опухолевого роста
Экспрессия маркеров опухолевого роста: HER 2 neu, Ki 67, P 53, как фактор влияния на метастазирование рака молочной железы в легкие
В.Н. Плохов, И.И. Андреяшкина*
Кафедра онкологии с курсом онкологии ВолгГМУ, Дорожная клиническая больница на ст. Саратов II ОАО «РЖД»*
В работе представлен анализ данных литературы и результатов собственных наблюдений авторов относительно выявления закономерностей экспрессии маркеров опухолевого роста HER 2 neu, Ki 67, P 53 при метастазировании рака молочной железы в легкие. Рассмотрено влияние гиперэкспрессии HER 2 neu на клинические варианты метастазирования рака молочной железы в легкие. Оценены изменения иммуногистохимических маркеров на фоне проведения полихимиотерапии.
Ключевые слова: рак молочной железы, метастазы в легкие, иммуногистохимические маркеры.
Expression of tumors growth markers her 2 neu, ki 67, p 53 as afactor affecting mammary cancer metastasizing into lungs
V.N. Plohov, I.I. Andreiashkina
The paper presents an analysis of literature data and results of authors own observations on the identification of patterns of expression of markers of tumor growth: HER 2 neu, Ki 67, P 53, with metastatic breast cancer in the lungs. The influence of overexpression of HER 2 neu in clinical variants of metastatic breast cancer in the lungs. Evaluate the changes of immunohistochemical markers on the background of the chemotherapy.
Key words: breast cancer, lung metastases, immunohistochemical markers.
При метастазировании рака молочной железы в легкие большое значение имеет учет факторов, предсказывающих эффект от лечения и прогноз течения заболевания [3, 6]. Для определения прогноза и выбора терапии при метастазах рака молочной железы в легкие важное значение имеют ряд молекулярных маркеров. Во многих исследованиях получены доказательства большого прогностического значения таких иммуногистохимических маркеров, как эпидермальный фактор роста HER 2 neu, тканевые маркеры пролиферации и апоптоза при раке молочной железы. Иммуногистохимическое исследование позволяет оценивать данные показатели в связи с клеточным циклом опухоли [2, 5, 8].
Знание иммуногистохимических маркеров как эпидермальный фактор роста HER 2 neu, тканевые маркеры пролиферации и апоптоза позволяют разработать оптимальную модель для оценки риска метастазирования рака молочной железы в легкие у отдельного больного и выбора метода лечения [1, 4, 7, 9].
В изученной нами литературе практически отсутствуют систематизированные сведения о значении таких иммуногистохимических маркеров, как эпидермальный фактор роста HER 2 neu, тканевые маркеры пролиферации и апоптоза в построении оптимальной модели для оценки риска метастазирования рака молочной железы в легкие у отдельного больного и выбора метода лечения.
Установление закономерностей экспрессии маркеров опухолевого роста HER 2 neu, Ki 67, P 53 при метастазировании рака молочной железы в легкие.
Проведена сравнительная оценка показателей иммуногистохимического статуса у больных раком молочной железы с метастазами в легкие, находившихся на лечении в клинике факультетской хирургии и онкологии ГОУ ВПО Саратовского ГМУ им. В. И. Разумовского Минздравсоцразвития России, НУЗ Дорожная клиническая больница на ст. Саратов II ОАО «РЖД» за период с 2008 по 2010 гг.
В группы наблюдения были включены 62 больных раком молочной железы с метастазами в легкие (средний возраст составил 57,6 лет). Исследование проводилось в три этапа исследования: I этап — исследование уровня HER 2 neu, Ki 67, P 53 у первичных больных (до выявления метастазов в легкие); II этап — исследование уровня HER 2 neu, Ki 67, P 53 в метастатическом лимфоузле у первичных больных (до выявления метастазов в легкие); III этап — исследование уровня HER 2 neu, Ki 67, P 53 метастатического узла в легких у больных раком молочной железы.
Определение HER 2 neu, Ki 67, P 53 проводилось авидин-биотиновым методом. Методика приготовления срезов из парафинового блока для иммуногистохимии практически не отличается от обычного их изготовления для гистологической окраски. Результаты иммуногистохимической реакции могут оцениваться полуколичественным способом. Следует отметить, что универсальной оценки иммуноокрашивания нет, в исследовании применялась качественная оценка реакции и выражалась как отрицательная (-), слабо положительная (+), умеренно положительная (++) и сильно положительная (+++) реакции.
Статистический анализ и графика выполнялись с помощью стандартного пакета прикладных программ «Statistica 6.0», «Excel 2000». При статистической обработке полученных результатов использовались: критерий Шапиро-Вилкс для оценки нормальности распределения, критерий Стьюдента для независимых переменных, критерий Манна-Уитни для оценки значимости различий между группами при отсутствии нормальности распределения признака, односторонний критерий Фишера для оценки значимости различий между группами по качественным признакам.
Результаты исследования и их обсуждение
Результаты исследований показали, что частота встречаемости опухолей с гиперэкспрессией HER 2 neu на I этапе исследования составила 58 %, тогда как опухоли с отрицательным HER 2 neu статусом отмечались в 14,5 % наблюдениях. Экспрессия HER 2 neu как фактор прогноза статистически коррелирует с экспрессией рецепторов эстрогенов (РЭ), рецепторов прогестерона (РП). При оценке гормонального статуса иммуногистохимическим методом положительная экспрессия рецепторов эстрогенов выявлена в 35 % наблюдениях, из них слабая отмечена в 57,2 % наблюдениях, умеренная в 28,6 % наблюдениях и выраженная — в 14,3 % наблюдениях. Экспрессия рецепторов прогестерона отмечена в 45 % наблюдениях, из них выраженная экспрессия выявлена в 22,2 % наблюдениях, умеренная — в 22,2 % наблюдений, слабая в 55,6 % наблюдений. Увеличение экспрессии HER 2 neu сопровождается уменьшением экспрессии РЭ в 75 % наблюдений и уменьшением экспрессии РП в 80 % наблюдений (p Заключение
Анализ приведенных выше данных относительно закономерностей экспрессии маркеров опухолевого роста HER 2 neu, Ki 67, P 53 при метастазировании рака молочной железы в легкие позволил сделать следующие выводы:
Экспрессия опухолевых клеток что это
ИГХ, иммуногистохимическое исследование ткани, исследование образца опухолевой ткани, исследование ткани опухоли.
Какой биоматериал можно использовать для исследования?
Локализация б/м: образец ткани (биоптат) опухолевого образования стенки матки.
Общая информация об исследовании
Миома матки является самым распространенным доброкачественным новообразованием органов женской репродуктивной системы и выявляется у 25-30 % женщин.
Самая высокая заболеваемость и большинство показаний к оперативному лечению (быстрый рост, большие размеры узла, подозрение на малигнизацию лейомиомы) приходятся на перименопаузальный возрастной период, являющийся наиболее критическим по подобным рискам в жизни женщины. Возникающие болезни адаптации и компенсации, эндокринные, метаболические и иммунологические расстройства предрасполагают к манифестации опухолевых заболеваний.
Существуют определенные трудности в тактике ведения данного контингента больных. Реальный прогресс в решении проблем морфологической диагностики опухолей достигнут с использованием иммуноцистохимических методик. Оценка пролиферативной активности опухоли стала возможной на основании анализа белков ядра, связанных с репликацией ДНК, выявленных при помощи антител к Ki-67. Полученные данные помогают определиться с методикой лечения и объемом оперативного вмешательства по поводу быстро растущей миомы. Прежде всего это касается решения вопроса о сохранении придатков матки.
Большое значение при выборе тактики лечения, прогнозе риска осложнений имеет установление гистологического типа лейомиомы матки. ВОЗ рекомендует выделять обычную, или простую, лейомиому и гистологические варианты лейомиомы (клеточная, митотически активная, эпителиоидная, миксоидная, атипическая лейомиома и липолейомиома и т. д.). В настоящее время описано три основные формы миомы матки: 1) простая лейомиома, развивающаяся по типу доброкачественной очаговой мышечной гиперплазии, 2) митозы отсутствуют вовсе либо 3) единичные. Данная методика позволяет помочь в диагностике и дифференцировании лейомиом.
Иммуногистохимия (ИГХ) – метод выявления точной локализации клеточного или тканевого компонента (антигена) с помощью иммунологических и гистохимических реакций; при этом иммунологический анализ срезов тканей или цитологического материала проводится в условиях сохранения морфологии клеток. В диагностической практике можно выделить несколько основных областей применения ИГХ: во-первых, при исследовании опухолей человека в целях определения гистогенеза недифференцированных опухолевых образований, отдаленных метастазов, для дифференцировки различных тканевых компонентов, составляющих комплексные опухоли; во-вторых, в целях прогностической оценки дальнейшего течения заболевания и, наконец, при назначении терапии.
В целях прогностической оценки заболевания, предсказания биологического поведения опухоли, появления метастазов, эффективности терапии проводят исследование пролиферативной активности (Ki-67), выраженности ангиогенеза, выявление рецепторов к стероидным гормонам, изучение степени анаплазии клеток (мутантный белок гена p53).
Антиген Ki-67 является специфичным и оптимальным для широкого использования в патологоанатомической практике маркером пролиферации. Он впервые описан Gerdes и соавторами в 1983 г., состоит из двух полипептидных цепей с молекулярной массой 345 и 395 кДа. Это основная часть нуклеарного матрикса, в течение интерфазы ассоциированная с хромосомами фазы митоза. Ki-67−димерная молекула, имеющая тесную связь с 10-й хромосомой, конкретная роль этого протеина в процессе клеточного деления до сих пор точно не выяснена. Экспрессия Кi-67 позволяет выделить опухолевые клетки, находящиеся в активной фазе клеточного цикла, на всём его протяжении (G1-, S-, G2- и M-фазы). Кi-67 отсутствует только в G0-периоде. Активно пролиферирующие опухолевые клетки представляют собой «фракцию роста» новообразования. Антиген Ki-67, выявляемый соответствующими моноклональными антителами, представляет собой короткоживущий протеин, он разрушается в течение 1,5-2 часов. Поэтому антитела к Ki-67 выявляют только делящиеся клетки, так как Ki-67 не успевает накапливаться и не остается в покоящихся клетках. Пролиферативная активность является ведущим фактором как в механизме злокачественной трансформации клеток, так и в биологическом поведении уже возникших опухолей. Это наиболее важная характеристика фенотипа опухоли, в значительной степени определяющая скорость роста новообразования, риск метастазирования, потенциальный ответ на лечебные мероприятия и исход онкологического заболевания. Многие факторы, влияющие на течение и исход онкологических заболеваний, свое патогенетическое действие на опухоль опосредуют через изменение пролиферативной активности. Оценка пролиферативной активности опухолевых клеток необходимо не только для определения биологических характеристик опухолей, но и для селективного подхода к выбору терапии.
Индекс пролиферативной активности в различных опухолях имеет разные значения, являясь при этом независимым прогностическим признаком, определяющим клиническое течение и прогноз заболевания. При Ki-67 менее 15 % опухоль считается менее агрессивной, при показателе более 30 % опухоль считается высокоагрессивной. При высоком уровне (выраженном в %) Ki-67 опухоль с более высокой вероятностью ответит на химиотерапевтическое лечение. При низком его уровне опухоль при определённых условиях лучше отреагирует на гормонотерапию. Тест проводится на образце ткани, полученном из опухоли в результате биопсии или оперативным путем.
Дополнительно проводится комплексное определением пролиферативной активности гладкомышечных актинов – сократительных белков, являющихся главными компонентами системы микрофиламентов клетки. Выявлено шесть основных изоформ актина. Антитела к альфа-актину гладких мышц являются надежными маркерами для определения гладкомышечных опухолей. SMA и α-SMA также окрашивают клетки с частичной гладкомышечной дифференцировкой: перициты, миоэпителиальные клетки и миофибробласты. Определение перицитов вокруг сосудистых структур – признак доброкачественного сосудистого процесса, тогда как в большинстве злокачественных сосудистых новообразованиях число перицитарных клеток снижено. Высокая экспрессия гладкомышечного актина отмечается при непролиферативной и умеренной степени пролиферативной формы лейомиомы. В случае пролиферативной формы изменений выраженной степени экспрессия гладкомышечного актина слабее. Маркером, определяющим благоприятное течение заболевания, является высокая экспрессия гладкомышечного актина.
Комплексное гистологическое и иммуногистохимическое исследование с определением пролиферативной активности в растущих лейомиомах по экспрессии KI-67 и гладкомышечного актина представляет ценный современный метод диагностики, позволяющий определить степень пролиферативной активности и анаплазии опухолевых клеток, охарактеризовать прогноз и предложить адекватные методы лечения. Однако не следует и преувеличивать возможности данного метода при лечении конкретного пациента. Данный вид обследования является только дополнительной методикой исследования, и его результаты должны быть интерпретированы в контексте с другими данными обследования, включая клинические.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
При использовании данного метода визуализации антигенов должно получиться интенсивное четко выявляемое окрашивание тканевых антигенов в исследуемом образце и позитивном контроле. Окрашивание негативного контроля также необходимо принимать во внимание при оценке специфичного расположения исследуемых антигенов. Интерпретация полученных результатов ИГХ-реакции включает такие термины, как «выраженная позитивная реакция», «ложно-позитивная реакция», «негативная реакция», «ложно-негативное окрашивание».
Кто назначает исследование?
Особенности экспрессии и прогностическое значение пептидных молекул, связанных с ключевыми свойствами почечно-клеточного рака
1 ФГБОУ ВО «Ростовский государственный медицинский университет» Минздрава России, Ростов-на-Дону; 2 МБУЗ «Городская больница скорой медицинской помощи», Таганрог
В настоящее время почечно-клеточный рак (ПКР) является значимой проблемой урологии. Он составляет 3 % злокачественных новообразований у взрослого населения. Заболеваемость ПКР растет за последние десятилетия в среднем на 3–4 % в год. Возможно, этот рост связан с широким распространением методов прижизненной визуализации почек (УЗИ, компьютерная томография, магнитно-резонансная томография) [1]. Существующие способы оценки прогноза, учитывающие клинические особенности новообразования, его стадию, степень дифференцировки, гистологические особенности, несмотря на высокую прогностическую способность, не могут с достаточной точностью предсказать течение опухолевого процесса у конкретного пациента, так как не учитывают индивидуальные свойства ПКР. Кроме того, затруднена оценка прогноза при разных стадиях новообразования. В связи с этим современный подход к прогнозированию клинического течения ПКР заключается в поиске биологических маркеров, определяющих ключевые свойства опухоли, такие как повышенная пролиферативная активность, резистентность к апоптозу, способность к инвазии и метастазированию, подавление иммунных реакций [2].
Целью нашей работы было оценить особенности экспрессии молекул, связанных с фенотипом раковой стволовой клетки (CD133, N-кадгерин): TGF-α — фактора роста для эпителия канальцев и карбоангидразы IX (CAIX) — одной из ключевых молекул, связанных с VHL-молекулярным путем канцерогенеза при ПКР.
Результаты исследования
1. TGF-α TGF-α — мультифункциональный клеточный регуляторный пептид с широким спектром эффектов, связанных с клеточным ростом и дифференцировкой. В почке он является стимулятором пролиферации эпителия проксимальных канальцев. Эффекты TGF-α реализуются через рецепторы к эпидермальному фактору роста [3, 4].
Экспрессия TGF-α встретилась в 36 наблюдениях (59 %) ПКР. Наиболее часто TGF-α выявляли при светлоклеточном раке (55,9 %) (рис. 1–3), папиллярной форме первого типа (100 %) (рис. 4), реже при хромофобном раке (23,1 %) (рис. 5). Преимущественно экспрессия TGF-α определялась в цитоплазме опухолевых клеток (59 %), реже вдоль клеточных мембран (32,8 %). При анализе возможных взаимосвязей между экспрессией TGF-α и клиническими характеристиками ПКР установлено, что пол, возраст, индекс массы тела пациентов, наличие в анамнезе артериальной гипертензии, симптомность ПКР, наличие лабораторных признаков хронической болезни почек не влияли на экспрессию TGF-α. При анализе экспрессии TGF-α и основных морфологических характеристик ПКР, имеющих прогностическое значение (табл. 1), выявлена связь между наличием в опухоли этого маркера и степенью дифференцировки новообразования (c2 = 6,816; p 2
2. N-кадгерин N-кадгерин — это мембранный белок из надсемейства кадгеринов, участвующий в образовании кальцийзависимых межклеточных контактов. Высокий уровень экспрессии этого кадгерина характерен для мезодермы эмбриона. Исследования последних лет указывают на то, что N-кадгерин может быть маркером эпителиально-мезенхимального перехода, определяющим приобретение опухолевыми клетками агрессивных свойств (инвазия и метастазирование) [5].
Экспрессия N-кадгерина встретилась в 38 наблюдениях рака почки (62,3 %). Достоверно часто N-кадгерин выявляли при светлоклеточном (80 %) (p 0,05
3. CD133 СD133, или проминин-1, — трансмембранный гликопротеин, который экспрессируется в гемопоэтических стволовых клетках [6]. Последние годы экспрессию этого белка используют для выделения пула так называемых раковых стволовых клеток. Гипоксия и активация HIF-1α могут индуцировать пролиферацию CD133+-клеток. Экспрессия CD133+ может быть динамичной и меняться в зависимости от состояния микроокружения клеток [7].
Экспрессия CD133 встретилась в 37 наблюдениях рака почки (60,6 %). Наиболее часто CD133 выявляли при светлоклеточном (80 %) (рис. 8, 9) и папиллярном (рис. 10) вариантах ПКР (69,2 %). При хромофобном раке экспрессия CD133 отсутствовала. Для CD133 характерна преимущественно цитоплазматическая экспрессия (60,6 %), реже — мембранная (44,3 %).
При оценке возможных ассоциаций между экспрессией CD133 и клиническими характеристиками опухоли выявлены взаимосвязи с возрастом пациентов (c2 = 17,467; p 2
4. Карбоангидраза IX Карбоангидраза IX (CA-IX) является HIF-1αрегулируемым трансмембранным белком, связанным с новообразованиями, агрессивным фенотипом опухоли и неблагоприятным прогнозом при светлоклеточном раке почки [8]. Принято считать, что CA-IX помогает в регулировании внутриклеточного и внеклеточного уровней рН в ответ на гипоксию ткани опухоли.
Экспрессия CA-IX выявлена в 35 наблюдениях (57,4 %), преимущественно при светлоклеточном варианте ПКР (97,1 %) (рис. 11, 12), при хромофобном раке в 1 наблюдении отмечено слабое очаговое окрашивание антителами к CA-IX, при папиллярном раке экспрессия отсутствовала. При симптомном ПКР достоверно чаще встречалась экспрессия CA-IX (c2 = 6,213; p 0,05
Обсуждение
Наше исследование продемонстрировало, что экспрессия TGF-α, N-кадгерина, CD133 и CA-IX отличается при разных гистогенетических формах ПКР, что отражает особенности молекулярно-биологических путей, лежащих в основе их развития. Так, экспрессия CA-IX присуща только светлоклеточному варианту ПКР, экспрессия N-кадгерина, CD133 характерна для светлоклеточных опухолей и папиллярного варианта ПКР первого типа и отсутствует при хромофобных раках. Наши результаты согласуются с данными литературы. Так, В. Knebelmann et al. (2009) указали, что экспрессию TGF-α может подавлять белок VHL. Ряд исследователей продемонстрировали повышенную экспрессию TGF-α по сравнению с нормальной тканью при светлоклеточном и папиллярном вариантах почечно-клеточного рака [9, 10]. При этом показано, что этот фактор роста — один из вероятных факторов, индуцирующих развитие рака почки уже на ранних стадиях. При хромофобном варианте рака почки отсутствует экспрессия TGF-α, что, возможно, определяет низкий злокачественный потенциал этой формы новообразований и их слабую васкуляризацию [11]. Экспрессия N-кадгерина при светлоклеточном и папиллярном вариантах почечно-клеточного рака описана в работах J. Markovic-Lipkovski et al. (2001), T. Shimazui et al. (2006), C.L. Behnes et al. (2012) [12–14]. Гистогенетическая связь экспрессии этих маркеров с разными вариантами ПКР может позволить использовать их для морфологической дифференциальной диагностики. Кроме того, выявление этих молекул в биологических жидкостях (кровь, моча) может дать возможность проводить скрининг и мониторинг рака почки у пациентов.
Участие исследованных нами молекул в основных молекулярных путях развития и прогрессии ПКР определяет их прогностическое значение. Так, показана роль N-кадгерина в трансэндотелиальной миграции раковых клеток, что является важным этапом в процессе метастазирования [5]. Повышенная экспрессия этого маркера может ассоциироваться с плохим прогнозом течения рака почки [12, 15, 16].
W.H. Costa et al. (2012) выявили, что около 50 % раков почки экспрессировали CD133. Y. Zhang et al. (2013) обнаружили экспрессию CD133 в 21 % случаев почечно-клеточных опухолей. Ряд исследователей указывают, что высокая экспрессия CD133 может быть благоприятным прогностическим фактором [16–19]. Однако G. Feng et al. (2014) отметили высокий риск рецидивирования и развития метастазов у пациентов с повышенным уровнем матричной РНК гена CD133 в крови [20]. Предполагается, что CD133-позитивные клетки в почечно-клеточном раке поддерживают клеточную популяцию опухоли и служат источником дифференцированных злокачественных клеток [21].
Высокая экспрессия CA-IX связана с благоприятным прогнозом при локализованном и метастатическом ПКР [22]. Было установлено, что уровень экспрессии CA-IX обратно пропорционален риску метастазирования (р = 0,036) и высокая экспрессия CA-IX предполагает лучшую выживаемость даже после учета таких факторов, как Т-стадия, шкала Fuhrman и общее состояние пациента (все р ≤ 0,005) [23]. Низкая экспрессия CA-IX (≤ 85 %) ассоциируется с неблагоприятным исходом у больных с метастатическим ПКР (отношение рисков [OR]: 3,10; р 3.0.co;2-e.
5. Ramis-Conde I, Chaplain MA, Anderson AR, Drasdo D. Multiscale modelling of cancer cell intravasation: the role of cadherins in metastasis. Phys Biol. 2009;6(1):016008. doi: 10.1088/14783975/6/1/016008.
6. Mizrak D, Brittan M, Alison M. CD133: molecule of the moment. J Pathol. 2008;214(1):3-9. doi: 10.1002/path.2283.
7. Li Z. CD133: a stem cell biomarker and beyond. Exp Hematol Oncol. 2013;2(1):17. doi: 10.1186/2162-3619-2-17.
8. Tostain J, Li G, Gentil-Perret A, Gigante M. Carbonic anhydrase 9 in clear cell renal cell carcinoma: a marker for diagnosis, prognosis and treatment. Eur J Cancer. 2010;46(18):3141-3148. doi: 10.1016/j.ejca.2010.07.020.
9. Knebelmann B, Ananth S, Cohen HT, Sukhatme VP. Transforming growth factor alpha is a target for the von Hippel-Lindau tumor suppressor. Cancer Res. 1998;58(2):226-231.
10. Ramp U, Reinecke P, Gabbert HE, Gerharz CD. Differential response to transforming growth factor (TGF)-alpha and fibroblast growth factor (FGF) in human renal cell carcinomas of the clear cell and papillary types. Eur J Cancer. 2000;36(7):932-941. doi: 10.1016/s0959-8049(00)00030-7.
11. Chudek J, Schullerus D, Wilhelm M, Kovacs G. Lack of interleukin 6 (IL-6) and transforming growth factor alpha (TGF-alpha) expression in chromophobe renal cell carcinomas. Br J Cancer. 1998;78(9):1162-1164. doi: 10.1038/bjc.1998.647.
12. Shimazui T, Kojima T, Onozawa M, et al. Expression profile of N-cadherin differs from other classical cadherins as a prognostic marker in renal cell carcinoma. Oncol Rep. 2006;15(5):1181-4. doi: 10.3892/or.15.5.1181.
13. Markovic-Lipkovski J, Brasanac D, Müller GA, Müller CA. Cadherins and integrins in renal cell carcinoma: an immunohistochemical study. Tumori. 2001;87(3):173-178. 14. Behnes CL, Hemmerlein B, Strauss A, et al. N-cadherin is differentially expressed in histological subtypes of papillary renal cell carcinoma. Diagn Pathol. 2012;7:95. doi: 10.1186/17461596-7-95.
15. Zhou N, Lu F, Liu C,etal. IL-8 inducestheepithelial-mesenchymal transition of renal cell carcinoma cells through the activation of AKT signaling. Oncol Lett. 2016;12(3):1915-1920. doi: 10.3892/ ol.2016.4900.
16. Conant JL, Peng Z, Evans MF, et al. Sarcomatoid renal cell carcinoma is an example of epithelial-mesenchymal transition. J Clin Pathol. 2011;64(12):1088-1092. doi: 10.1136/jclinpath-2011-200216.
17. Costa WH, Rocha RM, Cunha IW, et al. CD133 immunohistochemical expression predicts progression and cancer-related death in renal cell carcinoma. World J Urol. 2012;30(4):553-558. doi: 10.1007/s00345-011-0769-x.
18. Cheng B, Yang G, Jiang R, et al. Cancer stem cell markers predict a poor prognosis in renal cell carcinoma: a meta-analysis. Oncotarget. 2016;7(40):65862-65875. doi: 10.18632/oncotarget.11672.
19. Matak D, Szymanski L, Szczylik C, et al. Biology of renal tumour cancer stem cells applied in medicine. Contemporary Oncology. 2015;19(1A): A44-A51. doi: 10.5114/wo.2014.47128.
20. Feng G, Jiang F, Pan C, et al. Quantification of peripheral blood CD133 mRNA in identifying metastasis and in predicting recurrence of patients with clear cell renal cell carcinoma. Urol Oncol. 2014;32(1):44.e9-14. doi: 10.1016/j.urolonc.2013.06.003.
21. Al-Lamki RS, Wang J, Yang J, et al. Tumor necrosis factor receptor 2-signaling in CD133-expressing cells in renal clear cell carcinoma. Oncotarget. 2016;7(17):24111-24124. doi: 10.18632/ oncotarget.8125.
22. Zhang BY, Thompson RH, Lohse CM, et al. Carbonic anhydrase IX (CAIX) is not an independent predictor of outcome in patients with clear cell renal cell carcinoma (ccRCC) after longterm follow-up. BJU Int. 2013;111(7):1046-1053. doi: 10.1111/ bju.12075.
23. Bui MH, Seligson D, Han KR, et al. Carbonic anhydrase IX is an independent predictor of survival in advanced renal clear cell carcinoma: implications for prognosis and therapy. Clin Cancer Res. 2003;9(2):802-11.
24. Phuoc NB, Ehara H, Gotoh T, et al. Prognostic value of the co-expression ofcarbonicanhydraseIX and vascularendothelial growth factor in patients with clear cell renal cell carcinoma. Oncol Rep. 2008;20(3):525-530. doi: 10.3892/or_00000037.
25. Ingels A, Hew M, Algaba F, et al. Vimentin over-expression and carbonic anhydrase IX under-expression are independent predictors of recurrence, specific and overall survival in non-metastatic clear-cell renal carcinoma: a validation study. World J Urol. 2017;35(1):81-87. doi: 10.1007/s00345-016-1854-y
Статья опубликована в журнале «Урологические ведомости». Номер №4/2017 стр. 5-19