Экссудат это в медицине что такое простыми словами
Экссудат
Полезное
Смотреть что такое «Экссудат» в других словарях:
Экссудат — Экссудат[1] мутная, богатая белком и клетками гематогенной и гистогенной природы жидкость, которая пропотевает из мелких кровеносных сосудов в месте воспаления. Содержит белок, лейкоциты, эритроциты, минеральные вещества, клеточные элементы … Википедия
ЭКССУДАТ — (лат. exsudatio, от предл. ех, и sudare потеть). Просачивание, выхождение жидких или сгустившихся веществ в теле через кровеносные сосуды или через поры кожи, подобно поту; выпотение. Словарь иностранных слов, вошедших в состав русского языка.… … Словарь иностранных слов русского языка
ЭКССУДАТ — (от латинского exsudo выпотеваю, выделяю), воспалительный выпот серозная, гнойная, кровянистая или с нитями фибрина жидкость, просачивающаяся из мелких кровеносных сосудов в ткани или полости тела при воспалении (например, при экссудативном… … Современная энциклопедия
ЭКССУДАТ — (от лат. exsudo выпотеваю выделяю), воспалительный выпот серозная, гнойная, кровянистая или фибринозная жидкость, просачивающаяся из мелких кровеносных сосудов в ткани или полости тела при воспалении (напр., при экссудативном плеврите). Ср.… … Большой Энциклопедический словарь
Экссудат — мутная, богатая белком и клетками гематогенной и гистогенной природы жидкость, к рая образуется в месте воспаления. Для острого воспаления характерно преобладание в Э. нейтрофилов, для хронического лимфоцитов и моноцитов, для аллергического… … Словарь микробиологии
экссудат — сущ., кол во синонимов: 1 • выпот (3) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
экссудат — и ЭКСУДАТ а, м. exsudat m. <лат. exsudare выходить наружу. 1. спец. Жидкость, выпотевающая при воспалении из мелких сосудов в ткани или полости тела; выпот. БАС 1. Болезнь моя воспрепятствовавшая своевременному ответу, была припадочная,… … Исторический словарь галлицизмов русского языка
ЭКССУДАТ — англ.exudate нем.Exsudat франц.exsudât см. > … Фитопатологический словарь-справочник
Экссудат — (от латинского exsudo выпотеваю, выделяю), воспалительный выпот серозная, гнойная, кровянистая или с нитями фибрина жидкость, просачивающаяся из мелких кровеносных сосудов в ткани или полости тела при воспалении (например, при экссудативном… … Иллюстрированный энциклопедический словарь
экссудат — а; м. [от лат. exsudare выделять] Мед. Жидкость, просачивающаяся из мелких кровеносных сосудов в ткани или полости тела при воспалении; воспалительный выпот. ◁ Экссудативный, ая, ое. Э. диатез. Э. плеврит. * * * экссудат (от лат. exsudo … … Энциклопедический словарь
экссудат — (exsudatum; экс + лат. sudo, sudatum потеть) богатая белком жидкость, содержащая форменные элементы крови, выходящая из мелких вен и капилляров в окружающие ткани и полости тела при воспалении … Большой медицинский словарь
Экссудат это в медицине что такое простыми словами
Местные отеки могут возникать в результате экссудации или транссудации.
Жидкость невоспалительной природы именуется транссудат, а воспалительной природы – экссудат.
В патогенезе местных отеков (в зоне воспаления, тромбоза, эмболии, сдавления венозных или лимфатических сосудов) ведущая роль отводится изменению соотношения гидродинамического и коллоидно-осмотического давления в артериальном и венозном сегментах капилляров, повышению проницаемости сосудистой стенки и возрастанию гидрофильности тканей.
Этиология и патогенез экссудации
Экссудация – выход жидкой части крови вместе с форменными элементами в зону альтерации при развитии воспалительного процесса.
В зависимости от особенностей этиологического фактора, степени повреждения сосудистой стенки и, соответственно, состава отечной жидкости выделяют следующие виды экссудатов: серозный, фибринозный, гнойный, гнилостный, геморрагический. Экссудат – высокоактивная биологическая жидкость (особенно гнойный, гнилостный и геморрагический), содержащая большое количество лизосомальных ферментов, лизоцима, лактоферрина, фагоцитирующих лейкоцитов, продуктов их жировой дегенерации. Последнее определяет двоякую роль экссудации в организме: с одной стороны, деградирующий эффект на клеточные элементы и межклеточное вещество соединительной ткани, а с другой, – защитная функция в связи с наличием иммуноглобулинов и ряда факторов неспецифической резистентности. Касаясь механизмов развития экссудации следует остановиться на закономерностях развития воспаления.
Как известно, воспаление – типовой патологический процесс, возникающий под влиянием различных патогенных факторов инфекционной и неинфекционной природы и характеризующийся развитием типового комплекса сосудистых и тканевых изменений. Сосудистые изменения проявляются в зоне острого воспаления в виде последовательной смены спазма сосудов, артериальной и венозной гиперемией с развитием престаза и стаза.
Тканевые изменения включают стадии альтерации, экссудации и пролиферации. Следует отметить, что стадия экссудации формируется на фазе венозной гиперемии, когда в зоне воспаления накапливаются чрезмерно-высокие концентрации вазоактивных медиаторов альтерации. Как известно, медиаторы альтерации имеют гуморальное происхождение (активированные фракции компллемента, системы свертывания крови, фибринолиза, калликреин-кининовой системы), а также образуются в клетках различной морфофункциональной организации. Медиаторы клеточного происхождения играют важную роль в повышении проницаемости сосудистой стенки, активации ее тромбогенных эффектов. Среди вазоактивных медиаторов клеточного происхождения следует отметить такие, как нейропептиды, гистамин, серотонин, лейкотриены, простагландины, свободные радикалы, а также ряд провоспалительных цитокинов, лизосомальных ферментов. Важная роль в повышении проницаемости сосудистой стенки отводится развитию метаболического ацидоза. В связи с этим очевидно, что ведущим патогенетическим фактором экссудации является мембраногенный фактор, который характеризуется существенным повышением проницаемости стенок сосудов микроциркуляторного русла для воды, мелко- и крупномолекулярных веществ. Если в норме через стенку капилляров проходят молекулы диаметром менее 5 нм, то при воспалении начинают проходить более крупные частицы. Причины повышения проницаемости сосудистых стенок: ацидоз, активация гидролитических ферментов, перерастяжение стенок сосуда, изменение формы клеток эндотелия. Повышение проницаемости сосудов ( венул и капилляров ) зоне воспаления развивается в результате воздействия медиаторов воспаления и в ряде случаев самого воспалительного агента.
Касаясь молекулярно-клеточных механизмов развития экссудации под влиянием ряда медиаторов альтерации, в частности гистамина, следует отметить, что источником этого биологически активного соединения являются тучные клетки и базофилы крови.
Гистамин. Образуется из аминокислоты гистидина под влиянием фермента гистидиндекарбоксилазы, депонируется в гранулах лаброцитов и базофилов в комплексе с гепарином, ФАТ и другими соединениями. Освобождение гистамина из клеток может возникать в результате физиологического экзоцитоза или при повреждении и распаде клеток. В качестве либераторов гистамина могут выступать бактериальные, вирусные патогенные факторы, разнообразные антигены, С3 и С5 фракции комплемента, катионные белки полиморфноядерных лейкоцитов, химические, физические, термические воздействия, индуцирующие процесс альтерации.
Высвобождение гистамина из клеток – одна из первых реакций ткани на повреждение наряду с интенсификацией выделения сенсорных нейропептидов (субстанция Р, пептид гена, родственный кальцитонину). Эффект этого медиатора на сосудистую стенку в зоне острого воспаления реализуется главным образом через Н1-рецепторы в виде вазодилатации и повышения проницаемости. Кроме того, в очаге острого воспаления гистамин вызывает боль, повышает адгезивные свойства эндотелия сосудов, способствует эмиграции лейкоцитов. Вследствие быстрого разрушения гистамина под влиянием фермента гистаминазы биологические эффекты его на микроциркуляцию кратковременны и в последующем пролонгируются другими медиаторами воспаления.
Из гранул лаброцитов и базофилов освобождаются в зону альтерации хемотаксический фактор эозинофилов (ФХЭ), хемотаксический фактор нейтрофилов (ФХН), фактор активации тромбоцитов (ФАТ), нейтральные протеазы и др.
Другой вазоактивный медиатор воспаления – серотонин представляет собой производное аминокислоты триптофана, значительная часть серотонина депонируется в тромбоцитах. Однако серотонин обнаружен и в других клетках, в частности в нейронах мозга, лаброцитах, базофилах, энтерохромаффинных клетках пищеварительного тракта. Под влиянием различных активаторов – коллагена, тромбина, АДФ, ФАТ – происходит секреция серотонина из тромбоцитов и хромаффинных клеток, одновременно из тучных клеток освобождается гистамин. В умеренных концентрациях серотонин вызывает расширение артериол, сокращение миоцитов в стенках венул и венозный застой. В высоких концентрациях серотонин обусловливает спазм артериол, а в случае их повреждения способствует остановке кровотечения.
Важное значение в развитии воспаления имеют медиаторы воспаления, образуемые полиморфноядерными лейкоцитами. Так, катионные белки, фактор активации тромбоцитов вызывают дегрануляцию тучных клеток и тем самым повышают проницаемость микроциркуляторных сосудов. Способствуют повышению проницаемости также активные метаболиты кислорода (супероксид радикал, синглетный кислород, перекись водорода).
При воспалении в результате повреждения эндотелия сосудов происходит активация фактора Хагемана, который запускает кининогенез и идет превращение прекалликреина в калликреин. Активация калликреина приводит к образованию брадикинина и каллидина. Кинины расширяют кровеносные сосуды и повышают их прницаемость, причем в большей степени, чем гистамин.
Важная роль в повышении проницаемости сосудистой стенки отводится простагландинам и эйкозаноидам.
Механизмы реализации мембраногенного фактора:
1) облегчение фильтрации воды из крови в интерстициальное пространство. Этот механизм может быть сбалансирован повышением реабсорбции воды в посткапиллярах в связи с истончением их стенок;
2) увеличение выхода молекул белка из плазмы крови в межклеточную жидкость ведёт к включению онкотического фактора. Такой механизм лежит в основе развития отёка при воспалении, местных аллергических реакциях, укусах насекомых и змей.
Возрастание проницаемости при воспалении, как правило, является двухфазным и включает немедленную (раннюю) и замедленную (позднюю) фазы.
Первая фаза – ранняя, немедленная, развивается вслед за действием альтерирующего агента и завершается в среднем в течение 15-30 мин. Эта фаза обусловлена в первую очередь действием гистамина, а также лейкотриена Е4, серотонина, брадикинина на венулы диаметром не более чем 100 мкм. Проницаемость капилляров при этом практически не меняется. Повышение проницаемости на территории венул связано с сокращением эндотелиоцитов сосуда, округлением клеток, образованием межэндотелиальных щелей, через которые происходит выход жидкой части крови и клеток.
Вторая фаза – поздняя, замедленная, развивается постепенно, достигает максимума через 4-6 ч, когда происходит фиксация лейкоцитов к эндотелию сосудов и длится иногда до 100 часов в зависимости от вида и интенсивности воспаления. Для этой фазы характерно стойкое увеличение проницаемости сосудов (артериол, капилляров, венул), обусловленное главным образом продуктами, освобождаемыми лейкоцитами – лизосомальными ферментами, активными метаболитами кислорода, простагландинами, комплексом лейкотриенов, водородными ионами. Кроме того при воспалении возможно повышение проницаемости в результате структурных изменений сосудистой стенки, вызванное лизосомальными протеазами, активацией процессов перекисного окисления липидов.
В механизмах развития экссудации, помимо увеличения проницаемости сосудов, определенная роль принадлежит пиноцитозу – процессу активного захватывания и проведения через эндотелиальную стенку мельчайших капелек плазмы крови. В связи с этим экссудацию можно рассматривать как своеобразный микросекреторный процесс, обеспечиваемый активными транспортными механизмами. Активация пиноцитоза в эндотелии микрососудов в очаге воспаления предшествует увеличению проницаемости сосудистой стенки за счет сокращения эндотелиоцитов.
Нарушение проницаемости сосудистой стенки лежит в основе развития отеков в зоне воспаления в случаях развития декомпенсированного метаболического ацидоза, а также неврогенных отеков (при поражениях задних корешков и столбов спинного мозга).
Проницаемость сосудистой стенки может повышаться под влиянием токсических соединений бактериальной природы (токсины дифтерийный, сибиреязвенный и др.), при действии экзогенных химических веществ (хлор, фосген и др.), при действии некоторых ядов различных насекомых и пресмыкающихся (комары, пчелы, шершни, осы, змеи и др.). Под влиянием воздействия этих агентов, помимо повышения проницаемости сосудистой стенки, происходит нарушение тканевого обмена и образование продуктов, усиливающих набухание коллоидов и повышающих осмотическую концентрацию тканевой жидкости. Возникающие при этом отеки называются токсическими.
Таким образом, одним из ведущих патогенетических факторов развития местного отека является мембраногенный фактор, связанный с повышением проницаемости сосудистой стенки.
Как отмечено ранее, механизмами реализации мембранногенного фактора развития отека являются облегчение фильтрации жидкости в микрососудах, избыточный транспорт белков, ионов из микрососудов в интерстициальную жидкость. Осмотическому и онкотическому факторам принадлежит большое значение в развитии воспалительного отека.
Гиперосмия тканей в очаге воспаления обусловлена повышением в них концентрации осмоактивных частиц – ионов, солей, органических соединений с низкой молекулярной массой. К факторам, вызывающим гиперосмию, относятся усиленная диссоциация солей вследствие ацидоза тканей (лактатный ацидоз типа А), выход из клеток калия и сопутствующих ему макромолекулярных анионов, повышенный распад сложных органических соединений на менее сложные, мелкодисперсные, а также сдавление и тромбоз лимфатических сосудов, препятствующие выведению осмолей из очага воспаления.
Одновременно с увеличением осмотического давления наблюдается увеличение и онкотического давления в тканях очага воспаления, в то время как в крови онкотическое давление снижается. Последнее обусловлено выходом из сосудов в ткани, в первую очередь, мелкодисперсных белков – альбуминов, а по мере повышения проницаемости сосуда – глобулинов и фибриногена. Кроме этого, в самой ткани под влиянием лизосомальных протеаз происходит распад сложных белковых макромолекул на более мелкие, что также способствует повышению онкотического давления в тканях очага воспаления. Это вызывает снижение эффективной онкотической всасывающей силы плазмы крови.
Возрастание гидростатического давления в фазу венозной гиперемии имеет место в связи с развитием тромбоза, эмболии, престаза, приводящих к нарушению оттока венозной крови. В то же время экссудат при воспалении вызывает сдавление венозных и лимфатических сосудов и усугубляет нарушение оттока крови. При этом площадь и интенсивность пропотевания плазмы крови на территории сосудов микроциркуляторного русла увеличивается.
Таким образом, при возрастании гидростатического давления в сосудах микроциркуляторного русла (при воспалении, тромбозах, эмболии, беременности и др.) возникают условия для развития отеков.
В развитии местного отека также играет роль снижение внутрисосудистого коллоидно-осмотического давления за счет локальной гипопротеинемии связанной с повышением проницаемости сосудистой стенки в зоне альтерации.
Гиперонкия, гиперосмия тканей в зоне альтерации, повышение их гидрофильности в связи с плазмопотерей в зону альтерации в комплексе с белками, а также развитием цитолиза, выходом внутриклеточных электролитов и белков также способствует развитию отека. Происходит уменьшение резорбции жидкости из интерстиция в посткапиллярах и венулах.
Впервые экспериментальные доказательства значения онкотического фактора в развитии отеков были получены Э.Старлингом (1896).
В ряде случаев в развитии местных отеков лежит нарушение лимфодинамики. Лимфогенный (лимфатический) фактор развития местного отека характеризуется затруднением оттока лимфы от тканей вследствие либо механического препятствия, либо избыточного образования лимфы. Причинами включения лимфогенного фактора являются:
1) врождённая гипоплазия лимфатических сосудов и узлов;
2) сдавление лимфатических сосудов (например, опухолью, рубцом);
3) эмболия лимфатических сосудов (например, клетками опухоли, паразитами);
4) опухоль лимфоузла, а также метастазы в лимфоузел опухолей других органов;
5) значительное увеличение образования лимфы в тканях, приводящее к перегрузке лимфатических сосудов и замедлению оттока от тканей.
В зависимости от особенностей этиологического фактора, степени повреждения сосудистой стенки и, соответственно, состава отечной жидкости выделяют следующие виды экссудатов: серозный, фибринозный, гнойный, гнилостный, геморрагический.
Механизмы развития, характеристика транссудации
Транссудация – выход жидкости из сосудистого русла в неповрежденную ткань; имеет место в условиях нормы, обеспечивает обмен между кровью и тканями электролитами, трофическими субстанциями, газообразными соединениями, продуктами метаболизма.
В связи с тем, что транссудация жидкости в ткани в условиях нормы и при ряде форм патологии происходит через неповрежденную сосудистую стенку или на фоне незначительного возрастания ее проницаемости, транссудат по химическому составу и биологической активности значительно отличается от экссудата. Так, удельная плотность транссудата ниже, чем экссудата. Это обусловлено высоким содержанием белка и форменных элементов в экссудате. Транссудат содержит белка менее 30 г/л, и общее количество клеток в нем, как правило, не превышает 100, в то время как в экссудате содержание белка превышает 30 г/л, а клеточных элементов более 3000. Экссудат содержит значительное количество иммуноглобулинов, факторов свертывания крови, лейкоцитов, эритроцитов, медиаторов воспаления, в связи с чем является биологически активной жидкостью, обеспечивающей одномоментное развитие как защитно-приспособительных реакций в зоне воспаления, так и дезорганизации, деградации структур клеток и межклеточного вещества.
Резюмируя вышеизложенное, следует заключить доминирующую роль мембраногенного фактора в инициации местных отеков воспалительного генеза с последующим присоединением онкотического фактора и возрастанием гидродинамического давления в зоне тромбоза и эмболии сосудов при венозной гиперемии.
Активация процессов транссудации в нормальную по структуре и функции не поврежденную ткань связана с инициирующим воздействием возрастания гидростатического давления в сосудах микроциркуляторного русла и увеличением площади трассудации, нарушением обратного траспорта тканевой жидкости в систему микроциркуляции.
Чрезмерная транссудация лежит в основе ряда местных и системных нарушений распределения внутри- и внесосудистой внутриклеточной и внеклеточной жидкости.
Таким образом, при возрастании гидростатического давления в сосудах микроциркуляторного русла (при тромбозах, эмболии, беременности) возникают усиление транссудации, развитие застойных отеков.
Экссудат это в медицине что такое простыми словами
Одной из самых актуальных проблем в хирургии является перитонит [1]. Актуальность определяется тремя основными факторами: широчайшей распространенностью заболевания, высокой летальностью, наличием сложных и многочисленных нарушений гомеостаза [2]. Применение современных методик (антибиотики широкого спектра действия, иммуномодуляторы нового поколения, экстракорпоральные методы детоксикации и т.д.) не дает существенного снижения летальности [2, 3]. В настоящее время, несмотря на развитие современной фармакологической индустрии, ощущается недостаток в выборе эффективного антибактериального средства в борьбе с перитонитом [4, 5]. Таким образом, все вышеперечисленные аргументы указывают на то, что методы санации брюшной полости нуждаются в доработке. Топическое использование противомикробных средств, депонированных в полимерных имплантах, улучшает результаты лечения, так как в этом случае антибактериальное средство действует локально, в зоне развития микробного воспаления, а также уменьшает вероятность перитонеальной адгезии и последующего спаечного процесса. Цитологическое исследование является одним из важнейших преимуществ сравнения и динамического изучения эффекта применения новых методов лечения воспалительных заболеваний.
Целью работы явилось изучение в сравнительном аспекте цитологической картины, формирующейся в брюшной полости, в процессе экспериментальной апробации образцов полимерных пленчатых имплантов в инфицированных условиях, а также выявление их влияния на течение острого воспалительного процесса.
Материалы и методы исследования
В качестве материала для экспериментальных исследований был использован антибиотик Цефтриаксон и образец полимерных мембран, разработанный ООО «Линтекс» (г. Санкт-Петербург): 76 MHR. В ранее проведенных исследованиях этот образец показал высокую степень адгезии (позволяет фиксировать его бесшовным способом); адекватные сроки деградации (от 7 дней, чего вполне достаточно, чтобы достичь необходимого эффекта); полное рассасывание (исключает необходимость повторных оперативных вмешательств для его извлечения) [6, 7]. Цефтриаксон был выбран в связи с его широким спектром антимикробной активности, наилучшими фармакокинетическими показателями, он обладает стабильностью по отношению к β-лактамазам и высокой проницаемостью через стенку грамотрицательных микроорганизмов [8, 9]. Данный антибиотик был взят в минимальной подавляющей концентрации в тканях – МПК (0,008 мг/мл), так как эта концентрация обладает одновременно бактерицидным действием и лимфостимулирующим [10, 11]. Опыты проводились в соответствии с конвенцией «О защите позвоночных животных, используемых для экспериментов или в иных целях», принятой Советом Европы (г. Страсбург, Франция 1986 г.), и директивой Совета 86/609/EEC от 24.11.86 г., по согласованию законов, правил и административных распоряжений стран-участниц в отношении защиты животных, используемых в экспериментальных и других научных целях. Эксперимент был выполнен на лабораторных крысах-самцах, линии Вистар, массой 250–300 г. Перед введением в эксперимент все животные находились на двухнедельном карантине в экспериментально-биологической клинике (виварии) Курского государственного медицинского университета.
Для моделирования инфицированных условий путем передозировки наркоза умерщвлялось одно животное. Из содержимого слепой кишки этого животного готовилась 10 % взвесь фекалий в изотоническом (0,9 %) водном растворе хлорида натрия. Полученная смесь после однократной фильтрации через четыре слоя марли вводилась интактным животным под наркозом пункционным способом из одного вкола (в центре белой линии живота) в правую и левую подвздошные области из расчета 0,5 миллилитров на 100 граммов массы животных не позднее чем через 20 минут после приготовления (для максимального сокращения потери анаэробной микрофлоры) [12]. Экспериментальных животных (39 крыс) делили на 3 группы. Первой группе (15 крыс) через 12 часов после моделирования инфицированных условий выполняли переднюю срединную лапаротомию, двукратное промывание брюшной полости 0,02 % раствором фурацилина, после чего туда помещали 2 антибактериальные мембраны размером 1х2 см. Для обеспечения длительного бактерицидного действия Цефтриаксона в очаге инфекции, перед использованием мембраны находились в растворе антибиотика (0,008 мг/л) 20 минут. Второй группе (12 крыс) было выполнено только промывание брюшной полости фурацилином. Третьей группе (12 крыс) после моделирования инфицированных условий лечение не производилось. Для оценки цитологической картины проводился микроскопический анализ экссудата, взятого из брюшной полости через 12 часов после моделирования, а также на 7 и 14 сутки, окрашенный по Романовскому – Гимзе. Оценивалось количество макрофагов, нейтрофилов и лимфоцитов, в связи с тем, что соотношения этих трёх групп клеток и даёт представление о характере и интенсивности течения воспалительного процесса. Статистическая обработка результатов проводилась путем вычисления среднего значения, стандартного отклонения, доверительного интервала. Методом доверительного интервала сравнивалась группа № 1 с группами № 2 и № 3. Все расчеты выполнялись с помощью аналитического пакета приложения Microsorft Excel Office 2010, лицензией на право использования которой обладает ФГБОУ ВО КГМУ Минздрава России.
Результаты исследования и их обсуждение
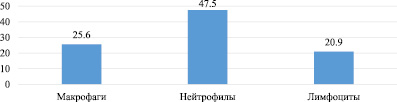
В ходе данного исследования, направленного на изучение антимикробных свойств полимерных пленчатых имплантатов, получены следующие результаты, представленные ниже. Клинически через 12 часов после моделирования – крысы малоподвижны, заторможены, группируются в углу клетки, выглядят вялыми, апатичны к еде, отмечается частое поверхностное дыхание, сухость кожи и взъерошенность шерсти. Цитологические данные (рис. 1) приведены для подтверждения результатов моделирования.
Рис. 1. Число клеток в поле зрения цитологического мазка экссудата брюшной полости через 12 часов после моделирования инфицированных условий
При микроскопии было обнаружено, что клеточный состав экссудата, взятого через 12 часов после моделирования инфицированных условий, представлен в основном лимфоцитами, макрофагами и нейтрофилами. Среди них значительно преобладала одна фракция – нейтрофилы. Это свидетельствует о течении острого инфекционного процесса в брюшной полости, т.е. использованная методика позволяет в эксперименте воспроизводить перитонит, близкий к таковому в клинике. Показатели летальности, приведенные ниже (табл. 1), указывают на улучшение результатов лечения у животных после операции с применением антибактериальных полимерных имплантов.
Показатели летальности животных в течение исследования