Электролизная вода что это
Электролиз воды — получение водорода и очистка воды
Электролиз воды – это хорошо известный, для всех кто дружит с техникой, процесс электролиза, у которого в качестве электролита используется вода.
Впрочем, необходимо отметить, что при электролизе в той или иной толике вода присутствует всегда. Вначале рассмотрим, что же представляет из себя процесс электролиза в общем.
Электролиз — что это …
Электролиз – это электрохимический процесс, который осуществляется через размещение в электролите двух электродов и подключении к ним постоянного тока. Электролитами называются жидкие проводники, которые относятся к проводникам второго типа. Под жидкими проводниками понимаются жидкости / растворы обладающие электропроводностью.
Для справки добавим, что сосуды, в которые наливаются электролиты, называются гальваническими ваннами.
В ходе процесса электролиза, ионы, под воздействием электромагнитного поля, образуемого в электролите постоянным электрическим током, начинают движение к электродам. Ионы с положительным зарядом, в соответствии с законами физики, двигаются к электроду с отрицательным зарядом, который называется КАТОДОМ, а отрицательно заряженные ионы соответственно перемещаются к другому электроду, называемому АНОДОМ. Электролиз сопровождается выделением на электродах веществ, что указывает на движение в электролитах атомов. Например, как правило, металлы и водород выделяются на КАТОДЕ.
На прохождение процесса электролиза влияет несколько факторов:
Электролиз воды
Электролиз воды — это электролиз, у которого в качестве электролита используется вода.
Как правило, при электролизе воды, для лучшего прохождения процесса, в воду добавляют немного какого либо вещества, например пищевой соды, но не обязательно, поскольку обычная вода практически всегда уже содержит примеси.
В результате электролиза воды выделяются водород и кислород. Кислород будет выделяться на АНОДЕ, а водород на КАТОДЕ.
Электролиз воды — применение технологии
Технология электролиза воды наиболее часто применяется в таких случаях.
Заключение
Как мы видим, электролиз воды, несмотря на кажущуюся свою простоту, применяется в весьма важных областях — в областях от которых зависит развитие и процветание всей нашей цивилизации.
Процедура электролиза воды, методики, для чего она, домашний эксперимент
электролиз воды это разложение воды на ее элементарные составляющие под действием электрического тока. При этом водород и молекулярный кислород образуются на двух инертных поверхностях, H2 и O2. Эти две поверхности более известны под названием электродов.
Теоретически, объем Н2 образуется должен быть в два раза больше объема O2. Почему? Поскольку молекула воды имеет отношение H / O, равное 2, то есть два H для каждого кислорода. Это соотношение проверяется непосредственно с помощью его химической формулы H2О. Однако многие экспериментальные факторы влияют на полученные объемы.
Если электролиз проводят внутри труб, погруженных в воду (верхнее изображение), столб воды меньшей высоты соответствует водороду, поскольку на поверхности жидкости присутствует большее количество газа, оказывающего давление. Пузырьки окружают электроды и в конечном итоге поднимаются после истечения давления пара воды.
Обратите внимание, что трубки отделены друг от друга таким образом, что существует низкая миграция газов от одного электрода к другому. В низких масштабах это не представляет неизбежного риска; но в промышленных масштабах газовая смесь Н2 и O2 Это очень опасно и взрывоопасно.
По этой причине электрохимические ячейки, в которых проводится электролиз воды, очень дороги; им нужны конструкция и элементы, которые гарантируют, что газы никогда не смешиваются, выгодная подача тока, высокая концентрация электролитов, специальные электроды (электрокатализаторы) и механизмы для хранения H.2 произведенный.
Электрокатализаторы представляют собой трение и в то же время крылья для прибыльности электролиза воды. Некоторые состоят из оксидов благородных металлов, таких как платина и иридий, цены на которые очень высоки. Именно в этот момент исследователи объединяют усилия для разработки эффективных, стабильных и дешевых электродов..
Причиной этих усилий является ускорение образования О2, который дается на более низких скоростях по сравнению с H2. Это замедляется электродом, где образуется О2 как общее следствие, применение потенциала намного больше, чем необходимо (перенапряжение); что то же самое, чтобы снизить производительность и более высокие расходы.
Реакция электролиза
Электролиз воды включает в себя много сложных аспектов. Однако в общих чертах его основа лежит в простой глобальной реакции:
Полуклеточные реакции
Вышеизложенное можно обобщить следующими химическими уравнениями для полуклеточных реакций:
Реакции полуэлемента изменяются в зависимости от значений рН, методов, а также имеют потенциальные потенциалы восстановления или окисления, которые определяют, какой ток необходимо подавать, чтобы электролитический процесс воды происходил самопроизвольно..
процесс
Два электрода обычно платиновые, хотя на изображении они были заменены угольными электродами. Оба связаны с батареей, с которой применена разность потенциалов (ΔV), которая способствует окислению воды (образование O).2).
В верхней части цилиндров есть несколько клавиш, позволяющих выпускать образующиеся газы. Вы можете тщательно проверить наличие H2 заставляя его реагировать с пламенем, сгорание которого дает газообразную воду.
методы
Методы электролиза воды варьируются в зависимости от количества Н2 и O2 что предлагается генерировать. Оба газа очень опасны, если их смешивать друг с другом, и поэтому электролизеры имеют сложную конструкцию, чтобы минимизировать увеличение газовых давлений и их диффузию через водную среду..
Кроме того, методы колеблются в зависимости от элемента, электролита, добавляемого в воду, и самих электродов. С другой стороны, некоторые подразумевают, что реакция проводится при более высоких температурах, уменьшая потребление электроэнергии, а другие используют огромные давления для поддержания H.2 хранится.
Среди всех методов можно упомянуть следующие три:
Электролиз щелочной водой
Электролиз проводят с основными растворами щелочных металлов (КОН или NaOH). С помощью этой техники происходят реакции:
Электролиз с полимерной электролитической мембраной
Полуклеточные реакции для этого случая:
Ионы Н + они мигрируют от анода к катоду, где они уменьшаются, чтобы стать H2.
Электролиз с твердыми оксидами
Какая польза от электролиза воды?
Электролиз воды дает H2 (г) и О2 (G). Приблизительно 5% газообразного водорода, производимого в мире, образуется в результате электролиза воды..
H2 это побочный продукт электролиза водных растворов NaCl. Присутствие соли облегчает электролиз за счет увеличения электропроводности воды.
Глобальная реакция, которая имеет место:
Чтобы понять огромную важность этой реакции, будут упомянуты некоторые виды использования газообразных продуктов; потому что, в конце концов, именно они стимулируют разработку новых методов для достижения электролиза воды более эффективным и экологичным способом..
Из всех них наиболее желательным является использование ячеек, которые энергетически заменяют использование сжигания ископаемого топлива..
Производство водорода и его использование
-Водород, получаемый при электролизе, может быть использован в химической промышленности, действующей в реакциях зависимости, в процессах гидрирования или в качестве восстановителя в процессах восстановления..
-Кроме того, это важно в некоторых действиях, имеющих коммерческое значение, таких как: производство соляной кислоты, перекиси водорода, гидроксиламинов и т. Д. Участвует в синтезе аммиака по каталитической реакции с азотом.
-В сочетании с кислородом он производит пламя с высокой калорийностью, с температурами в диапазоне от 3000 до 3500 К. Эти температуры могут использоваться для резки и сварных швов в металлургической промышленности, для роста синтетических кристаллов, производства кварца и т. Д..
-Обработка воды: слишком высокое содержание нитратов в воде может быть уменьшено путем их удаления в биореакторах, в которых бактерии используют водород в качестве источника энергии
-Водород вмешивается в синтез пластмасс, полиэстера и нейлона. Кроме того, он является частью производства стекла, увеличивая сгорание во время выпекания.
-Реагирует с оксидами и хлоридом многих металлов, в том числе серебра, меди, свинца, висмута и ртути с образованием чистых металлов.
-И, кроме того, он используется в качестве топлива в хроматографических анализах с детектором пламени..
Как метод отладки
Электролиз растворов хлорида натрия используется для очистки воды бассейна. Во время электролиза водород образуется в катоде и хлоре (Cl2) на аноде. Говорят об электролизе в этом случае как хлоратор соли.
Хлор растворяется в воде с образованием хлорноватистой кислоты и гипохлорита натрия. Хлорноватистую кислоту и гипохлорит натрия стерилизуют водой.
В качестве источника кислорода
Электролиз воды также используется для генерации кислорода на Международной космической станции, которая служит для поддержания кислородной атмосферы на станции..
Водород можно использовать в топливном элементе, способе накопления энергии и использовать воду, которая генерируется в элементе для потребления астронавтами..
Домашний эксперимент
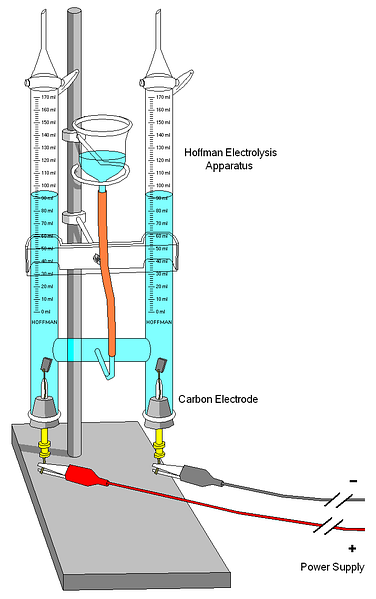
Эксперименты по электролизу воды проводились на лабораторных весах с помощью вольтметров Хоффмана или другой сборки, которая позволяет вместить все необходимые элементы электрохимической ячейки..
Из всех возможных сборок и оборудования самым простым может быть большой прозрачный контейнер для воды, который будет служить ячейкой. Кроме того, вы должны иметь под рукой любую металлическую или электропроводящую поверхность, которая будет выполнять функцию электродов; один для катода, а другой для анода.
Для этой цели могут быть полезны даже карандаши с острыми точками на обоих концах. И, наконец, небольшой аккумулятор и несколько кабелей, которые соединяют его с импровизированными электродами..
Если не сделать в прозрачном контейнере, образование пузырьков газа не может быть оценено.
Домашние переменные
Хотя электролиз воды является предметом, который содержит много интригующих и обнадеживающих аспектов для тех, кто ищет альтернативные источники энергии, домашний эксперимент может быть скучным для детей и других зрителей..
Следовательно, достаточное напряжение может быть приложено для формирования H-образования2 и O2 чередуя определенные переменные и отмечая изменения.
Кроме того, тот же эксперимент можно повторить с холодной и горячей водой. Таким образом, влияние температуры на реакцию будет затем рассматриваться.
Наконец, чтобы сделать сбор данных немного менее бесцветным, вы можете прибегнуть к очень разбавленному раствору сока фиолетовой капусты. Этот сок является основным кислотным индикатором природного происхождения..
Добавляя его в емкость с введенными электродами, можно заметить, что на аноде вода станет розовой (кислотной), а на катоде окраска будет желтой (основной).
Разделяй и властвуй: совершенствование электролиза воды
Одной из самых известных химических формул, которые нам известны еще со школьной скамьи, является H2O — оксид водорода, т.е вода. Без этого простого на первый взгляд вещества жизнь на нашей планете была бы совершенно иной, если вообще была бы. Помимо своих животворящих функций у воды имеется масса других применений, среди которых стоит выделить получение водорода (H). Одним из методов достижения этого является электролиз воды, когда ее разделяют на составляющие, т.е. на кислород и водород. Это достаточно сложный, затратный, но эффективный метод. Тем не менее, нет в мире такого, что ученые не хотели бы улучшить. Команда исследователей из университета штата Вашингтон и Лос-Аламосской национальной лаборатории нашли способ усовершенствовать электролиз воды, значительно снизив себестоимость его проведения без снижения результата. Какие изменения пришлось внедрить в электролиз воды, почему были использованы те или иные вещества, и какие результаты показывает обновленный метод добычи водорода? Об этом нам поведает доклад ученых. Поехали.
Основа исследования
Водород во многом уникальный элемент: он самый легкий среди элементов периодической таблицы, а его одноатомный вариант является самым распространенным веществом во Вселенной. Кроме того водород крайне дружелюбный элемент, с легкостью формирующий ковалентные связи с большинством неметаллов. В природе мы встречаем водород чаще в составе какого-то вещества, в том числе и в воде, нежели, так сказать, в одиночку.
При обычных условиях водород представляет собой газ без запаха и вкуса с химической формулой Н2. У него есть и жидкий эквивалент — жидкий водород, который хоть и не так популярен в массовой культуре, как жидкий азот, но не менее экстремален в аспекте температур: точка замерзания −259.14 °C; точка кипения −252.87 °C.
Для перечислений всех конкретных применений водорода понадобится немало времени, так как он принимает активное участие в самых разных сферах производства: пищевая промышленность, металлургия, производство электроники, производство аммиака и т.д. Не говоря уже об использовании водорода в качестве ракетного топлива.
Методов получения водорода также существует несколько: из природного газа, из угля и посредством электролиза воды. В год в мире по примерной оценке используется порядка 70 миллионов тонн, из которых лишь 100 000 тонн производится методом электролиза.
Такая методологическая «дискриминация» обусловлена сложностью и ценой электролиза в совокупности с получаемыми объемами водорода по сравнению с другими методами. Однако всегда есть возможность для совершенствования, о чем и пойдет речь далее, но обо всем по порядку.
Движущей силой электролиза воды для ее расщепления на кислород и водород является электричество. По словам ученых, низкотемпературный электролиз воды представляет особый интерес для сферы возобновляемой энергетики, так как этот метод может позволить хранить электроэнергию из возобновляемых источников в химических связях в форме водорода высокой чистоты.
При низкотемпературном электролизе воды в качестве электролита (проводящее ток вещество) используется концентрированный раствор KOH (гидроксид калия), протонообменная мембрана (PEM от proton-exchange membrane) или щелочная анионообменная мембрана (AEM от alkaline anion exchange membrane).
Основное преимущество AEM электролиза над другими вариантами заключается в его стоимости. То есть для его реализации нет необходимости использовать металлы платиновой группы (PGM от platinum-group metals) в качестве катализаторов. Однако всегда есть подвох, заключающийся в данном случае в нестабильности щелочного метода, ввиду чувствительности к перепадам давления и низкой скорости производства водорода.
В традиционных щелочных электролизерах (установка для электролиза) жидкий щелочной электролит (30–40 мас.% КОН) циркулирует через электроды, которые разделены пористой мембраной (1а).

Изображение №1: схема низкотемпературного электролиза воды.
2.0 В), чем у щелочных электролизеров, поскольку протонообменная мембрана имеет более высокую проводимость. (1b).
Использование твердых электролитов в PEM электролизе воды позволяет создать компактную систему с долговечными и устойчивыми структурными свойствами при высоких перепадах давления (200–400 psi). Но даже в этом методе есть свои недостатки, в частности высокая стоимость установки для электролиза, ввиду дорогостоящего кислотостойкого оборудования и необходимости в металлах платиновой группы.
В AEM электролизе за последние несколько лет произошло несколько изменений. Одним из самых важных является создание полимерных AEM (1с). Щелочной AEM-электролиз сочетает в себе многие преимущества других методов: возможность использовать катализаторы без PGM; возможность применять чистую воду или низкоконцентрированный щелочной раствор вместо концентрированных щелочных электролитов; низкие омические потери из-за высокой проводимости и тонких AEM. В дополнение к этому мембранная конструкция установки позволяет ей работать при значительных перепадах давления, а также снижает ее габариты и вес. Не говоря уже о снижении стоимости данного устройства.
В своем исследовании ученые решили попытаться избавиться от некоторых недостатков данного метода, тем самым сделав его более привлекательным для массового производства водорода. Исследователи выяснили, что высокая концентрация четвертичных аммониевых соединений необходима для повышения активности реакций выделения водорода и кислорода в AEM электролизере. Также было установлено, что фенильные группы в основной цепи иономера* имеют негативный эффект, образуя кислые фенолы при высоких анодных потенциалах.
Иономер* — полимеры, состоящие из электрически нейтральных и ионизированных составных звеньев, ковалентно связанных с основной цепью полимера в виде боковых групп атомов.
Кватернизаця* — преобразование соединений элементов 15-ой группы (N, P, As, Sb), атомы которых имеют свободную электронную пару, в четвертичные соли при взаимодействии с реагентами типа RX (Х — анионоидная группа).
Результаты исследования
Прежде чем понять, на что способен усовершенствованный AEM электролизер, необходимо было установить, чего он не может, т.е выяснить факторы, ограничивающие его производительность. Для этого были проведены эксперименты с вращающимся дисковым электродом (RDE от rotating disk electrode). RDE эксперименты предоставляют информацию о различных требованиях к электролитам, используемым в топливных элементах и электролизерах, путем измерения реакции выделения кислорода (OER), реакции выделения водорода (HER), реакции восстановления кислорода (ORR) и реакции окисления водорода (HOR).

Изображение №2: влияние концентрации NaOH (гидроксид натрия) на активность электрокатализаторов.
На графиках выше показаны поляризационные кривые OER с использованием IrO2 и HER с использованием поликристаллического платинового электрода (Pt poly) в зависимости от концентрации NaOH. Активность OER и HER для AEM электролизера значительно увеличивалась при увеличении концентрации NaOH с 0.01 М (рН = 12) до 1 М (рН = 14). HOR активность Pt poly проявляет максимальную активность при концентрации NaOH в 0.02 М (вставка на 2b). Потеря активности HOR при более высокой концентрации NaOH (> 0.1 М) также сопровождалась более низкой плотностью тока, ограничивающей диффузию.
Более низкая HOR активность Pt poly с концентрированным раствором NaOH объясняется кумулятивной совместной адсорбцией катион-гидроксид-вода, что ограничивает доступ водорода к поверхности катализатора. Однако совместная адсорбция не влияет на активность HER и OER, поскольку адсорбция происходит от 0 до 0.9 В. Влияние концентрации NaOH на активность ORR Pt poly показало тенденцию, аналогичную HOR.
ORR-активность Pt поли увеличивалась при увеличении концентрации NaOH с 0,01 до 0.1 М, затем начинала уменьшаться при дальнейшем увеличении концентрации NaOH до 1 М.
Результаты экспериментов предполагают, что концентрация гидроксида аммония, необходимая для AEM электролизеров и AEM топливных элементов, может быть различной. Для AEM электролизеров предпочтительнее иономер с более высокой ионообменной емкостью (IEC от ionexchange capacity). Для AEM топливных элементов лучше подойдет иономер со средним IEC, так как иономеры с более высоким IEC вызывают ограниченный перенос газа из-за нежелательной совместной адсорбции катион-гидроксид-вода.
Далее ученые решили выяснить, каким должен быть иономер для AEM электролизеров. Эксперименты с RDE показали, что обеспечение условий с высоким pH (> 13) в электродах имеет важное значение для создания высокоэффективных AEM электролизеров.
На данный момент доступные анионообменные иономеры имеют две критические проблемы, которые могут ограничивать среду с высоким pH в AEM электролизерах.
Первая проблема заключается в наличии фенильных групп в основной цепи иономера. Ранее проведенное исследование показало, что фенильная группа в основной цепи иономера может окисляться при OER потенциалах и образовывать фенольное соединение, которое является кислым (pKa = 9.6). К сожалению, большинство стабильных щелочных иономеров содержат фенильные группы в своей структуре.
Следовательно, AEM электролизеры, использующие иономеры, содержащие фенильную группу, так или иначе подвержены образованию фенола.
В аспекте окисления фенильной группы было обнаружено несколько крайне важных особенностей. Скорость образования фенола связана с энергией адсорбции фенильной группы на поверхности OER катализаторов, а незамещенные фенильные группы в боковой цепи полимера оказывают более вредное воздействие по сравнению с замещенной аммонием фенильной группой.
Структура и размер фрагментов основной цепи в полиароматических соединениях сильно влияют на адсорбцию фенила, тогда как функционализированная боковой цепью фенильная группа демонстрирует гораздо более низкую энергию адсорбции из-за конкурирующей адсорбции с аммониевыми группами. Кроме того, биметаллические платиновые катализаторы (например, PtRu, PtNi и PtMo) могут эффективно снижать энергию адсорбции фенила.
0.1 М). Неоднородное распределение иономера в электроде дополнительно снижает эффективность реакции и проводимость гидроксида. Следовательно, иономеры с более высоким IEC должны быть полезны для повышения производительности AEM электролизера.
Однако одно тянет за собой другое, так как для синтеза иономера с высоким IEC необходимо учитывать несколько критериев.
Во-первых, существует ограничение на максимальное количество аммониевых групп на полимерное составное звено (группа атомов, составляющих полимер).
Во-вторых, анионообменные иономеры с высоким IEC часто подвергаются реакции сшивания во время процесса функционализации, что затрудняет дальнейшую обработку.
И, в-третьих, когда анионообменные иономеры синтезируются с высоким IEC, они часто становятся растворимыми в воде, что непригодно для применения в электродах.
Как ни крути, а обойти все эти ограничения будет не так и просто. Тем не менее, взяв за основу вышеописанные данные, ученые подготовили несколько функционализированных триметиламмонием полистирольных иономеров (3а).

Изображение №3: химическая структура полимерных материалов, использованных в исследовании.
Созданные иономеры обладали достаточно уникальными характеристиками по сравнению с обычными иономерными связующими, разработанными для AEM топливных элементов.
Во-первых, основная алифатическая полимерная цепь не содержит фенильной группы. Отсутствие фенильной группы в основной цепи полимера исключает возможность адсорбции фенила и образования кислого фенола.
Во-вторых, основная цепь полимера не содержит длинных неионных алкильных цепей, которые могут снизить растворимость полимера.
В-третьих, все фенильные группы в боковых цепях имеют замещенные аммониевые или аминные группы, которые минимизируют адсорбцию фенильных групп и помогают поддерживать высокий рН.
По завершению синтеза иономеров было обнаружено, что их IEC варьируется в диапазоне от 2.2 до 3.3. Для AEM был подготовлен HTMA-DAPP, т.е. полифенилен Дильса-Альдера, функционализированный гексаметилтриметиламмонием (3b). Гидроксидная проводимость HTMA-DAPP составляла 120 мСм/см при 80 °C (мСм — миллисименс; сименс — единица измерения электрической проводимости).
Основная цепь полифенилена в высокомолекулярном полимере HTMA-DAPP обеспечивает превосходную механическую прочность (растягивающее напряжение > 20 МПа при относительной влажности 90% при 50 °C). А вот кватернизованный полистирол слишком хрупок для создания мембран и поэтому не подходит для применений с водным AEM электролизером, который требует механически стабильных AEM.
Щелочная стабильность HTMA-DAPP также достаточно высока: проявление минимального разложения в течение > 3000 часов в 4 М NaOH при 80 °C. Этот показатель гарантирует проведение испытаний AEM электролизера при рабочей температуре в 85 °C.
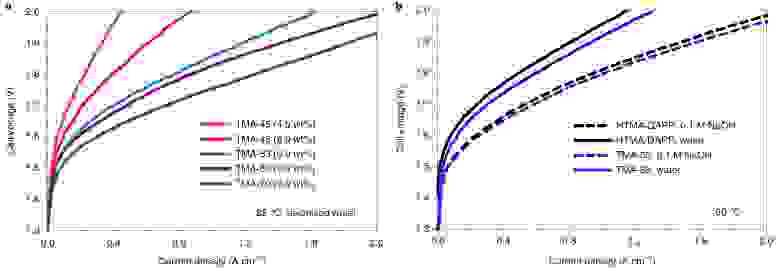
Изображение №4: влияние иономеров на производительность AEM.
На графике 4а продемонстрирован прогресс улучшения рабочих характеристик электролизера за счет исследуемого иономера.
Помимо влияния иономеров на производительность электролизера, ученые также исследовали влияние фенильной группы в иономере (4b). Для этого были проведены эксперименты, в которых сравнивались два МЕА, которые были одинаковы, за исключением связующего электрода. Первый электрод — это MEA с HTMA-DAP, а второй — с TMA-53. Содержание иономера (9 мас.%) и значение IEC (2,6) для обоих электродов было также одинаковым.
Подобные наблюдения указывают на то, что работа электролизера менее чувствительна к 0.1 М NaOH. Это может объясняться тем, что кислотные фенолы от окисления фенильной группы были нейтрализованы щелочным раствором.
Далее было проведено более детальное изучение характеристик MEA с TMA-70 посредством использования катализаторов, не содержащих металлов платиновой группы. В качестве анода был использован катализатор на основе нанопены NiFe.
Проверка характеристик MEA с разным содержанием иономеров в анодном NiFe катализаторе позволила определить, что 20 мас.% содержание иономера является наиболее эффективным.

Изображение №5: производительность AEM электролизера с анодным катализатором без применения металлов платиновой группы.
Далее для большей наглядности рабочие характеристики MEA с анодным NiFe катализатором сравнили с характеристиками электролизера с протонообменной мембраной (PEM), в которых используются катализаторы с металлами платиновой группы.
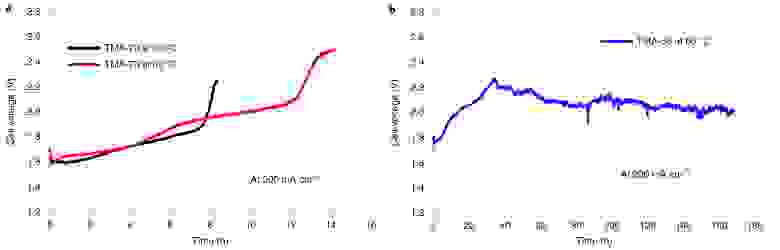
Изображение №6: показатели прочности AEM электролизеров с NiFe катализатором.
Было обнаружено, что частицы катализатора были вымыты как из анодного, так и из катодного выходных потоков. Это может свидетельствовать о том, что иономер с высоким IEC (TMA-70) не удерживал частицы катализатора во время непрерывной работы.
Увеличение силы связывания иономера можно было достичь путем применения того же иономера с более низким IEC при 60 °C.
На 6b показан кратковременный тест на прочность AEM электролизера с использованием иономера TMA-53. По результатам четко видно, что система работает стабильно в течение более 100 часов после начального повышения напряжения с 1.75 до 2.1 В. Начальное повышение напряжения в течение первых 40 часов, вероятно, связано с окислением фенила.
Вывод достаточно печальный — система хоть и показывает отличные результаты по производительности, но не может похвастаться тем же в аспекте долговечности.
Для более подробного ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых.
Эпилог
В данном труде исследователи продемонстрировали модель связующей системы для электродов, которая способна повысить производительность AEM электролизера. Такой вариант по своим характеристикам не уступает современным PEM электролизерам, при этом он не нуждается в металлах платиновой группы, что значительно снижает себестоимость всей системы.
Связующее для электродов было синтезировано на основе результатов экспериментов с вращающимся дисковым электродом, которые показали важность высокого локального pH для эффективной реакции выделения водорода и реакции выделения кислорода.
Удаление фенильных групп из основной цепи полимера позволяет предотвратить образование кислых фенолов, которые могут нейтрализовать гидроксид четвертичного аммония и снизить рН электролита. Кроме того, повышение рН электродов было достигнуто путем увеличения содержания иономера и IEC.
AEM электролизер, использующий кватернизованный иономер полистирола аммония, продемонстрировал отличную производительность даже без циркулирующего щелочного раствора.
Конечно не обошлось и без недостатков. В дальнейшем ученые намерены провести ряд дополнительных исследований для улучшения производительности разработанной системы и для повышения ее долговечности.
В совокупности все рассмотренные наблюдения являются дополнительными сведениями в области разработки высокоэффективных систем электролизеров, а также позволяют понять, как эффективнее хранить возобновляемую энергию.
Как говорят сами авторы исследования, суть заключается в том, что источники возобновляемой энергии весьма нестабильны. За одинаковый промежуток времени можно получить разный объем энергии, поскольку могут быть разные условия (например, ветрогенератор в безветренную погоду не особо эффективно работает). Тем не менее, порой имеется излишек энергии, которую необходимо эффективно утилизировать. Авторы сего труда считают, что использовать данную возобновляемую энергию нужно для производства водорода, необходимость в котором из года в год только растет.
Благодарю за внимание, оставайтесь любопытствующими и хорошей всем рабочей недели, ребята. 🙂