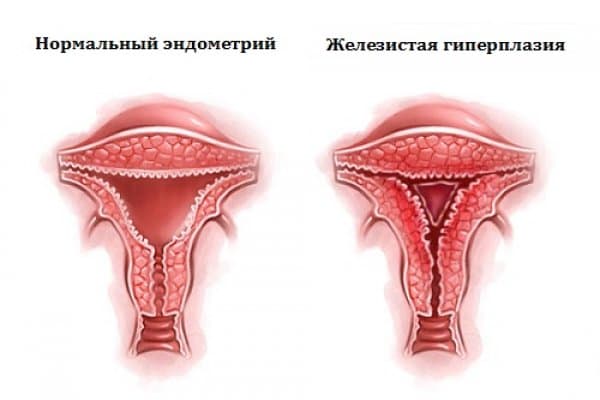
Эндометрия не соответствует фазе цикла что это такое
Гиперплазия эндометрия – симптомы и лечение

Основная причина чрезмерного разрастания эндометрия – это повышенная выработка эстрогенов и недостаток прогестерона. Чаще всего, данная патология диагностируется у женщин в предменопаузе и у девочек- подростков. Оба состояния связаны с гормональной перестройкой организма. Для гиперплазии эндометрия характерен ановуляторный цикл – отсутствие овуляции.
Что может спровоцировать гиперплазию эндометрия?
Какие симптомы характерны для гиперплазии эндометрия?
Все эти симптомы могут сопровождать миому матки или даже выкидыш на раннем сроке, поэтому необходимо сделать УЗИ малого таза, чтобы определить причину нециклических выделений.
Способы диагностики гиперплазии эндометрия
Узи органов малого таза влагалищным датчиком определяет толщину эндометрия. Толщина эндометрия меняется на протяжении всего цикла, в период перед месячными фиксируется самое высокое значение. Для диагностики следует проводить УЗИ в первой половине цикла, обычно на 7-10 день. Толщина свыше 15 мм дает повод заподозрить патологию и направить пациентку на гистероскопию – внутреннее обследование матки гистероскопом (специальным оптическим прибором), сопровождающееся диагностическим выскабливанием эндометрия и исследование полученного материала для типирования гиперплазии. Так УЗИ дает лишь 68 процентов информативности при гиперплазии, а для гистероскопии это значение достигает 94 процентов.
Аспирационная биопсия – еще один метод диагностики, когда кусочек эндометрия, взятый из полости матки, направляется на гистологическое исследование.
В некоторых случаях гинеколог может направить пациентку на анализ крови на гормоны: эстроген и прогестерон, гормоны щитовидной железы и надпочечников.
Лечение гиперплазии.
Самым эффективным способом лечения гиперплазии эндометрия является раздельное диагностическое выскабливание. Проводится в условиях стационара, обычно под наркозом. Затем полученный эндометрий отправляется на гистологию, и в зависимости от полученного результата исследования назначается гормональное лечение.
Гормонотерапия нужна для подавления разрастания эндометрия и регулирования гормонального фона. Гормональное лечение зависит от возраста пациентки. Так женщинам до 35 лет назначают комбинированные оральные контрацептивы.
Лечение гестагенами – еще один способ гормонотерапии, подходит для лечения гиперплазии эндометрия любого типа. Спираль Мирена – это один из таких вариантов. Но существует и таблетированная форма – это назначение препаратов Утрожестан или Дюфастон.
Не следует пренебрегать гормональной терапией, так как процент рецидивов высок (полипы могут возникнуть вновь после их удаления и не один раз), а обильные кровотечения осложняются анемией.
Гиперплазия эндометрия матки
Тел.: 8-800-25-03-03-2
(бесплатно для звонков из регионов России)
Санкт-Петербург, наб. реки Фонтанки, д. 154
Тел.: +7 (812) 676-25-25
Санкт-Петербург, В.О., Кадетская линия, д. 13-15
Тел.: +7 (812) 676-25-25
Санкт-Петербург, ул. Циолковского, д.3
Тел.: +7 (812) 676-25-10
Эндометрий представляет собой нежную тонкую слизистую ткань, которая выстилает полость матки изнутри. Данная ткань каждый месяц быстро растет и утолщается под действием женских половых гормонов. В случае наступления беременности, эндометрий является «пуховой периной» на которую прикрепляется оплодотворенная яйцеклетка. При отсутствии беременности под действием гормонов эндометрий отторгается, выходит в виде менструальной крови.
Классификация гиперплазии эндометрия по локализации
Классификация гиперплазии эндометрия (по гистологической картине)
Причины гиперплазии эндометрия
В настоящее время основной причиной развития гиперплазии считается нарушение баланса женских половых гормонов, который чаще всего встречается в пубертатном периоде и перименопаузе.
Факторы риска развития гиперплазии эндометрия
Симптомы, которые встречаются при гиперплазии эндометрия
Основные из них при гиперплазии эндометрия могут быть:
Обследования, которые помогут выявить и поставить диагноз гиперплазии эндометрия
Лечение гиперплазии эндометрия
Практически в 100% случаев лечение гиперплазии эндометрия хирургическое.
Методами хирургического лечения гиперплазии эндометрия является гистероскопия и гистерорезектоскопия.
Данная операция проводится под общей анестезией. Продолжительность операции не превышает 30 минут, короткий период нахождения под общей анестезией позволяет врачам в тот же день отпустить пациентку домой.
Осложнения гиперплазии
При отсутствии должного и адекватного лечения гиперплазия эндометрия приводит к тяжелой анемии с значительным снижением уровня гемоглобина, появлению слабости, повышенной усталости, сонливости, что связано с большими потерями крови во время менструации. У молодых женщин гиперплазия эндометрия может быть причиной бесплодия и невынашивания беременности. Отдельные формы гиперплазии эндометрия (железистая и кистозная гиперплазии эндометрия) являются предраковым состоянием и в случае длительного наблюдения, при отсутствии лечения, могут переродиться в рак матки.
Профилактические мероприятия при данном заболевании необходимы для того, чтобы снизить риск развития рака эндометрия и предотвратить рецидив гиперплазии.
Гиперплазия эндометрия. Часто задаваемые вопросы
1. Что это такое? Доброкачественный процесс, который характеризуется чрезмерным разрастанием внутреннего слоя матки.
2. Из-за чего она возникает? Из-за постоянного воздействия полового гормона эстрогена на эндометрий, который вызывает его чрезмерное разрастание. Гиперэстрогения возникает из-за нарушения центральной регулиции менструального цикла, гормонопродуцирующих опухолей яичников, неправильного использования гормональных препаратов, дефицита прогестерона (гормон II фазы менструального цикла), обладающего антипролиферативным действием, так же в результате ановуляторных циклов.
3. Это распространенное заболевание? Частота встречаемости в структуре гинекологической заболеваемости 15-50%. По данным обращаемости пациенток частота встречаемости ГПЭ- 30%. В позднем репродуктивном возрасте и в перименопаузе встречается с частотой- 50%
4. Это заболевание очень опасно? Пристального внимания врачей заслуживают:
При отсутствии должного лечения гиперплазия эндометрия может приводить к серьезным маточным кровотечениям, со снижением гемоглобина крови и вытекающими отсюда последствиями.
5. Возможно ли забеременеть на фоне гиперплазии эндометрия? Ответ – нет. Гиперплазия эндометрия не возникает спонтанно, это следствие нарушений в репродуктивной системе женщины. Нарушение баланса между звеньями регуляции менструального цикла вызывает избыток эстрогенов в организме женщины, нехватку прогестерона, вследствие этого отсутствие овуляции (выхода яйцеклетки из фолликула для оплодотворения). Так же сам эндометрий структурно изменен, поэтому является неблагоприятным для имплантации (прикрепление плодного яйца к стенке матки).
7. Как диагностировать атипическую гиперплазию эндометрия? Большую информацию врач получает при опросе пациентки во время общения (возраст менархе или время наступления менопаузы, все особенности менструального цикла- его длительность, характер выделений и т.д.).
УЗ-исследование в зависимости от периода жизни женщины, а также фазы менструального цикла может дать информацию о состоянии эндометрия. По этим данным можно заподозрить проблему, однако подтвердить или опровергнуть атипию в клетках эндометрия нельзя. Только проведение гистероскопии с последующим гистологическим исследованием материала является золотым стандартом для диагностики этого состояния. Информативность метода более 90%.
8. Обязательно ли проводить выскабливание эндометрия при гиперплазии? Раздельное выскабливание цервикального канала и полости матки несет за собой лечебный и диагностический характер. Механическое удаление измененной патогенной ткани из полости матки предотвращает маточное кровотечение, что составляет лечебный эффект. Полученный соскоб отправляется на гистологическое исследование, после которого будет дано заключение о характере ткани, наличии или отсутствии признаков злокачественного поражения.
9. Возможен ли рецидив гиперплазии эндометрия? Да, возможен. Так как причиной гиперплазии эндометрия является нарушение гормонального баланса в организме женщины, то требуется обследование её гормонального фона. Для профилактики рецидива необходимо соответствующее лечение и исключение факторов риска.
Эндометрий при ЭКО
Процедура экстракорпорального оплодотворения (ЭКО) – это сложный и многоэтапный процесс, в ходе которого происходит оплодотворение яйцеклетки не в организме женщины, как при наступлении физиологической беременности, а в условиях эмбриологической лаборатории. Это инновационный сложный и трудоемкий процесс, который требует слаженной работы специалистов, применения схем лекарственных препаратов, а также выполнения некоторых инвазивных манипуляций. Конечно же, все этапы проведения ЭКО требуют грамотности и скрупулезности. Однако, далеко не сто процентов успеха зависит от точности методики выполнения всех нюансов этапов протокола.
Довольно большое значение для успешного протокола экстракорпорального оплодотворения имеет качество эндометрия.
Стаж работы 22 года.
Что такое эндометрий
Эндометрий — это внутренняя слизистая оболочка матки, ее внутренний слой, которым выстлана маточная полость. Это уникальная ткань, функциональные и гистологические особенности которой дают возможность наступить и пролонгироваться беременности.
Эндометрий имеет два слоя:

В эндометрии циклически, в зависимости от фазы овариально-менструального цикла, происходят изменения:

Как влияет эндометрий на зачатие?
Именно нормальные, физиологические значения толщины и качества эндометрия обеспечивают нормальную имплантацию эмбриона в полость матки и дальнейшее нормальное вынашивание беременности. Если эндометрий не соответствует необходимым характеристикам, то это может спровоцировать бесплодие, угрозу прерывания беременности, самопроизвольный аборт, плацентарную недостаточность.
Какой должен быть эндометрий для зачатия ребенка?
Для наступления самопроизвольной беременности необходимы определенные характеристики слизистой оболочки матки в зависимости от дня овариально-менструального цикла.
Какой толщины должен быть эндометрий для зачатия?

Какой должна быть толщина эндометрия при ЭКО
Как слишком тонкий эндометрий (гипоплазия), так и слишком толстый (гиперплазия эндометрия) могут препятствовать наступлению беременности. Что примечательно, что даже такая сложная процедура, как экстракорпоральное оплодотворение, которая дает шансы даже при нулевом проценте возможности беременности физиологическим путем, не может быть успешной при патологических характеристиках эндометрия (его толщины).
Какой должен быть эндометрий для ЭКО?
Для того, чтобы прогнозировать вероятность успешного протокола ЭКО, необходимо знать, какой должен быть эндометрий для подсадки эмбрионов:

Диагностика эндометрия
Как оценить, каким должен быть эндометрий для имплантации?
Важным показателем в оценке эндометрия имеет его рецептивность. Это параметр, который характеризуется оценкой готовности слизистой полости матки к имплантации эмбриона. Как ее оценить?
Какой толщиной должен быть эндометрий для зачатия: иные методы диагностики

Как улучшить эндометрий?
При наличии понимания о том, что необходимы определенные параметры эндометрия для наступления беременности, возникает логичный вопрос: как подготовить эндометрий к беременности? Существует несколько способов скорректировать толщину и качество эндометрия.
Как нарастить эндометрий перед ЭКО?

Данная статья не может быть использована для постановки диагноза, назначения лечения и не заменяет прием врача.
Эхографические особенности лютеиновой фазы менструального цикла
УЗИ аппарат RS85
Революционные изменения в экспертной диагностике. Безупречное качество изображения, молниеносная скорость работы, новое поколение технологий визуализации и количественного анализа данных УЗ-сканирования.
Введение
Недостаточность лютеиновой фазы (НЛФ) менструального цикла является функциональной овариальной патологией, характеризующейся гипофункцией желтого тела, и встречается у 46,6 % женщин с бесплодием и регулярным менструальным циклом [1, 2]. Недостаточный синтез прогестерона ведет к неполноценной секреторной трансформации эндометрия, изменению функции маточных труб, нарушению имплантации оплодотворенной яйцеклетки, что клинически проявляется в виде бесплодия либо спонтанного выкидыша в I триместре беременности [3].
Традиционная диагностика НЛФ включает клинические данные, тесты функциональной диагностики, определение содержания гормонов крови, морфологическое исследование эндометрия [4]. Однако многие методы этой диагностики являются продолжительными, дорогостоящими и небезопасными для больного вследствие инвазивности. Некоторые исследования такие, как базальная термометрия, зависят от пунктуальности и ответственности пациенток, что делает их во многом субъективными 2.
Эхография является доступным, безвредным, информативным методом диагностики, который достоверно отражает морфологические изменения, происходящие в эндометрии и яичниках при НЛФ 7.
В доступной литературе мы не встретили данные, характеризующие количественные и качественные показатели эхографической структуры желтого тела, патогномоничные для НЛФ [9,10], что и послужило основанием для проведения нашего исследования.
Материалы и методы
Обследовано 80 пациенток с клиническим диагнозом НЛФ. Контрольную группу составили 80 здоровых фертильных женщин с регулярным менструальным циклом. Ультразвуковое исследование выполнялось с помощью трансабдоминального конвексного (3,5МГц) и трансвагинального конвексного (5МГц) датчиков.
В ходе ультразвукового обследования матки измерялась толщина эндометрия, оценивалась его структура. При исследовании яичников определялись объемы желтого тела и яичника, вычислялось отношение объема желтого тела к объему яичника, оценивалась структура и эхогенность желтого тела, а также толщина и эхогенность его стенки. Мы проследили за процессом формирования желтого тела с момента овуляции. Оценка количественных показателей проводилась в середину секреторной фазы на 20-24-йдень менструального цикла.
Эндометрия не соответствует фазе цикла что это такое
Согласно существующим представлениям, все причины безуспешности попыток ЭКО, в которых удается выполнить перенос полученных in vitro эмбрионов, могут быть связаны либо с их неспособностью к внутриматочной нидации (эмбриональный фактор), либо со снижением рецептивности эндометрия (эндометриальный фактор) [1, 2]. Необходимость совершенствования эндометриального фактора программ ЭКО определяется тем, что при использовании морфологически хороших эмбрионов, полученных при оплодотворении донорских ооцитов в программах ЭКО-ОД, только ненамного повышает частоту успешных имплантаций в сравнении со стандартным ЭКО (где качество переносимых эмбрионов может быть не столь хорошим). Это можно видеть из отчета РАРЧ за 2013 г. (опубликован в 2015 г.), согласно которому частота наступления беременности на перенос эмбрионов (ЧНБпэ) в программе ЭКО-ОД превысила лишь на 5,3% аналогичный показатель в стандартной программе ЭКО (43,8% против 38,5%) [3]. Данный факт указывает на то, что резерв для дальнейшего повышения эффективности ЭКО в посттрансферном периоде ассоциируется с эндометриальным, а не с эмбриональным фактором, что собственно и определяет актуальность оценки состояния рецептивности эндометрия и поиск подходов к ее повышению.
Для эндометрия, способного обеспечивать успешную имплантацию, типичны вполне определенные признаки [2, 4—6]:
1) морфологические признаки, определяемые при стандартном ультразвуковом исследовании (УЗИ):
а) толщина; б) макроструктура;
2) особенности кровоснабжения;
3) ультраструктурные изменения в клетках поверхностного слоя;
4) особенности популяционного состава присутствующих иммунокомпетентных клеток;
5) метаболические характеристики (уровень многочисленных молекулярных и генетических регуляторов эндометриального гомеостаза).
Соответственно выраженные отклонения морфологических, гемодинамических, ультраструктурных, иммунологических и молекулярно-генетических параметров, характеризующих нормальное прегравидарное состояние эндометрия, могут обусловливать снижение его рецептивности. Это в свою очередь означает, что перечисленные 5 групп оцениваемых параметров эндометриального гомеостаза потенциально могут рассматриваться как маркеры эндометриальной рецептивности.
Термином «маркер эндометриальной рецептивности» принято обозначать любой (инструментальный или лабораторный) показатель, изменения которого в той или иной мере влияют на клинические исходы ЭКО, оцениваемые по показателю ЧНБпэ [6, 7].
Для практикующих врачей маркеры эндометриальной рецептивности интересны тем, что получаемая при их определении информация может служить, во-первых, прогнозированию наступления индуцированной беременности и, во-вторых, контролю эффективности любой дополнительной терапии, ставящей целью улучшение рецептивных свойств эндометрия.
Толщина эндометрия в оценке его рецептивности, понятие «тонкий» эндометрий
По данным УЗИ, толщина эндометрия под влиянием стимулирующего эффекта эстрогенов в естественных циклах к моменту овуляции у подавляющего большинства фертильных женщин колеблется от 8—12 мм [6—8]. Такие же значения толщины эндометрия отмечаются и у большинства пациенток с наступившей беременностью в стимулированных циклах стандартных программ ЭКО в день введения триггера овуляции при наличии в яичниках хотя бы единственного нормально развивающегося фолликула [6, 7]. Исходя из этих наблюдений, логично рассматривать именно такую толщину прегравидарного эндометрия (8—12 мм) в преовуляторном периоде, к завершению фолликулярной фазы как оптимальную для имплантации переносимого эмбриона, хотя в литературе описаны случаи наступления беременности даже при его толщине 4 мм [9]. Соответственно в стандартных программах ЭКО «тонким» следовало бы считать эндометрий, не достигающий к моменту завершения контролируемой стимуляции положенных оптимальных значений, т. е. имеющий толщину менее 8 мм на фоне регистрируемого в яичниках нормального роста хотя бы одного фолликула. В программах ЭКО с переносом размороженных эмбрионов в проводимых у реципиентки циклах заместительной гормональной терапии (ЗГТ) наличие «тонкого» эндометрия также можно констатировать при его толщине менее 8 мм на день назначения прогестерона, т. е. к концу монотерапии эстрогенами, имитирующей фолликулярную (пролиферативную) фазу цикла.
Таким образом, эндометрий с толщиной менее 8 мм к моменту завершения естественной (в натуральных циклах), искусственной (при применении индукторов фолликулогенеза) или имитируемой (при ЗГТ эстрогенами) фолликулярной фазы целесообразно обозначать как «тонкий». А сам феномен недостаточности развития (рост) эндометрия в пролиферативной фазе цикла в отсутствие признаков гипоэстрогении следует рассматривать как проявление резистентности к эстрогенной стимуляции.
К сожалению, не все специалисты применяют словосочетание «тонкий эндометрий» для обозначения преовуляторного эндометрия с толщиной именно менее 8 мм. По мнению многих из них, «тонким» следует считать эндометрий лишь с такой толщиной, при которой отмечается статистически значимое снижение ЧНБпэ. С этой точки зрения, «тонким» эндометрием (т.е. достоверно ухудшающим клинические исходы ЭКО), по разным данным, следует считать преовуляторный эндометрий с толщиной:
Следует отметить, что именно из-за расхождений в представлении о том, какая именно толщина преовуляторного эндометрия должна соответствовать определению «тонкий», или гипоплазированный эндометрий, невозможно составить точное представление об истинной распространенности случаев отставания толщины эндометрия ко дню введения хорионического гонадотропина человека (чХГ) от минимального нормативного значения (если таковым считать 8 мм) в программах стандартного ЭКО. По этой же причине остается неизвестной и частота случаев отставания толщины эндометрия от минимального норматива к моменту завершения монотерапии эстрогенами при подготовке эндометрия реципиенток к переносу размороженных эмбрионов.
В приложении к вопросу о влиянии феномена «тонкого», или гипоплазированного эндометрия на результаты ЭКО нет единого мнения. Знакомство с литературой показывает, что одни [9, 14] исследователи вообще отрицают негативное влияние «тонкого» эндометрия на клинические исходы ЭКО, тогда как другие [11, 12] рассматривают этот феномен как весьма важный фактор, препятствующий успешной имплантации. Причиной таких расхождений, вероятно, является зависимость ухудшения результатов лечения от степени отставания толщины преовуляторного эндометрия от минимального нормативного значения. Следует предположить, что авторы, у которых под наблюдением находились в основном пациентки с умеренным отставанием развития эндометрия (6—8 мм в день введения чХГ), приходили к выводу об отсутствии негативного влияния «тонкого» эндометрия на его рецептивность, определяющую клинические исходы ЭКО. И наоборот, исследователи, у которых среди набранных «профильных» больных была значительнее доля пациенток с более выраженным отставанием развития эндометрия (5 мм и менее к моменту завершения фолликулярной фазы), суммарно констатировали статистически значимое ухудшение результатов лечения по показателю ЧНБпэ, которое они также связывали с феноменом «тонкого», или гипоплазированного эндометрия.
Вопрос о механизмах отрицательного влияния «тонкого» эндометрия на частоту имплантации переносимых эмбрионов остается открытым. Пока высказывается лишь предположение о том, что при слишком тонком эндометрии бластоциста в процессе имплантации очень близко соприкасается со спиральными артериями и находится в области высокой концентрации кислорода, что негативно отражается на ее способности к нидации. Последнее косвенно подтверждается работами, в которых было показано, что культивирование invitro бластоцист в условиях низкой концентрации кислорода сопровождается их большей выживаемостью и более высокой способностью к успешной имплантации при последующем переносе в матку [16]. Также можно предположить, что в «тонком» эндометрии создаются предпосылки для учащения отклонений в метаболизме многочисленных биологических субстанций, которые контролируют тканевый гомеостаз в эндометрии и соответственно влияют на его рецептивность.
Эхо-структура прегравидарного эндометрия как маркер его рецептивности
На основании своих наблюдений S. Chen и соавт. [17] указывают, что наличие в преовуляторном периоде трехслойного (вместо монослойного) паттерна эндометрия ассоциируется с более высокой вероятностью успешной имплантации. Эта закономерность проявляет себя как при нормальной (≥8 мм), так и при недостаточной ( 3,0).
В ряде исследований [26, 32] выявлена корреляция между недостаточной толщиной преовуляторного эндометрия ( 3,0, то в таких случаях вероятность наступления беременности равна нулю [35]. С учетом этого обстоятельства при прогнозировании исходов ЭКО ими рекомендуется одновременный учет толщины эндометрия и показателя РI.
Другие специалисты [36] высказывают мнение, что для прогноза наступления беременности целесообразно одновременно учитывать конечную диастолическую скорость в маточных артериях, толщину и структуру эндометрия. По их мнению, вероятность наступления беременности резко снижается при сочетании в преовуляторном периоде уменьшения конечной диастолической скорости с недостаточной толщиной эндометрия и отсутствием его трехслойности.
Также можно найти сообщения [37], согласно которым для оценки рецептивности эндометрия целесообразно одновременно оценивать показатели S/D и IR в спиральных артериях в день введения триггера овуляции. Причем получаемые при этом результаты рекомендуется использовать в составе достаточно сложной формулы, в которой фигурируют еще и параметры, учитывающие:
— оптическую плотность экспрессии лейкемияингибирующего фактора в поверхностном и железистом эпителии эндометрия в период предполагаемого «окна имплантации» в цикле, предшествующем проведению ЭКО (для получения такой информации надо выполнить биопсию эндометрия в нестимулированном цикле с проведением достаточно сложного иммуногистохимического исследования полученных образцов);
— содержание сосудистого эндотелиального фактора роста в цервикальной слизи в день трансвагинальной пункции фолликулов.
Следует, однако, подчеркнуть, что предлагаемые к допплерографической оценке спиральные артерии могут не визуализироваться (по признанию самих же авторов, предлагающих тестировать кровоток в этом типе артерий) почти у 30% женщин как с наступившей, так и с ненаступившей беременностью [37]. Очевидно, что это обстоятельство существенно обесценивает получаемую информацию о состоянии рецептивности эндометрия, основанную на исследовании кровотока именно в спиральных артериях.
Таким образом, возможность оценки состояния рецептивности эндометрия на основе данных допплерометрии сосудов матки, дополняемых результатами стандартного УЗИ и, возможно, определениями некоторых молекулярных регуляторов эндометриального гомеостаза, по-прежнему представляется малоубедительной.
Зависимость рецептивности эндометрия от его ультраструктуры
В период «окна имплантации» имеют место значительные ультраструктурные изменения в морфологии эндометриальных эпителиальных клеток. Сканирование электронным микроскопом поверхности эпителия в период его максимальной рецептивности выявляет эктоплазматические протрузии, называемые пиноподиями [38, 39]. В своей эволюции эти образования проходят три стадии: развивающиеся, полностью развитые и регрессирующие пиноподии. Функциональная роль развитых пиноподий в периоде «окна имплантации» состоит, вероятно, в облегчении прикрепления бластоцисты к поверхностному слою эндометриальных эпителиальных клеток в области их апикального пространства. Поэтому пиноподии можно рассматривать как специфический ультраструктурный маркер рецептивности эндометрия, поскольку обнаруживаемые отклонения динамики их образования, плотности экспрессии или нарушения их микроструктуры могут становиться причиной затруднения имплантации переносимых эмбрионов [39]. Тем не менее следует иметь в виду, что слишком многие случаи снижения рецептивности эндометрия, как показывает практика, не связаны именно с нарушением функции пиноподий. У многих пациенток с безуспешным использованием ЭКО в анамнезе последующее исследование пиноподий в периоде «окна имплантации» не выявляет каких-либо отклонений в эволюции ультраструктуры поверхности эпителиальных клеток. По этой причине ряд исследователей [40] приходят к выводу, что образование пиноподий не может быть точным (во всяком случае, единственным) маркером, характеризующим рецептивность эндометрия.
Показатели клеточного иммунитета в оценке рецептивности эндометрия
В эндометрии здоровых фертильных женщин обнаруживается большое разнообразие иммунокомпетентных клеток, количество и характеристики которых варьируют в течение менструального цикла. На примере инфертильных пациенток с эндометриозом показано [2, 41—43], что отсутствие имплантации часто ассоциируется c обнаруживаемыми в крови и аспирате эндометрия отклонениями фракций иммунокомпетентных клеток, несущих антигены:
— CD8+ (цитотоксические Т-клетки);
— CD56+ (натуральные киллеры и активированные Т-клетки);
— CD14+ (моноциты и макрофаги);
— CD19+ (дифференцирующиеся В-лимфоциты);
— CD3+ (общая популяция Т-клеток).
S. Chen и соавт. [44] отмечают особую значимость специализированных регуляторных лимфоцитов, несущих одновременно поверхностные антигены CD4+, CD25+ и FoxP3. Эта Т-клеточная субпопуляция, обозначаемая авторами как T-regs, контролирует и ослабляет иммунный ответ, тормозит высвобождение цитокинов и медиаторов воспаления, поддерживая толерантность к имплантирующейся бластоцисте и развивающемуся плоду. Установлено, что у женщин с эндометриозом снижается доля T-regs в общей популяции CD4+ лимфоцитов, что потенциально может провоцировать аутоиммунные реакции как препятствующие успешной имплантации переносимых эмбрионов, так и увеличивающие ранние репродуктивные потери.
Нельзя исключить, что ослабление рецептивности эндометрия, ассоциируемое с отклонениями местного клеточного иммунитета, может сопровождать не только эндометриоз, но и другие гинекологические заболевания. По этой причине при уточнении рецептивности эндометрия (в особенности у пациенток с подтвержденными неудачами имплантации в анамнезе), вероятно, целесообразно оценивать иммунный статус с определением субпопуляционного состава, несущего указанные выше CD-антигены [43, 44].
Молекулярные и генетические маркеры рецептивности эндометрия
В литературе можно найти сообщения, что рецептивность эндометрия может страдать при отклонениях в местной продукциии/или тканевой рецепции и экспрессии:
— лейкемияингибирующего фактора (LIF) [47];
— сосудисто-эндотелиального фактора роста (VEGF) [48];
— гепаринсвязывающего эпидермального фактора роста (ГС-ЭФР) [49];
— матриксных металлопротеиназ (ММР) и их тканевых ингибиторов (ТIMP) [50];
Перечисленные молекулярные маркеры могут определяться в крови, секрете эндометрия или в самой ткани эндометрия, полученной при его биопсии.
При изучении состава секрета эндометрия (секретомика) в последние годы активно применяют электрофорез в полиакриламидном геле в двух проекциях и высокочувствительную жидкостную хроматографию, которые позволяют с высокой точностью характеризовать уровень интересующих субстратов. С помощью этих методов, например, было установлено, что в период «окна имплантации» поддержание высокой рецептивности эндометрия ассоциируется со значительным увеличением концентрации 9 липидов (простагландинов E2, F1α, F2α, а также соединений этаноламина с различными жирными кислотами) [57]. С другой стороны, усиленное образование аполипопротеина А1 в указанные сроки может препятствовать имплантации, что было продемонстрировано в контингенте пациенток с эндометриозом [58].
При исследовании биоптатов эндометрия предметом изучения может быть его водорастворимая фракция. Так, В.А. Бурлев и соавт. [59] описывают метод исследования выделяемой из гомогената ткани эндометрия его водорастворимой фракции для определения особенностей ее белкового, липопротеидного и гликопротеидного состава. Получаемая при этом информация о количестве обнаруживаемых фракций протеидов, липопротеидов и гликопротеидов (насчитывающих десятки конкретных субстанций), по мнению авторов, позволяет диагностировать недостаточность рецептивных свойств эндометрия и подбирать медикаментозную терапию.
Полученная при биопсии ткань эндометрия может быть исследована и с применением иммуногистохимического анализа. С его помощью возможно характеризовать экспрессию специфических белков, а также рецепторов к многочисленным лигандам, контролирующим эндометриальный гомеостаз, и к гормонам. Так, по предложению В.А. Бурлева и соавт. [51], для уточнения состояния рецептивности эндометрия в период ожидаемого «окна имплантации» у всех пациенток в скрининговой манере следует сначала уточнить концентрацию L-селектина в крови. Далее у пациенток с его недостаточной сывороточной концентрацией (менее 1710 нг/мл) необходимо провести иммуногистохимическое исследование биоптата эндометрия для анализа экспрессии L-селектина в строме эндометрия и специфического селектинового лиганда МЕСА-79 в поверхностном эпителии. При высокой экспрессии L-селектина в строме эндометрия и низкой экспрессии МЕСА-79 в поверхностном эпителии и эпителии желез авторы рекомендуют проведение прегравидарной подготовки (в качестве которой ими предлагается использовать электроимпульсную физиотерапию в комбинации с циклической ЗГТ) перед программой ЭКО.
Другие специалисты указывают на целесообразность иммуногистохимического определения в биоптатах эндометрия уровня экспрессии стромальными клетками ингибитора активатора плазминогена 1-го типа (PAI-1) [60, 61]. Чрезмерно высокий уровень PAI-1 сопровождается подавлением активаторов плазминогена, секретируемых бластоцистой на этапе адгезии, из-за чего снижается вероятность успешной имплантации [62]. Причинами увеличения экспрессии PAI-1 могут выступать воспалительные и опухолевые процессы, заболевания соединительной ткани, спаечный процесс, атеросклероз, ожирение, эндометриоз. Возрастанию уровня PAI-1 способствует также мутация (полиморфизм) гена PAI-1 5G/4G, т. е. увеличение содержания белка PAI-1 в строме эндометрия может быть не только связано с приобретенными причинами, но и носить наследственный характер [60, 63].
Высказывается также предложение определять в эндометрии иммуногистохимическим методом уровень экспрессии LIF, TGF-β1 и VEGF [37] с использованием коммерческих наборов антител и системы компьютерного анализа микроскопических изображений Морфология 5.2. В процессе такого анализа проводится оценка относительной площади экспрессии и оптической плотности LIF, TGF-β1 в железистом и поверхностном эпителии и в строме эндометрия. Относительную площадь экспрессии рассчитывают как отношение площади, занимаемой иммунопозитивными клетками, к общей площади клеток в поле зрения и выражают в процентах. Оптическую плотность экспрессии названных показателей измеряют в условных единицах. Использование данного метода показало, что экспрессия LIF и VEGF тканью эндометрия достоверно более высокая в группе беременных женщин по сравнению с женщинами, у которых беременность не наступила в результате ЭКО. По мнению авторов, полученные данные можно применять в качестве предиктивных критериев адекватной рецептивности эндометрия, т. е. для прогнозирования клинических исходов ЭКО.
Кроме того, в последние годы при исследовании биоптатов эндометрия отдельные специалисты предлагают использовать еще и молекулярно-генетические методы (геномика), с помощью которых изучают экспрессию генов, функция которых связана с клеточным метаболизмом, железистой секрецией, дифференцировкой клеток, межклеточной коммуникацией, адгезией, механизмами репарации и регуляции протеолиза [64, 65]. Для описания экспрессионного профиля эндометрия можно применять технологию микрочипов и полимеразную цепную реакцию. Получаемая при этом информация служит характеристике состояния рецептивности эндометрия и соответственно может быть использована для прогнозирования клинических исходов ЭКО, оцениваемых на посттрансферном этапе.
Заслуживает внимания, что некоторые из выполнявшихся исследований по идентификации генетических маркеров эндометриальной рецептивности уже принесли практический результат. Так, в литературе имеются сообщения о том, что для оценки способности эндометрия обеспечивать успешную имплантацию полезно исследовать экспрессию генов Ced-3, Сed-4, Bcl-2, Bax, Fas, TNF-α, которые влияют на баланс между апоптозом и пролиферацией [66]. Известно, что максимальная активность апоптоза отмечается в норме в эпителиальных клетках эндометрия в местах тесного контакта с бластоцистой. Апоптоз эпителиальных клеток эндометрия является важным механизмом, позволяющим эмбриону преодолевать эпителий эндометрия, в результате чего достигается непосредственный контакт трофоэктодермы с базальной мембраной и становится возможна стромальная инвазия. Соответственно при нарушениях экспрессии перечисленных выше генов могут происходить сбои в механизмах регуляции апоптоза, что приводит к снижению готовности эндометрия к имплантации бластоцисты [66].
Высказываются также предложения определять экспрессию НОХ-генов, кодирующих транскрипционные факторы, контролирующие программы формирования органов и тканей. По данным ряда авторов [67], экспрессия НОХА-10 гена, участвующего в регуляции роста, дифференциации и рецептивности эндометрия, оказывается сниженной в период «окна имплантации» у пациенток с подтвержденной безуспешностью имплантации. Предполагается, что снижение экспрессии НОХА-10 (спровоцированное, например, его гиперметилированием) может приводить к устойчивости действия прогестерона в эндометрии, так как в норме НОХ-гены модулируют многие функции прогестерона [68]. Данный механизм сохранения устойчивости действия прогестерона может объяснять случаи неудачи терапии, направленной на повышение рецептивности эндометрия у пациенток с безуспешной имплантацией в анамнезе.
Есть сообщения, в которых авторы предлагают выполнять молекулярно-генетическое исследование биоптата эндометрия на предмет экспрессии сразу 238 генов. Рекомендуемый к определению массив генов (представленных в одном генетическом чипе) выбран этими специалистами в результате предварительно проведенного анализа диагностической значимости каждого из них для оценки рецептивности эндометрия. Данный метод, получивший название Endometrial Receptive Array (ERA), по мнению его разработчиков, позволяет подтвердить наличие удовлетворительной рецептивности в конкретном образце эндометрия со специфичностью 88% и чувствительностью 99% [69].
Другие исследователи для оценки имплантационного потенциала эндометрия рекомендуют анализировать эндометриальную экспрессию 179 генов, которые они называют RAGs (Receptivity Associated Genes) [70].
Приходится констатировать, что авторы, описывающие множество молекулярных и генетических факторов, по их мнению, контролирующих эндометриальный гомеостаз и процесс имплантации, сами же признают, что до настоящего времени не имеют четкого представления, как все эти факторы взаимодействуют друг с другом [59]. По этой причине пока представляется неясным, насколько отклонения какого-то одного из молекулярных или генетических показателей (позиционируемых как «маркеры эндометриальной рецептивности») могут быть компенсированы изменениями других регуляторов эндометриального гоместаза. Из всего этого следует, что вопрос о том, какой из молекулярно-генетических регуляторов эндометриального гомеостаза может быть еще и надежным, заслуживающим доверия, маркером эндометриальной рецептивности все еще остается открытым.
Таким образом, складывается впечатление, что так называемые «высокотехнологичные» молекулярные и генетические методы оценки состояния рецептивности эндометрия в большей степени пригодны для формирования фундаментальных представлений о процессе имплантации, но не для рутинного прогнозирования клинических исходов ЭКО и мониторинга лечения, направленного на повышение частоты имплантации. Очевидно, что сомнительная диагностическая ценность всех этих методов, сочетающаяся к тому же с трудоемкостью их выполнения и дополнительными материальными расходами на соответствующее сложное лабораторное оборудование и дорогостоящие реактивы, не добавляет популярности этим технологиям и вполне закономерно ограничивает их внедрение в широкую клиническую практику.
Заключение
Обзор описываемых в литературе существующих диагностических методов оценки рецептивности эндометрия позволяет заключить, что из всего их многообразия для рутинного использования, по нашему мнению, вероятно, пригодны лишь ультразвуковые методы, предоставляющие информацию о толщине и макроструктуре эндометрия. Также для этой цели в перспективе можно использовать и допплерографическую оценку маточного кровотока, особенно после того, как будут идентифицированы допплерографические показатели, которые действительно характеризуют эндометриальную рецептивность.
Специалистам, полагающим полезным дополнение диагностического этапа ЭКО методами, предусматривающими иммунологические, микроструктурные (с применением электронной микроскопии) и разного рода молекулярно-генетические исследования, не следует забывать о высокой стоимости процедуры ЭКО. Цена лечения остается высокой даже при выполнении ЭКО в его простейшем стандартном варианте с минимальным набором диагностических процедур. На наш взгляд, представляется неоправданным рекомендовать расширение диагностики в программах ЭКО за счет тестирования дополнительных маркеров эндометриальной рецептивности, поскольку это ведет к еще большему удорожанию лечения, не гарантируя повышения его эффективности. Подобные исследования необходимо продолжать в рамках научных разработок фундаментальной медицины и патофизиологии процесса имплантации.