Эзофагоэнтероанастомоз что это означает
Эзофагоэнтероанастомоз что это означает
Этот метод используют в качестве альтернативы эзофагоеюностомии по Roux-en-Y. В данном варианте пищевод анастомозируют с тощей кишкой способом «конец вбок» (анастомоз Omega>. На расстоянии приблизительно 60 см от анастомоза отводящую петлю тощей кишки соединяют с приводящей петлей тощей кишки анастомозом длиной от 6 до 8 см. Этот анастомоз выполняется для отвода желчи и секрета поджелудочной железы, чтобы предупредить их попадание в пищевод. Это простейший и самый быстрый метод восстановления пассажа пищи после тотальной гастрэктомии.
При его выполнении нет необходимости идентифицировать или пересекать какие-либо брыжеечные артерии, что может привести к снижению кровоснабжения анастомозируемой петли тощей кишки. Несмотря на выполнение широкой еюноеюностомии между отводящей и приводящей петлями тощей кишки на расстоянии 60 см, эта операция не всегда предупреждает заброс щелочных секретов в пищевод и развивающийся вслед за этим эзофагит.
Пищевод мобилизуют в дистальной части приблизительно на 5-8 см, для того чтобы низвести его л пересечь в пределах здоровых тканей. Низведение пищевода облегчает формирование анастомоза между задней стенкой пищевода и тощей кишкой. Автор предпочитает не пересекать пищевод полностью до его анастомозирования с тощей кишкой. Накладывать швы между пищеводом и тощей кишкой легче, если желудок соединен с пищеводом и удерживается поднятым вверх зажимом Harrington. Кроме того, можно также производить подтягивание пищевода за желудок.
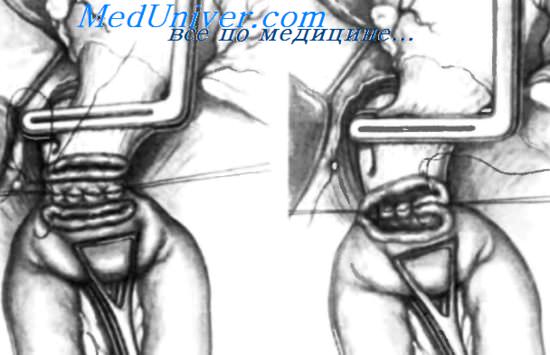
Для подшивания к пищеводу выбрана петля тощей кишки достаточной длины. Тощая кишка проведена через бессосудистую зону брыжейки поперечной ободочной кишки. Ее также можно провести спереди от брыжейки поперечной ободочной кишки. Тощую кишку удерживают около пищевода с помощью треугольного зажима Duval. Прежде чем начать формирование анастомоза между тощей кишкой и пищеводом, очень важно наложить 3-4 нерассасывающихся шва, включающих, с одной стороны, серозно-мышечную часть задней стенки тощей кишки, а с другой — мышцы диафрагмы. Эти швы помогают удерживать тощую кишку, чтобы не было натяжения эзофагоеюнального анастомоза. Накладывать эти швы, как и задние эзофагоеюнальные, проще если тощая кишка удерживается зажимом Duval.
После фиксации тощей кишки к мышце диафрагмы накладывают задние узловые нерассасывающиеся швы между мышечным слоем пищевода и серозно-мышечным слоем тощей кишки. Прерывистой линией показано, где следует рассекать заднюю стенку пищевода и тощую кишку. Как было указано выше, пересечение стенок пищевода должно производиться в два этапа. Сначала пересекают мышечный слой пищевода, а затем на несколько миллиметров дистальнее отсекают слизистую оболочку.
А. Задняя стенка пищевода и тощая кишка пересечены. Продолжается ушивание задней стенки анастомоза узловыми нерассасывающимися швами. В. Завершено наложение ряда сквозных швов на заднюю губу анастомоза
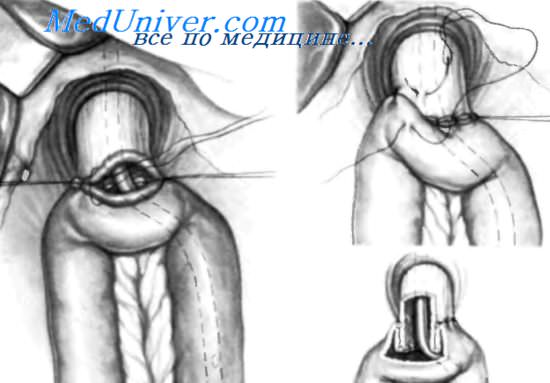
А. Завершено ушивание задней стенки эзофагоеюноанастомоза. В. Пищевод пересечен прямоугольными ножницами, что позволяет удалить операционный макропрепарат.
А. Накладывают ряд сквозных швов на переднюю стенку анастомоза. Стенки пищевода и тощей кишки соединяют узловыми швами, оставляя узлы внутри просвета. Назогастральный зонд Levine, нижний конец которого находился в средней трети пищевода, проводят под визуальным контролем в отводящую петлю тощей кишки на расстояние около 15 см. В. После закрытия просвета анастомоза на его переднюю стенку накладываются швь; между мышечным слоем пищевода и серозно-мышечным слоем тощей кишки, которые не проникают в просвет этих органов. На вставке изображено, как отсеченный конец пищевода инвагинируется в тощую кишку. Когда формирование анастомоза завершено, для подтверждения его герметичности вводят 50 мл индигокармина.
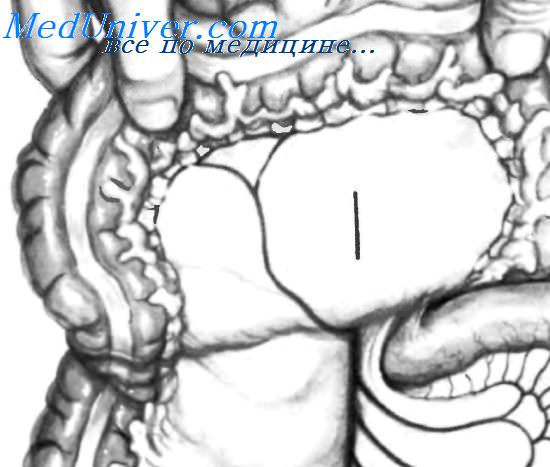
Завершив формирование эзофагоеюностомоза, накладывают несколько швов между передним краем эзофагодиафрагмальной брюшины и передней стенкой тощей кишки, как изображено на рисунке. Эти швы необходимы для удержания тощей кишки на месте, чтобы избежать натяжения по линии эзофагоеюнальных швов.
Завершив формирование эзофагоеюностомоза и подшивания петли тощей кишки сзади к мышце диафрагмы и спереди к эзофагодиафрагмальной брюшине, стенку тощей кишки фиксируют к брыжейке поперечной ободочной кишки в месте ее входа в верхнюю часть брюшной полости. Эти швы не только фиксируют тощую кишку, но и предупреждают ее ротацию, а также возникновение внутренних грыж. Под брыжейкой поперечной ободочной кишки, примерно на расстоянии 60 см от эзофагоеюноанастомоза, наложен анастомоз между отводящей и приводящей петлями тощей кишки длиной от 6 до 8 см (брауновский еюноеюноанастомоз).
Эзофагоэнтероанастомоз что это означает
Для восстановления непрерывности пищеварительного тракта после тотальной гастрэктомии предлагались различные виды операций. Были разработаны раличные варианты создания резервуара из тощей кишки вместо удаленного желудка. Ни один из них не выглядит лучше, чем анастомоз между пищеводом и тощей кишкой, подведенной изоперистальтически по Roux-en-Y.
Тотальная гастрэктомия, несомненно, является технически более сложной операцией, чем субтотальная резекция. Это обусловлено, главным образом, слабостью стенки пищевода, что играет важную роль при формировании анастомоза с тощей кишкой. Создание эзофагоеюноанастомоза — не только сложная, но и рискованная операция из-за возможного развития несостоятельности швов, являющейся ее наиболее частым осложнением, которое может привести к летальному исходу.
Хирургу, выполняющему гастрэктомию с восстановлением непрерывности пищеварительного тракта, необходимо руководствоваться основными принципами, некоторые из которых перечислены ниже:
1. Шов между пищеводом и тощей кишкой следует накладывать как можно аккуратнее, учитывая слабость тканей пищевода.
2. При пересечении пищевода часто можно наблюдать сокращение его слизистой оболочки. Это может привести к неправильному наложению линии швов анастомоза, когда в один или более швов не захватывается сокращенная слизистая пищевода, что приводит к несостоятельности швов. Для профилактики гаких осложнений некоторые авторы перед выполнением анастомоза накладывают несколько хромированных кетгутовых швов (3/0) между слизистой оболочкой и подслизистой основой, что предотвращает сокращение слизистой. Другие авторы пересекают пищевод в два этапа. На первом этапе пересекают мышечный слой. На втором этапе рассекают слизистую оболочку на несколько миллиметров ди-стальнее пересечения мышечного слоя, так чтобы после сокращения слизистой оболочки их края оказались приблизительно на одном уровне.
3. Очень важно накладывать швы между пищеводом и тощей кишкой на одинаковом расстоянии, без натяжения, чтобы сохранить жизнеспособность стенки пищевода.
4. Если хирург получает хорошие результаты, оперируя по какой-либо методике, следует продолжать оперировать именно этим методом, потому что это значительно надежнее, чем частое изменение техники операции.
5. Избранный хирургом метод реконструктивной операции для восстановления пассажа пищи по пищеводу должен приводить к минимальным функциональным нарушениям в послеоперационном периоде.
6. После восстановления непрерывности пищеварительного тракта больной во избежание истощения должен обеспечиваться достаточным питанием.
7. Следует избрать такой метод операции, который бы не приводил к забросу желчи и панкреатического секрета в пищевод.
8. При формировании эзофагоеюноанастомоза желательно соединять терминальный отдел пищевода с латеральной стенкой гощей кишки. Это обусловлено тем, что кровоснабжение конца тощей кишки несколько хуже, чем ее латерального края.
9. Для получения наилучших функциональных результатов и поддержания уровня послеоперационной летальности на уровне не более 10% тотальная гастрэктомия с восстановлением непрерывности пищеварительного тракта должна выполняться опытной хирургической бригадой.
В настоящее время для реконструкции пищеварительного тракта после тотальной гастрэктомии используют следующие виды оперативных вмешательств:
a. Эзофагоеюностомия по Roux-en-Y с использованием ручных швов.
b. Формирование эзофагоеюноанастомоза Roux-en-Y с применением механического шва.
c. Анастомоз между терминальным отделом пищевода и петлей гощей кишки с дополнительным еюноеюноанаатомозом.
d. Интерпозиция сегмента тощей кишки между пищеводом и двенадцатиперстной кишкой.
Эзофагоеюностомия.
В настоящее время это наиболее часто выполняемая после тотальной гастрэктомии реконструктивная операция. Выполнение других, более сложных операций, не улучшило результатов, достигнутых при использовании этой методики. Если еюноеюноанастомоз накладывают на расстоянии около 60 см от эзофагоеюностомы, то заброс желчи и панкреатического секрета в пищевод наступает крайне редко. Наилучшие результаты получают при тщательном отборе и достаточной длине петли тощей кишки, чтобы анастомоз был сформирован без натяжения и без нарушения кровоснабжения. Для выбора наиболее подходящего участка кишки можно использовать транслюминацию. Можно формировать анастомоз между тощей кишкой и пищеводом «конец в конец», но лучше конец пищевода соединять с латеральной стенкой тощей кишки. Петлю тощей кишки можно провести как спереди, так и сзади поперечной ободочной кишки. Эзофагоеюноанастомоз может выполняться с использованпем как ручного, так и механического шва. Мы опишем формирование терминолатерального эзофагоеюноанастомоза с использованпем ручных швов. Далее будут представлены некоторые моменты операции с использованием механического шва.
Эзофагоэнтероанастомоз что это означает
Послеоперационные признаки (абсцесс, свищ, сепсис) выхода кишечного содержимого (или контрастного вещества) за пределы кишки, что может явиться результатом расхождения швов анастомоза или пропущенного дефекта стенки кишки. Диагноз основывается на клинических (таких как перитонит, сепсис, субфебрильная лихорадка, лейкоцитоз, необъяснимая тахикардия, продолжающаяся дисфункция кишечника) или рентгенологических данных (в бессимптомных случаях, например, при наличии проксимальной стомы).
Осложнения: прямая кишка (5-10%), ободочная кишка (2%), тонкая кишка (1%), илеоанальный резервуарный анастомоз (4—5%), континентная илеостома (12%).
а) Дифференциальный диагноз. Абсцесс, несвязанный с кишкой (например, нагноившаяся гематома после разлитого перитонита).
б) Причины. Технические погрешности, недостаточное кровоснабжение, натяжение, плохое состояние тканей (после лучевой терапии, мальнутриция, инфекция), действие лекарственных средств (стероидов, бевацизумаба, химиопрепаратов), курение.
в) Обследование несостоятельности анастамоза кишечника
Необходимый минимальный стандарт:
• Оценка общего состояния больного: тахикардия (изначально может быть единственным симптомом), сепсис с дисфункцией органов, нестабильность гемодинамики, нутритивный статус и т.д.
• Обследование живота: перитонеальные симптомы без четкой локализации, кишечные свищи, состояние раны.
• Несостоятельность заподозрена, но не подтверждена: ирригоскопия с водорастворимым контрастом, КТ.
Сопутствующие факторы, влияющие на принятие решения:
• Ретроспективный анализ интраоперационных трудностей.
• Текущее состояние больного (общее, местное)?
• Несостоятельность: отграниченный или разлитой перитонит?
• Шансы на успех при формировании повторного анастомоза?
• Время, прошедшее после последней лапаротомии?
г) Ведение пациента с несостоятельностью анастамоза кишечника
Консервативное ведение:
• Отграниченная несостоятельность => дренирование абсцесса под контролем КТ => отграниченный свищ.
• Несостоятельность при отключенной кишке => повторное обследование через 6-12 недель.
• Несостоятельность с сепсисом => поддерживающие меры в дополнение к операции: НГЗ, антибиотикотерапия, оптимизация сердечной деятельности и функции дыхания.
• Ранняя симптоматическая несостоятельность ( релапаротомия для поиска дефекта:
— Отключение и дренирование.
— Разобщение анастомоза, формирование стомы (по типу операции Гартссмана).
— Повторное формирование анастомоза (с/без отключения).
— Ригидность стенки кишки в результате воспаления => ни резекция, ни формирование стомы не выполнимы => ушивание дефекта/дренирование или установка дренажа в зоне несостоятельности с целью формирования хорошо отграниченного свищевого хода.
• Поздняя диагностика несостоятельности (> 10 дней) => неблагоприятные условия при релапаротомии:
— Проксимальная стома (если возможно).
— Попытка воздействия на сепсис => установка дренажей (открытая или под контролем КТ) => попытка формирования хорошо отграниченного свищевого хода.
— Разлитой перитонит/сепсис => санационная лапаротомия с широким дренированием.
Видео промывания желудка через назогастральный зонд у взрослого
(оставленный зонд может использоваться для трансназального питания)
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Эзофагоэнтероанастомоз что это означает
М. П Королев., Л. Е Федотов., Г. А. Хусейнов, кафедра общей хирургии с курсом эндоскопии СПбГПМА,
зав. кафедрой профессор М. П. Королев
г. Санкт-Петербург
На кафедре общей хирургии с курсом эндоскопии СПбГПМА накоплен опыт лечения 92 больных со стриктурами пищеводно — кишечных и пищеводно — желудочных анастомозов.
В прошлом, все они перенесли операции по поводу различных заболеваний, в основном это рак пищевода различной локализации — 53 пациента, рак желудка – 29, химический ожог пищевода – 8, рубцовая стриктура нижней трети пищевода – 1, хроническая гигантская язва кардиального отдела желудка – 1. У 51 из 92 больного анастомоз носил инвагинационный характер, у 28 человек он был сформирован «конец в конец» однорядным швом, у 2 – сшивающим аппаратом и у 11 методика его формирования не была описана в протоколе операции.
Диаметр сужения составлял от 0,2 до 0,7 см, а протяженность стриктуры находилась в пределах 0,5 – 3,0 см, при этом стриктуры инвагинационных анастомозов были протяженнее неинвагинационных.
Количество пациентов с пищеводно-желудочными анастомозами равнялось 65, пищеводно-кишечными – 27.
Проведенное у всех больных диагностическое эндоскопическое исследование, сочетающееся с забором материала на гистологическое исследование, позволяло безошибочно ставить правильный диагноз. При значительном сужении анастомоза, выполнялось сочетанное рентгеноэндоскопическое исследование. Эндоскоп подводится к верхнему краю анастомоза, затем в инструментальный канал аппарата заводится катетер, который проводится через стриктуру. В катетер нагнетается водорастворимое контрастное вещество. Продвижение контраста и заполнение им нижележащей зоны анастомоза позволяет оценить зону анастомоза и протяженность стриктуры.
Лечение больных с рубцовой стриктурой пищеводного анастомоза мы всегда начинали с попытки ее бужирования под контролем эндоскопа. Бужирование пищеводно-желудочных анастомозов технически более простое. Это обусловлено тем, что в этих случаях буж, проходя стриктуру, попадает в желудочную трубку, имеющую достаточно прямой ход и проведение его за стриктуру достаточно безопасно и осуществляется на всю рабочую часть бужа. Выполнение бужирования эзофагоэнтероанастомоза более затруднительно, так как возможность проведения инструмента за пределы анастомоза ограничено извилистостью кишки. При первом же сеансе нам удается достичь калибров бужей в промежутке от № 30 до № 40. Последующие сеансы бужирования проводились 3 раза в неделю. После выписки из стационара больные находились на поддерживающем бужировании 1 раз в неделю в течение месяца. Данное лечебное пособие нами успешно проведено у 40 больных (29 –ЭГА, 11 – ЭЕА).
Таким образом, показаниями к бужированию были наличие ЭГА и ЭЕА с невыраженной рубцовой стриктурой, сформировавшейся в срок до двух месяцев после операции.
У 6 больных лечение заключалось в баллонной пневмодилатации рубцовой стриктуры. Применение этой методики часто не требовало сочетания с другими эндоскопическими методами. Первый сеанс дилатации проводился в операционной под эндотрахеальным наркозом, что позволяло безболезненно и более эффективно выполнить процедуру. Ограничивало применение дилататора наличие плотного рубца и малый диаметр анастомоза. В своей практике мы применяли отечественные пневмодилататоры, которые доставляются к анастомозу по струне – направителю (рис 1,2).
Диаметр анастомоза менее 5 мм не позволял завести баллон в сдутом состоянии (существующие зарубежные гидродилататоры позволяют проводить их по биопсионному каналу эндоскопа и устанавливать в стриктуру менее 5 мм диаметром). Наиболее частым вмешательством при рубцовых стриктурах пищеводного анастомоза является его эндоскопическое рассечение с последующим бужированием (48 больных.). Сужение у всех больных сформировалось в сроки от 2 до 4 месяцев после операции в виде плотного циркулярного рубца. Воздействие бужом на него не оказывает эффекта. Приложение большего усилия может привести к разрыву в области анастомоза. Эндоскопическое рассечение рубцовых стриктур анастомозов пищевода не рассматривалось нами как самостоятельное отдельное лечебное пособие, потому что оно всегда сочеталось с последующим бужированием. Только их совместное сочетание могло обеспечить хороший клинический эффект. Эндоскопическое рассечение позволяло увеличить диаметр входа в стриктуру и самое главное – рассечь плотную рубцовую ткань. Способ формирования пищеводно – кишечного анастомоза (инвагинационный или неинвагинационный) в достаточной степени обусловливал выполнение эндоскопического рассечения. Так как при инвагинационном анастомозе, его «многослойность» в какой — то мере препятствует перфорации, то при неинвагинационном анастомозе приходится воздействовать на стриктуру более деликатно, а рассечение выполнять на заведомо меньшую глубину, что может приводить к последующим рецидивам стриктур. Избежать рецидива стриктуры позволяет увеличение сеансов бужирования после рассечения (в среднем 10,5 сеансов у каждого больного с неинвагинационным анастомозом и 8 сеансов с инвагинационным).
Для того, чтобы оценить эффективность лечения, мы пользовались несколькими критериями. Это — клиническая, эндоскопическая и рентгенологическая оценка. Клинически — у больных исчезала дисфагия, они могли питаться любой пищей. При эндоскопическом осмотре — эндоскоп диаметром 13 мм свободно проходит через анастомоз. При рентгеноконтрастном исследовании — барий с первого глотка без задержки проходит через анастомоз, отсутствует супрастенотическое расширение пищевода (рис 3).
Сроки лечения составляли от 1.5 до 3 месяцев. Среднее количество сеансов бужирования составило 8, при совмещении с эндоскопическим рассечением – 6, в случае с неинвагинационным анастомозом – 9. Число сеансов дилатации равнялось – 3.
Всем пациентам мы назначали контрольные осмотры раз в полгода. На протяжении первого года мы контролировали 72 из 92 больных.
14 пациентов обратились с жалобами на дисфагию, причиной которой явился рецидив рубцового процесса, им были выполнены повторные курсы эндоскопического лечения. 11 пациентов умерло от рецидива рака. У остальных 47 больных достигнут стойкий клинический эффект.
В срок до двух лет мы наблюдали 47 пациентов. С рецидивами стриктуры обратилось 4 пациентов, умерли по причине основного заболевания 7 больных.
Выводы:
Способ формирования эзофагоэнтероанастомоза
Изобретение относится к медицине, хирургии. Концевой участок кишечного трансплантата визуально делят на три части. Брыжеечный край первого и противобрыжеечный край третьего участков, считая от торцевого отверстия трансплантата, равные по длине концевому отрезку мобилизованного пищевода, сшивают отдельными узловыми швами. Накладывают первый ряд швов между пищеводом и трансплантатом, включая в последний шов брыжеечный край первого и противобрыжеечный край третьего участков. Завершают формирование эзофагоэнтероанастомоза. Средний участок кишечного трансплантата подтягивают к передней брюшной стенке, формируют на нем подвесную энтеростому. Энтеростомическую трубку проводят, минуя зону пищеводного анастомоза вниз по трансплантату. Способ позволяет проводить раннее послеоперационное питание через энтеростому, минуя зону соустья. 2 ил.
Изобретение относится к медицине, преимущественно к онкологии, и может найти применение при лечении больных раком желудка и кардиоэзофагеальной зоны особенно при операциях по поводу генерализованного рака.
Известен способ наложения эзофагоеюноанастомоза, заключающийся в том, что после удаления желудка сшивают приводящее и отводящее колено петли тонкой кишки. Пищевод анастомозируют вертикально конец в бок с отводящим коленом. Приводящим коленом перекрывают переднюю поверхность пищевода и переднюю губу анастомоза, сшивая его с отводящим коленом. Между приводящим и отводящим коленом дистальнее пищеводного анастомоза накладывают анастомоз Брауна (Гилевич Ю.С., Оноприев В.И. Анастомозы в брюшной хирургии. Ставрополь, 1978, с.107).
Способ имеет существенные недостатки.
Натяжение тканей по передней губе приводит к прорезыванию швов и образованию несостоятельности, при формировании анастомоза не предотвращается поступление активного содержимого 12-перстной кишки в зону анастомоза; передняя губа анастомоза не имеет антирефлюксного механизма. Указанные недостатки приводят к возникновению несостоятельности швов анастомоза и рефлюкс-эзофагитов.
Прототипом данного изобретения является методика эзофагоеюностомии, при которой формируют заднюю стенку анастомоза, после чего производят у-образное отключение, а при формировании передней его стенки в зону анастомоза вшивают свободный проксимальный конец отводящей петли, при этом сшивают его переднюю и заднюю стенки соответственно с передней стенкой пищевода и передней стенкой отводящей кишки (А.с. СССР N 1132923, кл. А 61 В 17/00, Касаткин В.Ф. Способ наложения эзофагоеюноанастомоза).
Вышеуказанный способ также не лишен существенного недостатка. Он не предусматривает создание условий для проведения раннего энтерального питания больных.
Целью настоящего изобретения является возможность проведения раннего энтерального питания больных.
Указанная цель достигается тем, что концевой участок кишечного трансплантата визуально делят на три части, брыжеечный край первого и противобрыжеечный край третьего участков, считая от торцевого отверстия трансплантата, равные по длине концевому отрезку мобилизованного пищевода, сшивают отдельными узловыми швами, накладывают первый ряд швов между пищеводом и трансплантатом, включают в последний шов брыжеечный край первого и противобрыжеечный край третьего участков, завершают формирование эзофагоэнтероанастомоза, средний участок кишечного трансплантата подтягивают к передней брюшной стенке, формируют на нем подвесную энтеростому, энтеростомическую трубку проводят, минуя зону пищеводного анастомоза, вниз по трансплантату.
Изобретение «Способ формирования эзофагоэнтероанастомоза» является новым, так как оно неизвестно из уровня медицины, а именно в хирургии желудка и кардиоэзофагеальной зоны.
Новизна изобретения заключается в том, что формирование надежной энтеростомы происходит без дополнительной мобилизации тонкой кишки; энтеростомическая трубка проводится в тонкую кишку, минуя зону анастомоза; петля кишки, используемая для формирования энтеростомы, выключена из пассажа пищевых масс.
В доступных источниках информации России, СНГ и зарубежных не удалось обнаружить аналогичного предложенному способа формирования эзофагоеюноанастомоза.
Изобретение «Способ формирования эзофагоэнтероанастомоза» является промышленно применимым, так как может быть многократно повторено при хирургическом лечении рака желудка и кардиоэзофагеальной зоны в хирургических стационарах, особенно онкологического профиля: онкодиспансерах, научно-исследовательских онкологических институтах.
Способ осуществляют следующим образом.
Формируют У-образное отключение сегмента тонкой кишки по Ру. Концевой участок кишечного трансплантата визуально делят на три части. Брыжеечный край первого 1 и противобрыжеечный край третьего 3 участков, считая от торцевого отверстия трансплантата 5, равные по длине концевому отрезку мобилизованного пищевода, сшивают отдельными узловыми швами 4 (фиг.1). Накладывают первый ряд швов 6 (фиг.2) между пищеводом и трансплантатом, включая в последний шов брыжеечный край первого и противобрыжеечный край третьего участков (фиг.2). Средний участок кишечного трансплантата 2 подтягивают к передней брюшной стенке. Формируют на ней подвесную энтеростому 7. Энтеротомическую трубку 8 проводят, минуя зону пищеводного анастомоза вниз по трансплантату. Завершают формирование эзофагоэнтероанастомоза.
Технико-экономическая эффективность разработанного способа заключается в возможности исключить механические травмы зоны анастомоза, осуществлять раннее энтеральное питание больных, минуя зону соустья. Это позволит улучшить результаты хирургического лечения больных, снизить число гнойно-септических осложнений, сократить койко-день.
Способ формирования эзофагоэнтероанастомоза, заключающийся в наложении соустья конца пищевода в бок У-образно отключенного сегмента тонкой кишки, путем вшивания в зону анастомоза свободного проксимального конца кишки, отличающийся тем, что концевой участок кишечного трансплантата визуально делят на три части, брыжеечный край первого и противобрыжеечный край третьего участков, считая от торцевого отверстия трансплантата, равные по длине концевому отрезку мобилизованного пищевода, сшивают отдельными узловыми швами, накладывают первый ряд швов между пищеводом и трансплантатом, включают в последний шов брыжеечный край первого и противобрыжеечный край третьего участков, завершают формирование эзофагоэнтероанастомоза, средний участок кишечного трансплантата подтягивают к передней брюшной стенке, формируют на нем подвесную энтеростому, энтеростомическую трубку проводят, минуя зону пищеводного анастомоза вниз по трансплантату.