Как подбирать праймеры для днк
Пошаговое руководство по разработке праймеров для qPCR
Разработка праймеров для qPCR — важный шаг при постановке анализа qPCR или обратной транскрипции-qPCR (RT-qPCR). Праймеры qPCR, которые плохо отжигаются или отжигаются более чем к одной последовательности во время амплификации, могут значительно повлиять на качество и надежность результатов.
Кроме того, если вы проводите одностадийную RT-qPCR, обратная транскриптаза будет использовать обратный праймер для запуска реакции транскрипции. В этом случае некачественный праймер приведет как к неэффективной обратной транскрипции, так и к неэффективной амплификации — проигрышная ситуация.
Учитывая вышесказанное, стоит потратить время, необходимое для разработки качественных праймеров для qPCR. В этой статье мы расскажем вам, как именно это сделать!
Хорошая новость заключается в том, что праймеры дешевы, поэтому вы можете легко протестировать несколько различных пар, чтобы выбрать лучшие для вашего эксперимента.
Плохая новость: тестирование праймеров требует времени и терпения, поэтому чем быстрее вы получите пару работающих праймеров, тем лучше.
Инструмент NCBI Primer-BLAST широко используется для дизайна праймеров для qPCR. В Интернете доступно множество других инструментов для проектирования праймеров, включая primer3, а поставщики ПЦР часто предлагают свои собственные бесплатные программы для проектирования.
Ниже описаны основные этапы проектирования праймеров для qPCR с использованием инструмента NCBI Primer-BLAST.
Этапы проектирования будут аналогичными, если вы используете другие программы проектирования праймеров, и приведенная ниже информация должна дать вам представление о параметрах, на которые следует обратить внимание.
Дизайн праймеров для qPCR: Начало работы
Зайдите в базу данных генов Pubmed и выполните поиск интересующего вас гена. В правом углу следующего экрана вы можете отфильтровать по видам.
Нажмите на интересующий вас ген и прокрутите страницу вниз, пока не найдете NCBI Reference Sequence (RefSeq) для вашего гена (например, «NM_203483»).
Нажмите здесь, и на следующем экране в правом углу экрана вы увидите ссылку «Pick primers».
Параметры праймеров для qPCR
Установите следующие параметры праймеров:
Размер продукта ПЦР/ампликона: Для эффективной амплификации подберите праймеры таким образом, чтобы длина ампликона составляла от 70 до 200 п.н.
Количество праймеров для возврата: Это зависит от вас, в зависимости от того, сколько вариантов вы хотите выбрать. Программе не потребуется много времени, чтобы разработать 10 пар праймеров, и это должно дать вам разумный шанс найти подходящую пару.
Температура плавления: Как правило, следует стремиться к минимальной температуре 60°C и максимальной 63°C; идеальная температура плавления составляет 60°C (с максимальной разницей в 3°C в температурах плавления, Tm, двух праймеров). Для определения этих температур можно использовать калькулятор Tm.
Выбор экзона/интрона
Чтобы избежать амплификации загрязняющей геномной ДНК, подберите праймеры таким образом, чтобы одна половина праймера гибридизовалась с 3′-концом одного экзона, а другая половина — с 5′-концом соседнего экзона.
Для этого просто выберите «Праймер должен охватывать стык экзона и экзона». Другие параметры изменять не нужно.
Параметры проверки специфичности пары праймеров: Используйте настройки по умолчанию. Программа будет использовать последовательность RefSeq мРНК выбранного вами организма для конструирования праймеров.
Проверка экрана вывода
Посмотрите на параметры, которые выдала программа, и обратите особое внимание на следующее:
Убедитесь, что 3′-конец праймера содержит остаток C или G, поскольку остатки T и A легче связываются с ДНК неспецифическим образом.
Стремитесь к содержанию GC около 40-60% для обеспечения максимальной стабильности продукта.
Избегайте самокомплементарности, чтобы снизить вероятность образования праймер-димеров. В идеале праймер должен иметь почти случайный набор нуклеотидов.
Теперь выберите два-три лучших праймера и протестируйте их. Удачи!
Если у вас есть другие лучшие советы по разработке праймеров для qPCR, мы будем рады услышать вас в комментариях!
Полимеразная цепная реакция – руководство для начинающих
ПЦР — это метод современных лабораторий молекулярной биологии. Если вам нужно скопировать, упорядочить или количественно определить ДНК, вам необходимо знать ПЦР. Короче говоря, полимеразная цепная реакция — это биохимический метод, использующий термоциклирование и ферменты для быстрого и надежного копирования ДНК.
Эта статья дает краткий, базовый обзор ПЦР с несколькими советами, которые помогут вам избежать наиболее распространенных ошибок. Если вы новичок или имеете мало опыта в проведении ПЦР, то статья для вас. И даже если у вас есть опыт в ПЦР, стоит его немного освежить, и, возможно, получить один или два полезных совета.
Основные ингредиенты ПЦР:
Полимераза

Шаблон ДНК
Это ДНК, для которой вы разрабатываете свои праймеры. Это ДНК, которую ваша полимераза будет читать и копировать. Ваша шаблонная ДНК может быть геномной, плазмидной или кДНК. Чем более целостная и чистая ваша матричная ДНК, тем легче получить хорошие результаты ПЦР. Также имейте в виду, что идеальное количество ДНК будет зависеть от вашего источника, обычно 1 пг — 1 нг плазмидной ДНК или 1 нг — 1 мкг геномной ДНК на реакцию ПЦР.
Праймеры
Праймеры — это короткие фрагменты синтезированной ДНК, которые связываются с вашей шаблонной ДНК. Вам нужно будет разработать один «прямой» праймер и один «обратный». Прямой праймер обозначает начало вашей ПЦР. Последовательность этого праймера такая же, как у вашей ДНК-матрицы 5´-3´. Обратный праймер обозначает конец вашей ПЦР. Последовательность этого праймера является обратно комплементарной ДНК вашего шаблона. Обычно праймеры имеют длину 18-22 пары оснований. Однако важнее, чем их длина, является температура плавления ваших: она должна быть 54-60 ° С и максимально совпадать для обоих праймеров. Существует множество онлайн-калькуляторов, которые могут рассчитывать температуры отжига праймеров, и большинство компаний, которые синтезируют праймеры, предоставляют такие калькуляторы.
Нуклеотиды
Как мономеры ДНК, нуклеотиды необходимы для создания копий. В большинстве экспериментов вы будете использовать дезоксинуклеозидтрифосфаты (dNTP). Вы можете купить их отдельно или в виде смеси dGTP, dCTP, dATP и dTTP. Что бы вы ни покупали, имейте в виду, что нуклеотиды очень чувствительны к циклам замораживания и оттаивания. Поэтому лучше всегда создавать небольшие аликвоты ваших dNTP. Также убедитесь, что вы храните их правильно — не используйте морозильную камеру, которая проходит автоматические циклы размораживания.
Буфер
Большинство коммерческих полимераз поставляются с идеально подобранным буфером, который обеспечивает не только правильный рН, но и всегда содержит добавки, такие как магний, калий или ДМСО, которые помогают оптимизировать денатурирование, ренатурирование и полимеразную активность ДНК.
Термоциклирование

На этом этапе реакцию нагревают до 94-96°С в течение от 30 секунд до нескольких минут. Этот шаг обычно выполняется только один раз в самом начале реакции. Этот шаг важен для активации полимераз горячего старта, если вы используете такую полимеразу, и для денатурации вашей шаблонной ДНК.
На этом этапе смесь нагревают до 94-98°С в течение 15-30 секунд. Этот шаг денатурирует вашу ДНК и праймеры, что позволит им отжигать друг друга на следующем шаге.
На этом этапе температура вашей реакции быстро понижается до 50-64°C в течение 20-40 секунд. Температура на этом этапе должна быть достаточно низкой, чтобы ваши денатурированные праймеры могли образовывать пары оснований с вашей шаблонной ДНК. Но достаточно высокой, чтобы могли образовываться только самые стабильные (идеально спаренные) двухцепочечные структуры ДНК. Обычно эта идеальная температура отжига на несколько градусов ниже чем температура плавления вашей пары праймеров. Также на этом этапе ваша полимераза будет связываться с вашим комплексом ДНК праймер / матрица. Полимераза не начнет чтение, пока температура не повысится на следующем шаге.
На этом этапе реакционная смесь быстро нагревается до 72-80°C. В этот момент полимераза начинает чтение в направлении 5´-3´ и копировать ДНК шаблона в направлении 3´-5´. Более высокая температура на этом этапе уменьшает неспецифические взаимодействия ДНК праймера / матрицы, тем самым увеличивая специфичность реакции. Тем не менее, точная температура будет зависеть от предпочтения вашей полимеразы, поэтому перед экспериментом обязательно прочитайте инструкцию. Длина этого шага зависит от того, как долго будет длиться процесс копирования. Как правило, ДНК-полимераза может копировать 1000 пар оснований в минуту. Поэтому вам нужно выдержать смесь как минимум 1 минуту для копирования 1000 пар оснований. В конце инкубации будут созданы новые двухцепочечные фрагменты ДНК, состоящие как из матрицы, так и из новой ДНК.
Затем шаги 2-4 повторяют 15-40 раз
Чем больше циклов вы проведете, тем больше копий ДНК вы получите. Тем не менее, есть верхний предел. В какой-то момент доступные свободные нуклеотиды становятся ограничивающими, и преждевременно усеченные копии ДНК могут стать проблемой. Так что не жадничайте. Лучше получить меньше чистого продукта ПЦР, нежели большое количество сильно загрязненного.
Это необязательный, но часто рекомендуемый шаг. На этом этапе реакцию проводят при 70-74°С в течение нескольких минут. Обычно вы будете использовать ту же температуру, что и на шаге элонгации. Этот шаг позволяет полимеразам завершить считывание того участка, на котором они находятся в данный момент. Этот необязательный шаг может помочь уменьшить количество усеченных копий в конечном продукте.
Ваша реакция теперь завершена. Поскольку весь процесс может занять несколько часов, реакции ПЦР часто проводят в течение ночи. Рекомендуется запрограммировать ваш термоциклер на хранение продукта ПЦР при температуре 4°С до вашего возвращения. Советуем также прочесть статью о том, как провести ПЦР за 30 минут В это время вы можете проанализировать или использовать свой продукт, или перенести его в более подходящее долговременное хранилище, например, в холодильник.
Четыре бесплатных и простых онлайн-инструмента для разработки ПЦР праймеров
Проектирование и проведение реакций ПЦР в лаборатории стало настолько распространенным явлением, что количество доступных инструментов конструирования праймеров может быть немного подавляющим для новичка (или даже опытного молекулярного биолога!). Ниже приведены четыре онлайн-программы, которые помогут быстро, легко и эффективно разработать дизайн праймеров.
1. IDT OligoAnalyzer: Это простой, но эффективный инструмент для определения физических свойств олиго-последовательностей до 255 оснований. После загрузки последовательности вы получите информацию о ее длине, содержании GC (ГЦ), диапазоне температур плавления, молекулярной массе, коэффициенте экстинкции и оптической плотности. Особенно интересны вкладки формирования структуры шпильки, а последняя версия также позволяет пользователям легко выполнять NCBI Blast без копирования и вставки последовательности.
Проверьте праймер без каких-либо добавленных сайтов рестрикции для клонирования, прежде чем заказывать свой праймер. Поскольку добавленный сайт не связывается с ДНК-шаблоном в первом раунде амплификации, вы должны убедиться, что свойства праймера не меняются значительно и не тормозят реакцию!
2. PrimerBlast от NCBI (Primer3): возможно, один из наиболее уважаемых и универсальных онлайн-инструментов для разработки и анализа праймеров. PrimerBlast был разработан NCBI и сочетает в себе проверенную платформу Primer3 с возможностями Blast. Последний компонент имеет решающее значение, если вы амплифицируете геном организма и хотите минимизировать неспецифическое связывание с генами, сходными с вашей последовательностью-мишенью в геноме.
Для начала вы можете скопировать / вставить шаблон в PrimerBlast или использовать номер доступа в базе данных NCBI. Затем решите, какой из множества параметров вы хотите указать, например приемлемую длину продукта, диапазон температур плавления и выбор экзона / интрона, если вы разрабатываете праймеры для амплификации мРНК (экзоны делятся на некодирующие интроны в кодирующей ДНК). для мРНК).
После отправки и анализа последовательности вы также можете отсортировать результаты по длине праймера, температуре плавления и т. д. Моя любимая часть использования PrimerBlast — это то, что он предоставляет визуальный интерфейс, включая то, где праймеры будут связываться с шаблоном.
3. BatchPrimer3: это отличный инструмент для создания праймера с более высокой пропускной способностью. BatchPrimer3 основан на Primer3 и может создавать широкий спектр праймеров. Результаты предоставляются в виде HTML с визуализацией выравнивания с цветовой кодировкой и могут быть загружены в форме с разделителями табуляции. С помощью этого инструмента вы также можете получить пакетную информацию о физических параметрах предлагаемых праймеров.
4. HYDEN (HighlY DegeNerate primer) : иногда вы не знаете точную последовательность ДНК-мишени, которую вы пытаетесь амплифицировать, например, когда вы работаете с ДНК организма, которая еще не была секвенирована. В этом случае вы можете разработать «вырожденные» праймеры на основе родственных организмов или реверсировать их с помощью аминокислотной последовательности. HYDEN — это загружаемая программа, основанная на командной строке, которая разрабатывает праймеры для многих входных последовательностей.
Конечно, этот список не является исчерпывающим — есть много других доступных вариантов онлайн! Перед тем, как подключать все ваши любимые шаблоны убедитесь, что у вас есть подробное понимание того, как работает ПЦР и ваше конкретное приложение, прежде чем разрабатывать и заказывать учебники для начинающих. Хотя оптимальная конструкция праймера может иметь большое значение для успеха в термоциклере, рассмотрите возможность изменения других ключевых компонентов вашей реакции ПЦР (таких как температура отжига, концентрация магния и используемая полимераза), чтобы еще больше увеличить ваши шансы на успех с особенно трудными шаблонами.
Какие инструменты вы используете для разработки учебника для начинающих и что вам в них нравится? Расскажите нам в комментариях ниже!
Поиск иголки в стоге сена за 10 минут — подсвети себе LAMPой
Многие молекулярно-биологические операции напоминают поиск иголки в стоге сена
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Современные биологи в большинстве своём работают с генами. Ген — участок молекулы ДНК, кодирующий белок или РНК. Изучая активность гена и изменения в его работе, чаще всего пользуются методом полимеразной цепной реакции (ПЦР) и различными её модификациями. Метод позволяет найти ген и сделать множество его копий. Однако прибор и реактивы для проведения ПЦР дóроги, а время, необходимое на реакцию, составляет около двух часов. В данной статье описывается аналог полимеразной реакции — LAMP (loop-mediated isothermal amplification), позволяющий провести то же исследование в 10 раз быстрее, дешевле и, что крайне важно, более специфично. Также рассмотрены перспективы применения LAMP в фундаментальных и клинических исследованиях.
Конкурс «био/мол/текст»-2014

Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Как это здорово звучит: я занимаюсь генетикой, работаю с ДНК, РНК, получаю ГМО. Как это странно выглядит: я добавляю прозрачные растворы к прозрачным растворам, ставлю в сложный прибор, который показывает, сколько у меня ДНК, или из каких нуклеотидов она состоит. Конечно, целая молекула ДНК, особенно в связи с белками, поддерживающими её структуру (aka хромосома), ещё видна в микроскоп, но представьте себе один ген, один небольшой участок хромосомы. Чтобы работать с одним геном, его нужно сначала найти. Представьте, найти определённый участок, состоящий из 10000 букв (нуклеотидов) среди 3 миллиардов таких же букв! Разница в пять порядков. Это действительно сравнимо с поиском иголки в стоге сена.
Первым механизм такого поиска в 1983 году запатентовал Кэри Мюллис (Kary Mullis) [1]. Он предложил наработать множество копий исследуемой ДНК. Чтобы понять метод Мюллиса, широко известный как полимеразная цепная реакция (ПЦР) [11] и используемый уже более 30 лет практически в каждой лаборатории мира, обратимся к истокам. Как происходит увеличение количества ДНК в живом организме в естественных условиях.
Репликация ДНК
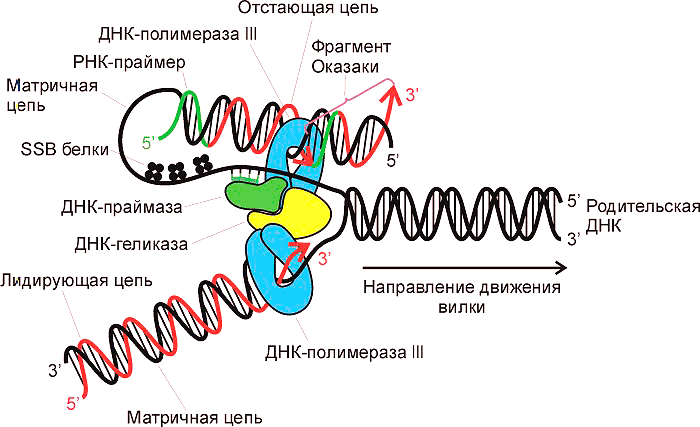
Природный механизм удвоения ДНК, который происходит перед делением каждой клетки, называется репликация (aka редупликация). Надо сказать, что до сих пор не все белки-участники данного процесса изучены, что говорит о его сложности. Главное, что происходит при репликации — сборка дочерней цепи ДНК на половине материнской. Напомню, что ДНК представляет собой двойную спираль, а информативная часть — азотистые основания — скрыта внутри спирали. Задача удвоения ДНК состоит в том, чтобы правильно собрать нуклеотиды в новую цепь и получить две идентичные молекулы. Собирает нуклеотиды фермент ДНК-полимераза. Но как ей добраться до азотистых оснований, скрытых в материнской цепи? Ответ прост — расплести цепи. Исполнение же трудно и требует участия целого ряда ферментов — гираз, лигаз, топоизомераз, белков, связывающих одиночную нить ДНК и препятствующих её повторному воссоединению (SSB белков). Тем не менее, ансамбль белков справляется с этой задачей (рис. 1). Итак, есть ДНК-полимераза, ей доступны азотистые основания матрицы, но что-то синтез не идёт.
Рисунок 1. Репликация ДНК. Обратите внимание, как много белков участвует в этом процессе.
Дело в том, что полимераза — фермент привередливый, синтез ДНК «с нуля» и не пойдёт: необходима затравка (праймер) — свободная OH-группа предыдущего нуклеотида или какого-либо белка. Теперь, присоединяя нуклеотиды к праймеру, ДНК-полимераза может копировать материнскую цепь.
Амплификация ДНК (ПЦР)
Амплификация — это искусственная многократная реплицкация. Итак, процесс репликации ДНК в клетке даже на настоящий момент изучен не до конца. Что же придумал Мюллис 30 лет назад? Как он смог скоординировать, по меньшей мере, десяток ферментов в один момент, о существовании части которых он даже и не знал? Представьте себе, никак. Он взял всего один фермент — ДНК-полимеразу. Доступ к азотистым основаниям обеспечил не белками, а плавлением. («Плавление» ДНК — неферментативное расхождение цепей при нагревании до 92–95 °C.)
Мы помним, что нужен праймер, чтобы «привередливая» полимераза начала работать. Добавляем 18—30-нуклеотидный фрагмент ДНК, комплементарный границе интересующей нас последовательности. Однако больших успехов все равно не получаем. Реакция идёт, но мы не можем сказать, что удваивается именно наш ген, потому что будут получаться фрагменты разной длины, зависящие от времени работы полимеразы и её активности. Как же понять, какой из образующихся продуктов — искомый?
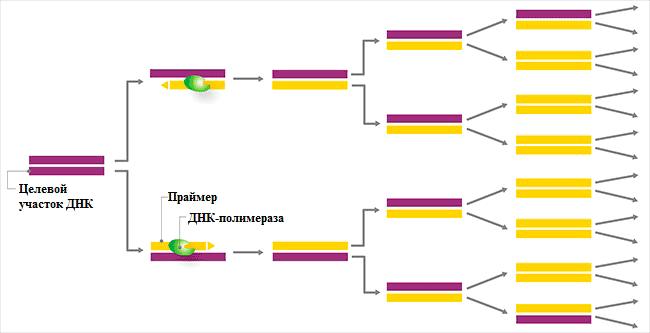
В ответе на этот вопрос и появилась гениальная идея Мюллиса — надо брать не один праймер, а два: прямой (F) и обратный (R). Тогда мы будем знать длину нашего фрагмента и быстро увеличим его количество. Также Мюллис предложил проводить реакцию не один раз, а циклом 30–45 повторов. Математический подсчёт показывает, что количество продукта будет расти как 2 n (рис. 2), где n — число циклов. (А если бы использовался один праймер, то число фрагментов увеличивалось бы просто как n.) То есть через 30 циклов мы получаем в 10 9 (в миллиард) раз больше продукта, чем содержалось в исходном образце (а не в 30 раз больше, как было бы при использовании одного праймера). Почему же такая огромная разница? Дело в том, что при использовании двух праймеров каждый образующийся фрагмент служит матрицей в ходе следующих циклов. В случае одного праймера продукт будет ему не комплементарен и не будет использоваться как матрица в дальнейшем.
Рисунок 2. Схематическое изображение процесса полимеразной цепной реакции. Фиолетовым цветом показана исходная молекула ДНК, жёлтым — образующиеся в ходе реакции молекулы ДНК, идентичные исходной. Видно, что уже после третьего цикла число молекул увеличивается в 8 раз.
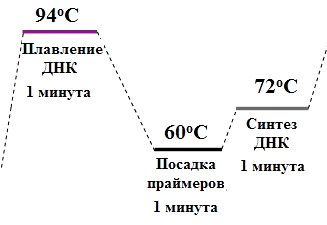
Рисунок 3. Цикл амплификации. Каждый цикл состоит из трёх ступеней: расхождение цепей ДНК, посадка праймеров и синтез новых цепей. Каждая ступень длится около 1 минуты. Таким образом, программа из 30 циклов будет длиться около 90 минут.
Сейчас проведение ПЦР занимает около 2 часов, благодаря использованию особой ДНК-полимеразы [2]. Дело в том, что каждый цикл ПЦР начинается с плавления ДНК на 95 °C (рис. 3), а «простая» полимераза — обычный белок — не выдерживала такой температуры и теряла функциональность, свернувшись, как белок варёного яйца. Поэтому по Мюллису после каждого цикла надо было добавлять новую порцию полимеразы. Рэнди Сайки (Randy Saiki) в 1986 году предложил использовать полимеразу из организма, живущего в термальных источниках — бактерии Thermophilus aquaticus (Taq-полимеразу), выдерживающую такой перегрев и работающую оптимально при 72 °C [3].
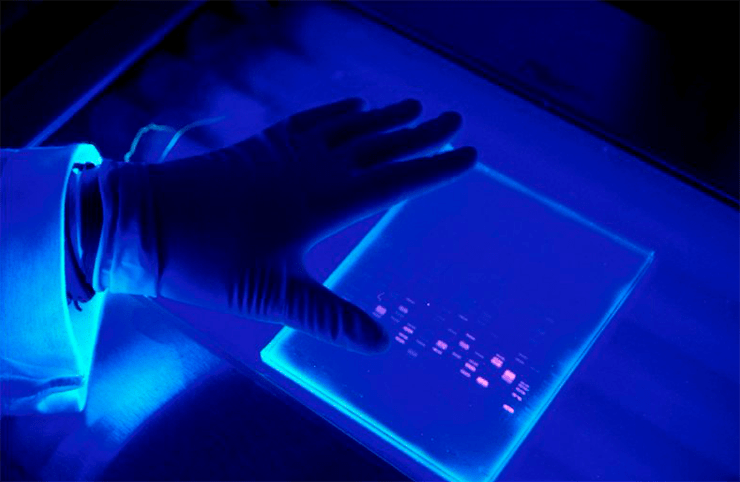
Как же теперь доказать, что, переливая прозрачные растворы, мы всё-таки не потеряли ДНК? Это можно увидеть глазами после 40-минутнтого разделения продуктов ПЦР в геле с помощью электрофореза. Гель — это, своего рода, молекулярное сито, сквозь которое под действием электрического тока идут молекулы: мелкие проходят быстро, крупные — медленно. Кроме того, фрагменты одинаковой длины концентрируются на одном уровне (а мы, следуя рекомендации Мюллиса, специально подбирали праймеры так, чтобы фрагменты были заданной длины). Всё это рассматривается в ультрафиолетовом (УФ) свете после добавления красителей, связывающихся с ДНК. В итоге мы увидим наш один ген или его фрагмент (или ничего не увидим, если искомой ДНК не было) (рис. 4).
Рисунок 4. Результат разделения продуктов ПЦР в агарозном геле. В качестве красителя, связывающего ДНК, использован бромистый этидий. Съёмка сделана в УФ-свете.
Итак, Мюллис предложил увеличить число иголок в разы, чтобы их блеск без труда можно было различить в сене не интересующей нас ДНК. В настоящее время существует множество модификаций ПЦР, применяемых для самых различных целей. Однако у этой реакции есть существенный минус — потребность в специализированном лабораторном оборудовании: термоциклере-амплификаторе (приборе, способном быстро менять температуру раствора столько раз, сколько нам нужно), камере для электрофореза и т.д. А если этого нет? Можно ли всё провести при одинаковой температуре — например, на водяной бане или в простом термостате? Оказалось, что это возможно, и есть целый ряд методов изотермической амплификации. Слово изотермическая означает, что реакция идёт при постоянной температуре. Наиболее быстрым, специфичным, дешёвым и часто используемым методом является опосредованная образованием петель изотермическая амплификация (loop-mediated isothermal amplification, LAMP). Итак, прольём свет этих LAMP.
Рисунок 5. Схематическое изображение метода LAMP. Для понимания метода вспомните, что синтез идёт от 3′- к 5′-концу (маленькие горизонтальные стрелочки), а обратно — никогда.
Метод LAMP, как и ПЦР, использует термостабильную полимеразу. Примечательно, что, когда искали полимеразу для реакции Мюллиса, нашли две — Taq, которая используется и по сей день для ПЦР, и Bst (из Bacillus stearothermophilus). Было показано, что Bst-полимераза нестабильна и быстро выходит из строя при 95 °C, да и документация к Taq была лучше. Однако у Bst есть преимущество перед Taq: она вымещает вторую цепь ДНК сама, без участия ферментов или использования высоких температур. Использование Bst в методе LAMP позволило проводить реакцию на 30–40 минут быстрее, поскольку исчезает потребность в первом шаге цикла, но это ещё далеко не всё.
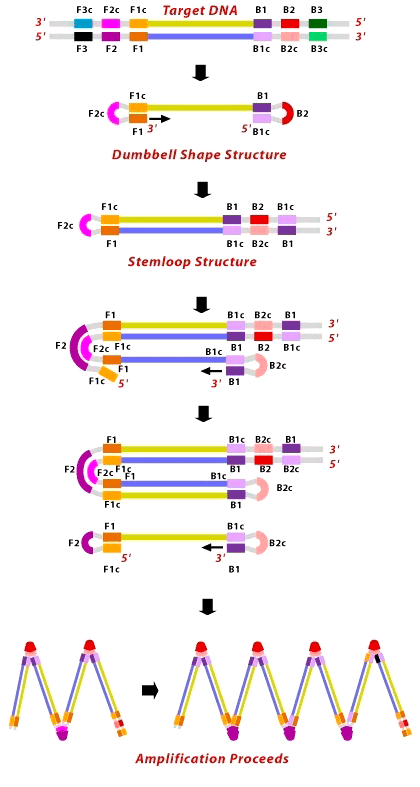
В названии метода, кроме постоянства температуры, упоминаются ещё некие петли. Давайте разберёмся. Метод LAMP, описанный японским учёным Цугунори Нотоми (Tsugunori Notomi) в 2000 году [4], подразумевал использование четырех праймеров (пары внутренних и пары внешних), узнающих шесть различных участков искомой ДНК. Внутренние праймеры подобраны таким образом, чтобы сформировать те самые петли на концах искомого фрагмента (рис. 5). Чтобы это удалось, к 5′-концу праймера F2 прикреплена вторая часть, комплементарная F1 части матрицы, — F1c, то есть фрагмент F1c—F2 — это и есть внешний праймер, длинной до 50 нуклеотидов (F от forward, «прямой»). В результате, как только новая цепь ДНК останется одна, из-за вымещающей активности Bst-полимеразы её конец тут же замкнётся в петлю. То же происходит и с праймерами, садящимися на противоположный конец матрицы (B от backward, «обратный»). В конечном итоге, появится одноцепочечный фрагмент ДНК с петлями с обеих сторон — гантелевидная структура (dumbbell structure). На этом завершается первый шаг LAMP.
После получения «гантельки» с одного из её концов (3′) полимераза продолжает синтез к другому (5′), образуя «рукоятку» (stemloop). Концы «рукоятки», оказавшись в одноцепочечном состоянии, замыкаются в петли, продолжая синтез. Так постепенно формируются загзагообразные продукты.
Внешние праймеры (F3 и B3) необходимы лишь в самом начале реакции для разделения двух материнских цепей.
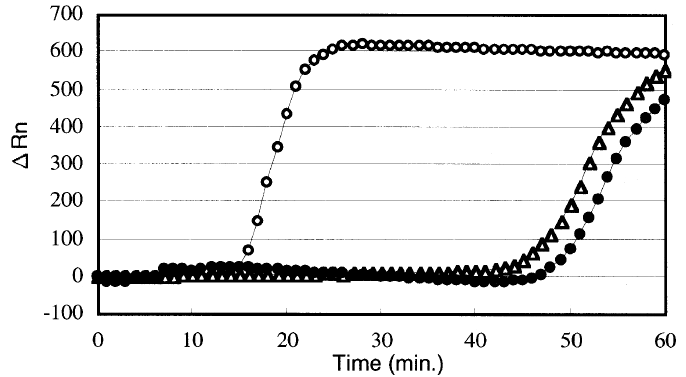
Такой метод позволяет быстрее нарабатывать продукт и длится от часа до получаса. Однако уже через два года этим же учёным удалось усовершенствовать свой метод, добавив ещё одну пару праймеров — петлевые праймеры [5]. При их использовании, предположительно, идёт наработка продукта с петель в обе стороны, а не в одну, как в оригинальном методе. Как показывает график из этой работы (рис. 6), уже через 10–20 минут можно было регистрировать продукт в достаточном количестве.
Рисунок 6. Сравнение эффективности LAMP с добавлением петлевых праймеров (пустые кружки) с классической LAMP (зачернённые кружки). По оси Х отложено время, по оси Y — изменение интенсивности флуоресценции (по нему можно судить об изменение количества ДНК в образце).
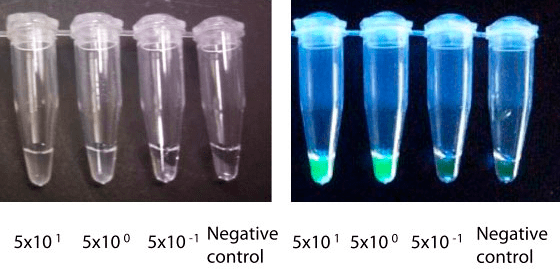
Да, как же регистрировать продукт в этой реакции? Представляете, просто взглянув на пробирку (не нужно ждать 40 минут), можно увидеть помутнение — это выпадает осадок пирофосфата магния. Ионы магния входят в состав реакционной среды, помогая работать Bst-полимеразе, а пирофосфат-ионы высвобождаются из нуклеотидов при синтезе цепи. Для верности можно также добавить краситель, связывающий ДНК и осветить УФ (рис. 7).
Рисунок 7. Визуализация результатов LAMP. Это одинаковые пробирки в естественном (слева) и УФ-свете (справа). В подписях указано исходное число молекул ДНК в пробе. Интересно, что даже 5 молекул ДНК в 25 мкл детектируются этим методом.
Сравнение ПЦР и LAMP
Таким образом, используя метод LAMP, можно ответить на вопрос «Присутствует ли интересующий нас ген в пробе?» за 5–20 минут [7], в то время как при использовании ПЦР ответа придётся ждать около двух часов, не считая времени на электрофоретическое разделение продуктов. Но, как известно, спешка хороша при ловле блох, а для научного исследования куда важнее точность и специфичность (то есть амплификация всегда и только той последовательности ДНК, которую мы задали, а не просто похожей).
Однако и тут LAMP опережает ПЦР. LAMP более специфичен, потому что ему необходимо узнать целых шесть участков в искомой молекуле ДНК, а ПЦР — только два (которые находятся непосредственно под праймерами). Но, что даже более важно, на LAMP не оказывает влияния присутствие биологических компонентов, зачастую не позволяющих провести ПЦР [8]. Исследуемый образец (например, слюну) можно заносить в реакционную смесь без очистки и искать гены вируса [6]. Благодаря этому свойству, LAMP используется в клинической практике для выявления патогенов человека и животных [9], определения пола коров до имплантации зародыша и даже нахождения метастазов прямо во время хирургической операции [10]. Метод прост в исполнении, дёшев (в отличие от других методов изотермической амплификации) и не требует ни сложной техники, ни обязательных биологических знаний.
| Критерий | ПЦР | LAMP |
|---|---|---|
| Необходимость плавления ДНК | + | − |
| Температура (°C) | 94; 55–60; 72 | 60–65 |
| Устойчивость к биологическим компонентам | − | + |
| Продолжительность (минут) | 90–120 | 5–20 |
| Регистрация продукта | электрофорез | невооружённым глазом |
Какой из методов лучше применять, зависит от эксперимента. Если исследователь постоянно меняет праймеры, условия или изучаемый ген, то ПЦР будет удобнее. Несмотря на то, что она занимает больше времени, на деле два часа едва хватает, чтобы приготовить смесь для следующей реакции и занести пробы в биохимический планшет. Если же речь идёт о предотвращении пандемии, и необходимо как можно быстрее определить присутствие известного вирусного агента, то, конечно, LAMP. Его можно применять, например, для мониторинга здоровья пассажиров в аэропортах стран, из которых возможно занесение вируса.
В заключение хочу отметить интересную тенденцию научных исследований, проявившуюся в эволюции методов амплификации нуклеиновых кислот. Как указано выше, во время создания ПЦР был выбор между двумя полимеразами: Taq и Bst. Мюллис выбрал Taq и построил свой метод на ней. А Нотоми спустя двадцать лет вернулся к Bst и придумал ещё более мощный метод LAMP.