Как поддерживать иммунитет при туберкулезе
Как поддерживать иммунитет при туберкулезе
Проблемы медицинской микологии.- 2005.- Т.7,№1.- С.3-13.
Иммунитет при туберкулезе и аспергиллезе (обзор)
1 Институт биоорганической химии РАН, Москва; 2 НИИ медицинской микологии им. П.Н. Кашкина, Санкт-Петербургская медицинская академия последипломного образования; 3 НИИ фтизиопульмонологии МЗ РФ, Санкт-Петербург, Россия
В обзоре представлены данные о механизмах патогенеза развития туберкулеза и инвазивных форм аспергиллеза.
IMMUNITY IN TUBERCULOSIS AND ASPERGILLOSIS (REVIEW)
The mechanisms of pathogenesis of tuberculosis and invasive aspergillosis are discussed in this review.
Введение
Туберкулез и аспергиллез являются двумя хроническими инфекциями легких, имеющих много общего в основе патогенеза [1]. Обе инфекции могут протекать как манифестно, так и развиваться незаметно. Симптомы заболевания варьируют от субклинических проявлений до острого сепсиса с легочной недостаточностью, когда пациенты нуждаются в реанимационных мероприятиях. Туберкулез вызывают патогенные бактерии Mycobacterium tuberculosis при определенных условиях, и прежде всего при снижении эффективности функционирования иммунной системы. Aspergillus является условным патогенном, который наиболее часто вызывает инвазивные формы аспергиллеза у больных с серьезными иммунодефицитными состояниями, например, реципиентов трансплантатов органов и тканей, больных СПИДом, онкологических и прочие пациентов, получающих иммуносупрессивную терапию [2,4,5,6]. В последние годы накоплены данные о том, что некоторые формы аспергиллеза (хронический инвазивный аспергиллез и аспергиллема) все чаще выявляют у иммунокомпетентных больных, что связывают как с улучшением диагностики данных патологических состояний, так и с более глубоким пониманием механизмов их патогенеза [7,8]. Частота ассоциации туберкулеза и аспергиллеза достигает 50-76%, в результате чего дифференциальная диагностика этих заболеваний нередко затруднена. В целом, механизмы ответа иммунной системы на M. tuberculosis и A. fumigatus сходные, а разница в частоте данных заболеваний связана с особенностями микроорганизмов, а нет принципиальных различий в ответе на них иммунной системы.
Споры аспергилла дымчатого также способны выживать и созревать в фагосомах, что может приводить к гибели фагоцитов. Созревшие споры прорастают, увеличивая антигенную нагрузку и вызывая иммунный ответ. В результате такого взаимодействия может развиваться заболевание или происходит элиминация антигена и выздоровление. Наличие предсуществующей полости может способствовать формированию аспергиллем, так как доступ клеток иммунной системы в эти полости затруднен.
Далеко не всегда развитие хронических форм туберкулеза и аспергиллеза связано со снижением функций иммунной системы [7,8, 9,10]. И в том, и в другом случаях существует популяция людей, генетически более предрасположенная к этим заболеваниям, что связано с особенностями функционирования системы внутриклеточного клиренса фагоцитов, с дефектами системы гуморальных факторов резистентности слизистых оболочек, с наличием лектина, отвечающего за распознавание углеводов у патогенов, а также ассоциировано с определенными белками, экспрессируемыми генами главного комплекса гистосовместимости (HLA I и II классов) [11,12,13]. Вероятно, определенную роль играют также половые гормоны, так как туберкулезом и аспергиллезом чаще болеют мужчины (69-75%) [14,15].
Неспецифически е факторы устойчивости организма человека, составляющие систему барьерных органов и тканей, клеток и биологических жидкостей одинаково реагируют на разные антигены: распознают их и выводят из организма, предварительно убивая микроорганизмы. Эффективность защитных неспецифических факторов зависит от их компетентности и свойств антигена. Макрофаги, нейтрофильные гранулоциты, моноциты и естественные киллеры (ЕК) могут непосредственно убивать патогены или подавлять их способность к размножению, осуществляя активный выброс внутриклеточных бактерицидных субстанций (лизосомно-катионные белков, супероксидных радикалов, гидролитических ферментов) и/или за счет фагоцитоза с последующим внутриклеточным перевариванием. Система комплемента, лизоцим, β-лизины и ряд других компонентов с той или иной долей успеха служат внеклеточному перевариванию возбудителя.
Механизмы врожденного иммунитета при туберкулезе и аспергиллезе
Роль системы поверхностно-активных белков
Поверхностный слой слизистого эпителия содержит множество гуморальных факторов, способствующих бактерицидности слизистого секрета. Одним из факторов генетической предрасположенности к туберкулезу и аспергиллезу является дефект системы поверхностно-активных молекул (сурфактантов), к которой относят маннозо-связывающий белок (МСБ), белки-сурфактанты A и Д, коллектины и пентраксины. Возможно существуют и другие, еще не идентифицированные, молекулы. MСБ является основным опсонизирующим белком врожденной системы иммунитета [23]. Пониженная экспрессия этого белка выявлена у 70% больных с хроническим инвазивным аспергиллезом. Аналогичный показатель был снижен только у 26% в контрольной группе [24]. Данные по туберкулезу отличаются. Так, среди больных низкий уровень экспрессии МСБ наблюдали крайне редко [25]. Однако была выявлена связь между определенными аллелями генов МСБ, ассоциированными с чувствительностью к туберкулезу [26,27]. Полиморфизм белков системы сурфактантов также может быть ассоциирован с туберкулезом и аспергиллезом. Продукция сурфактантов необходима для поддержания стабильности альвеол и нормального функционирования легких. Мутации в трех разных генах, связанных с продукцией и функционированием сурфактантов, приводят к дефициту этих белков и ассоциированы с рядом острых и хронических болезней легких [28]. Также было показано, что сурфактанты А и Д обладают прямым антимикробным действием и способны ингибировать рост бактерий и грибов за счет увеличения их проницаемости и доступности для связи с коллектинами, которые впоследствии облегчают фагоцитоз бактерий и спор грибов [29]. Дефекты системы сурфактантов выявлены у больных идиопатическим фиброзом, заболеванием, ассоциированным с высоким риском развития аспергиллеза [30]. Еще одним классом молекул, принимающих участие в клиренсе патогенов с поверхности слизистой оболочки легких, являются пентраксины. Пентраксины – это суперсемейство консервативных белков, имеющих циклическую мультимерную структуру. Было показано, что мыши с инактивированным геном, кодирующим длинный пентраксин Ptx3, являются чувствительными к инвазивному аспергиллезу [31]. Ассоциация между экспрессией пентраксинов и туберкулезом также была доказана [32]. В целом, дефекты клиренса поверхности слизистых оболочек могут приводить к более длительному удержанию бактерий и спор гриба, что облегчает их инвазию в ткани за счет продукции ими протеаз и токсинов.
Роль клеток врожденной системы иммунитета в защите от внутриклеточных патогенов
Роль макрофагов
Макрофаги фагоцитируют M. tuberculosis или споры гриба в результате распознавания сахаров патогенов через систему TLR, однако киллинг наблюдают лишь через 20-24 ч, спустя 6-12 ч после завершения фагоцитоза [48,49]. Выявлена различная чувствительность спор к киллингу макрофагами в зависимости от стадии развития. Так, покоящиеся споры менее чувствительны к киллингу и могут выживать и прорастать в моноцитах [50,51].
Основной механизм киллинга патогенов Мф не зависит от реактивных форм кислорода и азота. Так, показано, что макрофаги способны убивать споры в анаэробных условиях. Макрофаги, выделенные из периферической крови человека и культивируемые несколько дней in vitro убивали споры гриба, но у них не был отмечен «перекисный взрыв»; X-CGD мыши (X-linked granulomatous disease), генетически не способные к продукции перекисных форм кислорода, также эффективно убивали споры гриба, как и контрольные мыши [52]. Механизмы, обеспечивающие киллинг бактерий и спор гриба, изучены недостаточно. Определенную роль в этих процессах играют эндосомальные протеазы [53].
Роль нейтрофилов
Прочие клетки, такие как тромбоциты, тучные, эпителиальные, базофилы и эозинофилы, также могут принимать участие в защите против M. tuberculosis и A. fumigatus за счет связывания через TLR рецепторы, усиливая нейтрофил-опосредованную реакцию, а также оказывая повреждающее действие на патогены за счет продукции дефенсинов [62,63].
Суммируя вышесказанное, можно сделать вывод, что способность эффективно удалять патогены с поверхности слизистых, а также устойчивость фагоцитов к внутрифагосомальным возбудителям инфекций являются основными протективными факторами при защите от туберкулеза и аспергиллеза. Нарушения в этих звеньях врожденного иммунитета могут постепенно приводить к заболеванию, особенно на фоне прочих предрасполагающих факторов таких, как лечение кортикостероидами, наличие хронических заболеваний, рак, ВИЧ или трансплантация органов.
Механизмы адаптивного иммунитета при туберкулезе и аспергиллезе.
Иммунный ответ инициируется антигеном и организуется иммунокомпетентными клетками и растворимыми факторами, т.е. состоит из клеточного (Т-иммунитет) и гуморального звена (В-иммунитет), тесно и постоянно взаимодействующими между собой, а также с факторами неспецифической защиты и самим антигеном.
Для активации адаптивного иммунного ответа к тому или иному патогену необходимо представление белковых антигенов, из этого конкретного патогена. Это представление осуществляют антиген-представляющие клетки (АПК) (Рис.2). К АПК относят три типа клеток: дендритные клетки (ДК), Мф и В-клетки. АПК обладают двумя особенностями, по сравнению с прочими клетками организма. Эти клетки синтезируют молекулы главного комплекса гистосовместимости (ГКГС) II класса, которые транспортируются в эндосомальный компартмент этих клеток. Кроме того, эти клетки способны индуцибельно, т.е. зависимо от цитокинового и хемокинового микроокружения, экспрессировать специализированные ко-стимуляторные молекулы, необходимые для активации Т-клеток. К таким ко-стимуляторным молекулам относятся мембран-ассоциированные молекулы В7.1 и В7.2 (CD80/CD86) и ряд таких цитокинов, как интерлейкины (ИЛ) 1, 2, 12 [64,65,66].
Каждый из типов АПК обладает своими уникальными свойствами. Первичный иммунный ответ на патогены наиболее эффективно запускается дендритными клетками. Именно активация ДК чаще всего приводит к появлению Т-хелперов 1 типа (Тх1) [66]. Мф менее эффективны в запуске первичного ответа и чаще ассоциированы с формированием Тх2. Считают, что В-клетки являются индукторами вторичного иммунного ответа и не способны активировать наивные Т-клетки.
Клеточный иммунитет
В модельных экспериментах на мышах показано, что при формировании специфического иммунитета наблюдается два основных типа иммунного ответа, так называемая дихотомия иммунного ответа. Ключевым звеном в активации специфического иммунитета является представление антигена антиген-представляюшими клетками (АПК) и распознавание представленных антигенов Т-хелперами. Именно на этой стадии происходит определение, какой тип иммунного ответа будет формироваться в дальнейшем. Активация Тх1 ведет к формированию клеточного иммунитета, а активация Тх2 опосредует гуморальный иммунный ответ. Дифференцированные Тх1 участвуют в активации CD8 + цитотоксических лимфоцитов, обеспечивающих протекцию против внутриклеточных паразитов, таких как вирусы и микоплазмы. Второй важной функцией Тх1 является их помощь фагоцитам в усилении внутриклеточного клиренса за счет индукции слияния фагосом с лизосомами, что позволяет удалять патогены, персистирующие в фагосомах фагоцитов [72,73]. Активация Тх2 ведет к усиленной продукции антител, наиболее протективных в защите против внеклеточных патогенов, таких как ряд бактерий, паразиты и т.д.
Многочисленными экспериментами показано, что выбор типа хелперов происходит на ранней стадии формирования иммунного ответа и часто является селективным. То есть, при формировании Тх1 происходит подавление предшественников Тх2, и наоборот. Регуляция селекции хелперов осуществляется на уровне продукции определенных цитокинов. Так, известно, что ключевым цитокином, продуцируемым Тх1, является интерферон- g (ИФН-g), а цитокинами, продуцируемыми Тх2, – ИЛ-4, 5, 10 и 13. Продукция ИФН-g Тх1 подавляет продукцию ИЛ-4 Тх2, а продукция ИЛ-10 Тх2 подавляет продукцию ИФН-g Тх1. К настоящему времени нет полной информации, позволяющей определить, как именно происходит выбор типа иммунного ответа. Последние данные, полученные с использованием ДК, служат основой для предположения о том, что основным моментом, приводящим к активации Тх1, является продукция ИЛ-12 АПК. Запуск продукции ИЛ-12 ДК осуществляется через систему TLR. Так, распознавание фрагментов патогенов через TLR2, TLR7 и TLR9 приводит к продукции ИЛ-12, активации Тх1 и формированию клеточного ответа [74,75]. Ключевой фактор, продуцируемый АПК и определяющий активацию Тх2, пока не выявлен. Одной из гипотез является предположение об отсутствии продукции ИЛ-12 АПК, что помогает выжить и дифференцироваться клеткам, продуцирующим ИЛ-4. ИЛ-4, так же как и многие другие лимфокины, является аутокринным фактором, то есть Т клетки не только производят этот цитокин, но и имеют к нему рецепторы на своей поверхности, что позволяет им получать дополнительный сигнал через ИЛ-4. Первичным источником ИЛ-4 при запуске дифференцировки Тх2 могут служить не только АПК, но клетки ближайшего микроокружения, такие как эпителиоциты, тучные клетки, эозинофилы. Подобный процесс может запускаться локально, в месте поступления патогена, что приводит к постепенной сенсибилизации организма [70,71].
Общий механизм специфического ответа иммунной системы при попадании микобактерий и спор гриба в легкие условно можно описать следующим образом (Рис.3). При стимуляции фагоцитирующих клеток различными структурами патогенов клетки продуцируют ряд факторов, таких как ФНО- a, ИЛ-1, ИЛ-6, ИЛ-8, ряд хемокинов, что стимулирует не только фагоцитоз и хоминг нейтрофилов, но также и обеспечивает хоминг лимфоцитов к месту реакции [76,77,78]. Активация Т-лимфоцитов происходит в дренирующих место реакции лимфатических узлах, куда мигрирует часть нагруженных антигеном макрофагов и дендритных клеток (ДК). Макрофаги и ДК являются не только фагоцитами, но также и АПК, объединяющими врожденную и антиген-специфическую приобретенную системы иммунитета. В процессе фагоцитоза АПК «процессируют» антигены туберкулезных микобактерий или гриба и представляют их пептиды на собственной поверхности в контексте молекул ГКГС II класса. Т- клетки хелперного ряда, несущие маркер CD4, распознают именно комплекс молекулы ГКГС II класса с пептидами антигенов. В результате распознавания такого комплекса CD4 + Т-хелперы могут дифференцироваться либо в Тх1, либо в Тх2. Основной функцией Тх1 является организация и поддержание формирования гранулем вокруг зараженных макрофагов. Именно формирование гранулем является протективным фактором при защите от туберкулеза [77,78]. Активированные Тх1 возвращаются в легкие за счет связывания с молекулами адгезии на эндотелии сосудов. Кооперация между макрофагами и Тх1 помогает формированию гранулем вокруг места гибели инфицированных макрофагов.
0 На экспериментальных моделях также показано, что протективный ответ при туберкулезе и аспергиллезе ассоциирован с активацией Тх1 [79,80]. При этом основную роль играют CD4 + Т-клетки. Роль CD8 + Т-клеток в противотуберкулезной защите также обсуждается [81]. У людей чаще регистрируют формирование Тх1, однако есть работы, в которых показано участие в патогенезе туберкулеза и Тх2 [82,83,84].
Гуморальный иммунитет
Роль гуморального иммунитета при туберкулезе и инвазивном аспергиллезе минимальна. Так, у ряда больных антитела к патогенам не выявляют, но иногда могут наблюдать и высокие титры антител [86,87]. На экспериментальных моделях показано, что роль антител в патогенезе этих инфекций не является определяющей для исхода заболевания [88,89].
Клинико-иммунологические проявления туберкулеза и аспергиллеза
При хроническом течении туберкулезного процесса угнетение иммунной системы носит постоянный характер и проявляется в дисбалансе нормального соотношения между субпопуляциями Т-лимфоцитов. Недостаточность клеточного ответа может проявляться в изменении функциональной активности Тх2, что приводит к аллергическим реакциям. Ответ немедленного типа, инициируемый непосредственным взаимодействием антигенов с антителами типа реагинов (IgE), вызывает каскад патохимических реакций, сопровождающихся активацией тканевых энзимов, выбросом гистаминоподобных соединений, повышением сосудистой проницаемости, изменением «белкового» зеркала крови. Такой ответ характеризуют как реакцию гиперчувствительности немедленного типа (ГНТ). При туберкулезе аллергические проявления свойственны преимущественно поражениям глаз, кожи, почек, синовиальной оболочки.
Функционирование сложнейшей системы, обеспечивающей иммунный ответ, контролируется специальными генами иммунного ответа, связанными с главным комплексом гистосовместимости, молекулы которого представлены на лейкоцитах (HLA). Известно, что генетические факторы регулируют взаимодействие между макрофагами, Т- и В-лимфоцитами, функциональную активность всех клонов иммунокомпетентных клеток, т.е. определяют иммунный ответ во всем многообразии. В настоящее время установлено, что лица с определенным набором антигенов локусов В и DR системы HLA чаще болеют либо, напротив, более устойчивы к туберкулезу и аспергиллезу [92,93,94,95]. Частота встречаемости одних и тех же антигенов неодинакова у представителей различных популяций.
Благодарности
Работа выполнена при поддержке фонда РФФИ, грант №04-04-48815, программы президиума Академии наук по фундаментальным исследованиям «Молекулярная и клеточная биология»
Значение иммуномодуляторов в лечении больных туберкулезом легких
В чем особенность течения туберкулеза на современном этапе? Почему в схеме комплексной терапии туберкулеза необходимо использовать иммуномодуляторы? Tуберкулез — это специфическое инфекционное заболевание, развивающееся в ответ на попадание в орган
В чем особенность течения туберкулеза на современном этапе?
Почему в схеме комплексной терапии туберкулеза необходимо использовать иммуномодуляторы?
Tуберкулез — это специфическое инфекционное заболевание, развивающееся в ответ на попадание в организм микобактерий туберкулеза (МБТ). Туберкулез может поражать все органы и системы организма человека, но наиболее часто — органы дыхания. В настоящее время туберкулез признан ВОЗ глобальной проблемой, наносящей колоссальный экономический и биологический ущерб. В России эпидемиологическая ситуация по туберкулезу характеризуется наличием у большинства больных обширных, запущенных форм туберкулеза, с деструкцией и бацилловыделением, эффективность лечения при этом снижена. В сложившихся неблагоприятных условиях основными противотуберкулезными мероприятиями следует считать выявление и лечение больных туберкулезом.
Различные авторы указывают на многообразие факторов, имеющих существенное значение в развитии туберкулезного воспаления. Среди них большая роль принадлежит иммунологическим процессам, в связи с чем туберкулез может быть признан классическим примером иммунного воспаления. Состояние иммунной системы организма является также одной из причин замедленной регрессии специфических изменений и сохранения морфологической активности туберкулезного процесса [9, 16]. Необходимо признать, что традиционная химиотерапия, даже проводимая правильно, вызывает в основном бактериостатический эффект и не в состоянии полностью устранить многообразие морфологических и функциональных изменений туберкулезного характера. Химиотерапия не стимулирует защитные силы организма и не может во всех случаях обусловить полное выздоровление. У большинства больных туберкулезом легких в процессе эффективного лечения достигается нормализация основных показателей иммунитета, но у части больных развивается вторичное иммунодефицитное состояние [10]. Клинически туберкулез у лиц с иммунодефицитом плохо поддается лечению.
Нарушение иммунорегуляции может корректироваться с помощью иммунотерапии. В связи с этим особое значение в современной комплексной терапии туберкулеза имеет использование иммунотропных препаратов с целью стимуляции защитных сил организма и нормализации измененного иммунологического статуса больных туберкулезом [7, 18]. Клинический опыт свидетельствует о благоприятном влиянии на лечение туберкулеза таких препаратов, как спленин, левамизол, диуцифон, препараты тимуса, туберкулин, вакцина БЦЖ. Включение в комплексную терапию больных туберкулезом иммуномодуляторов способствует ускорению нормализации показателей иммунитета и более быстрой регрессии туберкулезного процесса [1, 16]. Актуальной задачей является поиск новых отечественных иммунокорригирующих препаратов и изучение механизмов их действия [2, 4, 5, 6]. В работах Р. В. Петрова, Р. М. Хаитова и соавторов обоснован новый подход к поиску иммунокорректоров с избирательным воздействием на конкретное звено иммунитета, в основе которого заложен принцип создания иммуногенов путем структурного объединения антигена (АГ) и полимера-иммуностимулятора [17]. В качестве иммуностимуляторов предложено использовать водорастворимые полиэлектролиты. Экспериментально доказано, что иммунный ответ на комплексы АГ, конъюгированных с водорастворимыми полиэлектролитами, гораздо выше ответа на сами АГ. В Институте иммунологии МЗ РФ А. В. Некрасовым впервые в нашей стране создан принципиально новый синтетический высокомолекулярный иммуностимулятор — полиоксидоний (ПО; рег. № 96/302/9, патент РФ № 2073031) [14, 15].
ПО, обладающий в большом диапазоне доз широким спектром фармакологического действия и высокой иммуностимулирующей активностью, оказывает выраженное иммуностимулирующее действие на гуморальный иммунный ответ, усиливает кооперацию Т- и В-лимфоцитов. Установлено его преимущественное влияние на фагоцитарное звено иммунитета. ПО активирует функцию макрофагов и лимфоцитов. При этом препарат обладает неспецифическим защитным действием от широкого спектра патогенов, основанным не на прямом угнетении микроорганизмов, а на стимуляции иммунитета. Кроме того, в экспериментах была показана стимулирующая способность клеток ретикулоэндотелиальной системы захватывать и удалять из циркулирующей крови чужеродные микрочастицы [14, 15]. Известно, что ПО, стимулируя иммунные реакции, не нарушает естественных механизмов их торможения, не истощает резервных возможностей кроветворной системы [14, 15]. Показано, что введение ПО приводит к значительному повышению интенсивности антителообразования в ответ на чужеродные АГ различной природы [14, 17].
Установлено также, что токсичность ряда лекарственных препаратов снижается при совместном их введении в организм с ПО.
Отсутствие побочных эффектов и токсичности, четко показанное в эксперименте, указывает на возможность применения ПО в качестве лечебного и профилактического средства при различных заболеваниях, в том числе при хронических заболеваниях легких. ПО может применяться как иммуностимулятор широкого спектра действия, детоксикант, иммуностимулирующий и пролонгирующий носитель для АГ в структуре конъюгированных вакцин нового поколения. В настоящее время на основе ПО созданы гриппозная, бруцеллезная, брюшнотифозная вакцины и ряд аллерговакцин, разрабатываются и другие вакцины, в том числе форсифицированные.
Препарат обладает пролонгированным эффектом. Однократно введенный, он действует в течение одной-двух недель. Клинические испытания препарата на здоровых добровольцах показали хорошую переносимость ПО, отсутствие каких-либо побочных явлений или аллергических реакций [6].
В клинике ПО применялся у хирургических больных с послеоперационными инфекционными осложнениями, с трофическими нарушениями нижних конечностей при сахарном диабете, с острыми и хроническими инфекционно-воспалительными урогенитальными заболеваниями, с аллергией и бронхиальной астмой, с онкологическими заболеваниями [8, 11, 12, 13]. Проведено исследование клинической эффективности и переносимости ПО при лечении пациентов с хроническим бронхитом и хроническим рецидивирующим фурункулезом — заболеваниями, представляющими собой вторичные иммунодефициты с поражением различных звеньев иммунной системы [6].
В литературе имеются лишь единичные сведения об исследованиях эффективности использования ПО в клинике фтизиатрии [3].
Целью настоящей работы явилось исследование клинической эффективности ПО в комплесной иммунохимиотерапии больных туберкулезом органов дыхания.
В соответствии с «Программой исследования эффективности применения иммуномодулятора полиоксидония в комплексной терапии больных туберкулезом органов дыхания» в условиях специализированного стационарного отделения проведена оценка иммунного статуса больных и анализ клинической эффективности комплексной иммунохимиотерапии ПО у 29 больных туберкулезом легких. 16 больных контрольной группы, сопоставимые по возрасту, полу и клиническим формам туберкулеза легких, получали в те же сроки только специфическую химиотерапию (рис. 1).
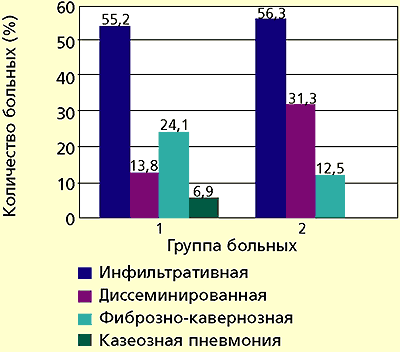 |
| Рисунок 1. Распределение больных основной (1) и контрольной (2) групп по формам активного туберкулеза легких |
Курс иммунотерапии ПО проводился по схеме: 6 мг в сутки внутримышечно два раза в неделю; 27 пациентам было сделано 10 инъекций, двум больным — 4 и 6 инъекций ПО соответственно.
Больным проводилось комплексное клинико-лабораторное, рентгенологическое, инструментальное и иммунологическое обследование. Эффективность ПО у больных туберкулезом легких оценивали в процессе комплексной иммунохимиотерапии, сразу после проведения курса лечения ПО и через месяц после его окончания. Пациенты контрольной группы обследовались в те же сроки. Схемы специфической химиотерапии у пациентов основной и контрольной группы были идентичными.
Анализ влияния иммунотерапии ПО на ликвидацию симптомов интоксикации у больных туберкулезом легких представлен на рис. 2. Необходимо отметить, что улучшение общего самочувствия, уменьшение или исчезновение жалоб со стороны органов дыхания отмечалось больными после первых инъекций ПО.
 |
| Рисунок 2. Динамика ликвидации интоксикации у больных основной (1) и контрольной (2) групп через 1 мес. после окончания курса иммунотерапии ПО |
Наряду с оценкой дезинтоксикационного эффекта ПО поводилось изучение влияния препарата на состояние специфического процесса в легочной ткани у больных туберкулезом. Динамика рассасывания инфильтративных изменений в легочной ткани у больных основной и контрольной групп представлена на рис. 3. Анализ данных, представленных на рис. 3, позволяет сделать вывод о выраженном положительном влиянии ПО на процесс рассасывания специфического воспаления в легочной ткани у больных туберкулезом.
 |
| Рисунок 3. Динамика рассасывания инфильтрации в легочной ткани у больных основной (1) и контрольной (2) групп через 1 мес. после окончания курса иммунотерапии ПО |
Важными являются результаты исследования прекращения бактериовыделения у пациентов через месяц после окончания курса иммунотерапии ПО. Анализ этих данных представлен на рис. 4.
 |
| Рисунок 4. Динамика прекращения бактериовыделения у больных основной (1) и контрольной (2) групп через 1 мес. после окончания курса иммунотерапии ПО |
Результаты изучения другого важного критерия эффективности лечения больных туберкулезом — инволюции полостей распада под влиянием иммунотерапии ПО — представлены на рис. 5. Проанализировав эти данные, можно сделать вывод о положительном влиянии ПО на процесс заживления деструкции легочной ткани у больных туберкулезом.
 |
| Рисунок 5. Динамика инфолюции полостей распада у больных туберкулезом легких основной (1) и контрольной (2) групп через 1 мес. после окончания курса иммунотерапии ПО |
Ниже мы приводим клиническое наблюдение, подтверждающее сделанные нами выводы.
Больной М-ч, 33 года. Заболел подостро в августе — сентябре 1999 года. При обследовании в тубдиспансере установлен диагноз: инфильтративный туберкулез верхней доли правого легкого в фазе распада и обсеменения, МВТ (+). При рентгенотомографическом исследовании: в верхней доле правого легкого — неоднородное затемнение с полостью распада больших размеров, множественными очагами бронхогенного обсеменения в нижележащих отделах легкого, воспалительная «дорожка» к правому корню. В мокроте обнаружены МБТ методом люминесцентной микроскопии. В гемограмме: Нв — 99 г/л, лейкоциты — 7,4х109/л, п — 2%, с — 61%, э — 0%, л — 34%, м — 3%, СОЭ — 40 мм/ч. Проба Манту с 2 ТЕ PPD-L — папула 24 мм. Бронхоскопия: неспецифический гнойный эндобронхит II степени правого Б-2 со стенозом I-II степени.
Больному начали проводить курс противотуберкулезной химиотерапии четырьмя препаратами (изониазид + рифампицин + стрептомицин + пиразинамид). Учитывая данные клинико-лабораторного исследования, свидетельствующие о наличии у больного резко выраженного интоксикационного синдрома, было решено начать лечение ПО. Курс иммунотерапии составил 10 инъекций ПО два раза в неделю по 0,006 г в течение 5 недель. На фоне проводимого лечения у больного уже в первые две недели отмечалось улучшение самочувствия, значительное уменьшение симптомов интоксикации. При рентгенологическом исследовании в динамике отмечалось значительное рассасывание инфильтративных изменений и уменьшение размеров деструкции в верхней доле правого легкого. Через месяц после окончания курса иммунотерапии ПО полость распада четко не определялась.
Заключение: у больного с впервые выявленным инфильтративным туберкулезом верхней доли правого легкого в фазе распада и обсеменения МБТ(+) назначение иммунотерапии ПО позволило добиться полной ликвидации симптомов интоксикации, нормализации гемограммы, прекращения бактериовыделения, значительного рассасывания воспалительной инфильтрации и закрытия деструкции легочной ткани к третьему месяцу химиотерапии.
Поскольку иммунотерапия ПО проводилась в разные сроки от начала антибактериального лечения, представлялось целесообразным оценить ее эффективность при раннем (в течение первых одного-двух месяцев) назначении ПО совместно с антибактериальными препаратами (I подгруппа) и в более поздние сроки (II подгруппа). Первая подгруппа в основном была сформирована из больных инфильтративной формой туберкулеза легких (73,1%), тогда как во II подгруппе преобладали больные фиброзно-кавернозной формой туберкулеза легких (47,4%).
Мы изучали дезинтоксикационный эффект ПО у больных туберкулезом легких в различные сроки от начала антибактериального лечения, а также динамику рассасывания инфильтрата, прекращения бактериовыделения и инволюции деструктивных изменений в легочной ткани. Анализ полученных данных показал эффективность использования ПО с дезинтоксикационной целью на различных этапах антибактериального лечения больных туберкулезом легких. Симптомы интоксикации через месяц после окончания курса ПО ликвидированы у больных I и II подгрупп в 78,6 и 72,7% случаев соответственно. Значительное рассасывание специфических воспалительных изменений в легких у больных после курса ПО чаще отмечалось в I (68,7%), чем во II (30,8%) подгруппе. Абациллирование достигнуто через месяц после окончания курса ПО в I подгруппе у всех больных, а во II подгруппе — у 54,5% больных. Закрытие деструкции легочной ткани через месяц после курса иммунотерапии ПО у больных чаще происходило в I, чем во II подгруппе (46,7 и 18,2% соответственно).
Таким образом, анализ клинической эффективности ПО у больных туберкулезом легких показал преимущества комплексной иммунохимиотерапии, проводимой пациентам с наличием интоксикации, бактериовыделения, инфильтративными изменениями и деструкцией легочной ткани в первые один-два месяца от начала антибактериальной терапии.
Литература
им. Д. И. Менделеева. 1982. 27 (№ 4). С 417-428.