Как повысить тромбоциты у новорожденного
Как повысить тромбоциты у новорожденного
Тромбоцитопения — состояние, при котором количество тромбоцитов ниже 150х109/л. Риск кровотечений зависит от количества тромбоцитов.
• Тяжёлая тромбоцитопения (количество тромбоцитов
Диагностика иммунной тромбоцитопении у детей
Иммунная тромбоцитопения — диагноз исключения, поэтому необходимо уделить большое внимание анамнезу, клиническим особенностям и мазку крови для того, чтобы быть уверенным, что ни один более тяжёлый диагноз не был пропущен. У детей младшего возраста необходимо предположить врождённые причины (такие как синдромы Вискотта-Олдрича или Бер-нара-Сулье). Любые атипичные клинические проявления, как, например, наличие гепатоспленоме-галии или выраженной лимфаденопатии, требуют немедленного исследования костного мозга для исключения острой лейкемии или апластической анемии.
Необходимо провести исследование костного мозга, если планируется лечение ребёнка глюкокортикоидами, поскольку эта терапия может временно маскировать эти заболевания. Также необходимо предположить СКВ. Однако если имеются характерные клинические симптомы при отсутствии изменений в крови, за исключением низкого количества тромбоцитов, и нет намерения проводить лечение, то исследование костного мозга не требуется.
При иммунной тромбоцитопении, за исключением выразительных кожых проявлений и значительно сниженного количества тромбоцитов, состояние хорошее и у большинства пациентов происходит быстрая ремиссия без каких-либо вмешательств.
Ведение детей с иммунной тромбоцитопенией
Приблизительно у 80% детей болезнь протекает остро, доброкачественно и обычно спонтанно разрешается в течение 6-8 нед. Большинству детей помощь может оказываться на дому, госпитализация и не требуется. Подход к лечению противоречивый. Большинству детей не требуется никакая терапия, даже если количество тромбоцитов составляет менее 10х109/л, однако необходимо начать лечение, если есть признаки массивного кровотечения (например, внутричерепного или желудочно-кишечного) или продолжающееся небольшое кровотечение (например, постоянная кровоточивость ротовой полости).
Для лечения используется преднизолон внутрь или иммуноглобулин внутривенно, однако оба они имеют значительные побочные эффекты и не влияют на шанс достижения полной ремиссии. Инфузии иммуноглобулина обычно приводят к более быстрому увеличению числа тромбоцитов, чем глюкокортикоиды. Трансфузии тромбоцитарной массы оставляют для жизнеугрожающих кровотечений, поскольку они поднимают уровень тромбоцитов лишь на несколько часов. Преднизолон должен применяться лишь короткими курсами независимо от числа тромбоцитов. У родителей должен быть свободный 24-часовой доступ в клинику.
Ребёнок должен избегать травм, насколько это возможно, и контактных видов спорта до тех пор, пока сохраняется очень низкое число тромбоцитов.
Хроническая иммунная тромбоцитопения у детей
У 20% детей количество тромбоцитов остаётся низким через 6 мес после установления диагноза, это известно как хроническая иммунная тромбоцитопения у детей. Никакое лечение не проводится до тех пор, пока не произойдет массивное кровотечение. Как и при острой иммунной тромбоцитопении у детей, не должны применяться длительные курсы глюкокортикоидной терапии. Поэтому терапия в основном поддерживающая, ребёнок должен избегать контактных видов спорта, однако должен стимулироваться для продолжения нормальной жизнедеятельности, в том числе посещения школы.
Как и при острой иммунной тромбоцитопении у детей, родителям необходим 24-часовой доступ к медицинской помощи. Семье может пойти на пользу общение с группой поддержки родителей детей, страдающих иммунной тромбоцитопенией. У большинства детей наступает выздоровление в течение 3 лет или стабилизация с сохранением умеренной асимптомной тромбоцитопении. Случаи профузных кровотечений являются редкими и требуют помощи специалистов. Спленэктомия является, вероятно, наиболее эффективным лечением в этой группе пациентов, но приводит к значительному увеличению заболеваемости и в 25% случаев может оказаться бесполезным. Если иммунная тромбоцитопения у ребёнка переходит в хроническую форму, требуется проведение регулярных обследований на наличие СКВ, поскольку тромбоцитопения может предшествовать появлению маркёров этого заболевания.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гемостаз новорожденных
Опубликовано в журнале:
« Практика педиатра » № 1, 2020, стр. 49-52
С.В. Черкасова, канд. мед. наук, ФГБОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» МЗ РФ, г. Москва
Резюме. В периоде новорожденности система гемостаза претерпевает ряд изменений, обусловливающих ее меньшую устойчивость. Особенно это проявляется у недоношенных и детей с малой массой тела к сроку гестации. Одним из повреждающих факторов, действующих на систему гемостаза, является инфекционно-воспалительный процесс. Современные интегральные методы оценки гемостаза, такие как тромбоэластография и тромбодинамика, наиболее полно отражают состояние свертывающей системы.
Ключевые слова: гемостаз, новорожденные, тромбодинамика, тромбоэластография
Summary. In the neonatal period, the hemostatic system undergoes a number of changes, causing its less stability. This is especially evident in premature and low-weight children by the time of gestation. One of the damaging factors affecting the hemostatic system is the infectious-inflammatory process. Modern integral methods of hemostasis assessment, such as thromboelastography and thrombodynamics, most fully reflect the state of the coagulation system.
Key words: hemostasis, newborns, thrombodynamics, thromboelastography
Новорожденные составляют группу высокого риска тромботических и геморрагических осложнений. Механизмы, лежащие в основе их возникновения, до конца не поняты. Гемостатический баланс у новорожденных отличается от такового у взрослых и представляет собой развивающийся процесс. Концентрация белков плазмы также отличается у новорожденных по сравнению с детьми старшей возрастной группы и взрослыми и подвергается быстрому созреванию в течение первых шести месяцев жизни. Факторы свертывания крови материнского происхождения не способны пересечь плацентарный барьер. В периоде новорожденности система гемостаза претерпевает ряд изменений, обусловливающих ее меньшую устойчивость. Особенно это проявляется у недоношенных и детей с малой массой тела к сроку гестации. Тем не менее, несмотря на наличие количественных и качественных отличий практически всех параметров системы гемостаза от параметров у взрослых, здоровые новорожденные в целом имеют клинически нормальный функциональный гемостаз без тенденции к коагулопатии или тромбозу. По-видимому, система гемостаза у новорожденных находится в некотором альтернативном балансе, который отличается от баланса гемостаза у взрослых. Вопрос об устойчивости этого баланса по-прежнему остается открытым. Из-за особенностей гемостаза у новорожденного лабораторная диагностика нарушений этой системы затруднена, и лечащий врач вынужден ориентироваться исключительно на клиническую картину, которая в большинстве случаев проясняется после того, как тромбогеморрагическое осложнение уже развилось и прогрессирует.
Таблица. Неонатальный гемостатический баланс
Локальные и скрининговые тесты фиксируют изменения активности/концентрации отдельных компонентов системы гемостаза, но не показывают, насколько эти локальные изменения повлияли на итоговую способность плазмы к образованию сгустка.
Современные интегральные методы оценки гемостаза, такие как тромбоэластография (рис. 1) и тромбодинамика (рис. 3), наиболее полно отражают состояние свертывающей системы.
Рис. 1. Тромбоэластография
Фаза инициации, интервал R, усиление К, фаза распространения характеризуются углом, а показатель МА характеризует состояние фибриногена и тромбоцитов, выведение средней кривой. На рисунке 2 представлен гиперфибринолиз.
Рис. 2. Гиперфибринолиз
| R min 5,6 9-27 | K min 1,8 2-9 | Angle deg 65,6 22-58 | MA mm 33,1 44-64 | PMA *0* | G d/sc 2,5 3,6-8,5 | EPL % 57,9 0-15 | A mm 3,3 |
Рис. 3. Тромбодинамика
Тромбодинамика с помощью видеомикроскопии позволяет регистрировать образование фибринового сгустка, инициированного иммобилизованным на поверхности тканевым фактором. При этом сгусток первоначально формируется на активирующей поверхности, а затем распространяется в плазме.
Такой подход позволяет учитывать пространственную гетерогенность свертывания крови in vivo, т.е. тот факт, что начало и распространение свертывания происходят в пространственно разделенных областях [2]. Этот тест показал высокую чувствительность к гипо- и гиперкоагулянтным нарушениям, а также к терапии антикоагулянтами.
Внедрение глобальных тестов в рутинную клиническую практику в неонатологии требует проведения большего количества клинических исследований, но для новорожденных, баланс гемостаза которых отличается от такового у взрослых даже в норме, применение глобальных тестов может решить проблему неинформативности стандартных тестов в области предикции тромбогеморрагических осложнений, а также контроля антикоагулянтной и прокоагулянтной терапии.
ЛИТЕРАТУРА
Иммунные тромбоцитопении у новорожденных детей: трудности диагностики и тактика ведения
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Иммунные тромбоцитопении у новорожденных детей:трудности диагностики и тактика ведения
Геморрагические нарушения у новорожденных детей из-за высокого риска тяжелых осложнений и неблагоприятных исходов относят к ургентным состояниям. При этом в неонатологической практике геморрагический синдром по-прежнему остается одним из наиболее сложных для нозологической верификации [1–3].
Долгие годы большинство геморрагических расстройств в неонатальный период связывали с дефицитом витамин К-зависимых факторов свертывания (геморрагическая болезнь новорожденного), ДВС-синдромом, тяжелыми врожденными и постнатальными инфекциями, наследственными коагулопатиями. В дальнейшем результаты исследований (1970–1990 гг.) показали, что причинами неонатального геморрагического синдрома могут быть и другие патологические состояния, в т. ч. и иммуно-опосредованные тромбоцитопении [4].
Ранее нами совместно с сотрудниками лаборатории иммуногематологии Гематологического научного центра РАМН был представлен алгоритм диагностики иммунных тромбоцитопений у новорожденных детей [5, 6]. Однако анализ клинических наблюдений и результаты тестирования врачей, проводимого нами в рамках циклов повышения квалификации, свидетельствуют о том, что практикующие неонатологи и педиатры все еще недостаточно информированы о роли иммунно-опосредованных тромбоцитопений в развитии геморрагического синдрома у новорожденных. Недооценка этиологического значения иммунной тромбоцитопении в генезе неонатальных геморрагических нарушений может стать причиной диагностической ошибки и неадекватного лечения. В качестве примера приводим собственное клиническое наблюдение.
Таким образом, ведущим в клинической картине являлся геморрагический синдром, генез которого необходимо было уточнить. Для этого сразу при поступлении сito! были проведены клинический анализ крови, коагулограмма, исследование электролитов, газов крови и ее кислотно-щелочного состояния (КЩС), рентген органов грудной клетки, а также, учитывая риск внутричерепного кровоизлияния, – нейросонография и осмотр глазного дна. Одновременно был осуществлен забор крови для биохимического анализа, определения уровня С-реактивного белка (СРБ) и прокальцитонина, исследований методами полимеразной цепной реакции (ПЦР) и иммуноферментного анализа (ИФА) для верификации маркеров TORCH-инфекции (исследование проводили в ЦНИИ эпидемиологии Роспотребнадзора). Принимая во внимание тот факт, что результаты ПЦР и ИФА на внутриутробные инфекции будут известны только через 24 ч, одновременно были отобраны образцы крови ребенка, матери и отца для исключения иммунных вариантов тромбоцитопении (исследование проводили в лаборатории иммуногематологии Гематологического научного центра РАМН).
Результаты обследования сito!:
– клинический анализ крови (3-и сут жизни): гемоглобин – 179 г/л, эритроциты – 4,31х1012/л, MCH – 29 пг, MCV – 98 фл, лейкоциты – 14,7х109/л, нейтрофилы – 56%, лимфоциты – 32%, моноциты – 8%, эозинофилы – 3%, базофилы – 1%, тромбоциты – 37х109/л, MРV – 11 фл;
– коагулограмма (3-и сут жизни: АЧТВ – 32 с, ПТИ – 113%, тромбиновое время – 15 с, фибриноген – 3,2 г/л, Хагеман-зависимый фибринолиз – 10 мин, D-димеры – 450;
– нейросонография, рентген органов грудной клетки, глазное дно, электролиты, газы крови и ее КЩС – без особенностей;
– СРБ, прокальцитонин – в пределах нормы.
При заборе капиллярной крови для клинического анализа, газов крови и ее КЩС отмечена пролонгация длительности кровоточивости.
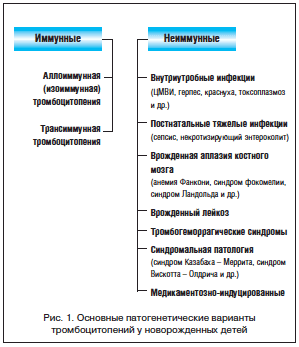
Отсутствие изменений в коагулограмме в динамике (в 1-й и 3-й дни жизни) позволило сделать заключение, что причиной геморрагического синдрома у ребенка является тромбоцитопения без участия нарушений плазменного гемостаза. Тромбоцитопения в периоде новорожденности встречается при целом ряде патологических состояний, поэтому дифференциальный диагноз нередко вызывает затруднения. Определенная практическая помощь при этом может быть получена, если все неонатальные тромбоцитопении разделить на 2 основные патогенетические группы: иммунные и неиммунные (рис. 1).
Причинами неиммунных тромбоцитопений являются внутриутробные и тяжелые постнатальные инфекции, тромбогеморрагические синдромы, врожденный лейкоз, врожденная аплазия костного мозга (анемия Фанкони, синдром фокомелии, синдром Ландольда и др.) и другая синдромальная патология различного генеза (синдром Казабаха – Меррита, синдром Вискотта – Олдрича и др.).
В основе неонатальных иммунных тромбоцитопений лежит передача плоду через плаценту от матери антитромбоцитарных антител. При этом характер антител зависит от патогенеза иммунных изменений в организме матери. Если у матери имеет место аутоиммунная тромбоцитопения или системная красная волчанка, то существует риск трансплацентарного проникновения в организм плода аутоиммунных тромбоцитарных антител. При этом развивается так называемая трансиммунная форма неонатальной тромбоцитопении. В тех же случаях, когда плод наследует от отца тромбоцитарные антигены человека (HPA – Нuman Рlatelet Аntigens), отсутствующие у матери, возможны ее сенсибилизация и последующая передача антител плоду через плаценту с развитием алло-(изо)иммунной неонатальной тромбоцитопении (рис. 1). Значительно реже тромбоцитопении у новорожденных вызываются медикаментами, которые принимает мать (толбутамид, гидралазин, гидантион, азатиоприн, гепарин и др.) или новорожденный (жировые эмульсии для парентерального питания, вальпроаты, гепарин), а также другими причинами.
С учетом сохраняющегося геморрагического синдрома у обсуждаемого ребенка, а также снижения уровня тромбоцитов в динамике было принято решение о необходимости проведения терапии Ig для в/в введения (ИГВВ), не дожидаясь получения результатов иммуногематологических исследований методами ИФА и ПЦР. ИГВВ человека нормальный был назначен из расчета 400 мг/кг на 1 введение, на курс – 5 введений с интервалом 24 ч; курсовая доза – 2 г/кг.
Одновременно с ИГВВ-терапией продолжали проводить дифференциальную диагностику. Анализ данных анамнеза, клинической картины и результатов проведенного обследования уже в 1-е сут пребывания ребенка в Тушинской детской больнице позволил исключить сепсис и некротизирующий энтероколит, тромбогеморрагические синдромы, анемию Фанкони, синдром фокомелии, синдром Казабаха – Меррита, а также побочные действия медикаментов (табл. 1).
Полученные в дальнейшем результаты обследования на TORCH-инфекции свидетельствовали об отсутствии маркеров внутриутробных инфекций. Так, были получены отрицательные результаты ПЦР-анализа (кровь, моча) на вирусы герпеса человека 1, 2, 6-го типов, цитомегаловирус (ЦМВ), вирус краснухи, токсоплазму. Результаты ИФА-анализа свидетельствовали об отсутствии в сыворотке крови ребенка специфических антител к герпес-вирусам, вирусу краснухи, токсоплазме, а также anti-CMV-IgM. Выявленные anti-CMV-IgG были высокоавидными (0,78) и сопоставимыми с материнскими по титру и авидности, что, наряду с отсутствием генома ЦМВ в биологических средах ребенка, позволило исключить у него внутриутробную ЦМВИ. С учетом особенностей обнаруженных в сыворотке крови ребенка антител к ЦМВ (Ig класса G, концентрация и индекс авидности – как у матери) они были расценены как материнские, переданные ребенку трансплацентарно. Таким образом, предположение о внутриутробной ЦМВИ как причине тромбоцитопении не нашло убедительных подтверждений.
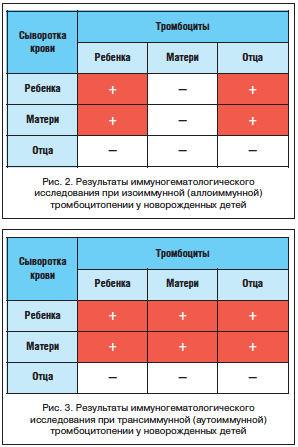
В то же время результаты иммуногематологического исследования наглядно продемонстрировали наличие в сыворотках крови матери и ребенка антител к тромбоцитам ребенка и его отца (рис. 2). Это позволило сделать вывод о том, что причиной геморрагического синдрома в данном случае является аллоиммунная тромбоцитопения, развившаяся в результате изоиммунизации матери HPA плода, который унаследовал их от отца. ИГВВ-терапия была продолжена, что позволило быстро купировать геморрагический синдром и добиться тенденции к восстановлению уровня тромбоцитов (112х109/л – на 7–е сут жизни, после 5-го введения ИГВВ; 141х109/л – к 10–м сут жизни; 148х109/л – к 14-м сут жизни; 164х109/л – к 21-м сут жизни). Катамнестическое наблюдение за ребенком в дальнейшем свидетельствует об отсутствии тромбоцитопении и геморрагического синдрома.
Таким образом, в структуре неонатальных тромбоцитопений особое место занимают иммунные варианты. При этом трансиммунные неонатальные тромбоцитопении наблюдаются в тех случаях, когда у матерей имеет место аутоиммунная тромбоцитопения или системная красная волчанка. В основе патогенеза данной формы неонатальной тромбоцитопении лежит трансплацентарный перенос к плоду материнских аутоиммунных антитромбоцитарных антител класса IgG. По данным разных авторов, у женщин с аутоиммунной тромбоцитопенией риск рождения ребенка с трансиммунной неонатальной тромбоцитопенией достигает 30–75%. При этом тяжелые формы тромбоцитопении отмечаются в 8–15% случаев, а риск внутричерепного кровоизлияния составляет 1,5% [8]. Доказано, что степень снижения уровня тромбоцитов у матери во время беременности не влияет на тяжесть трансиммунной неонатальной тромбоцитопении. К сожалению, до настоящего времени нет единой и общедоступной тактики ведения беременных с аутоиммунной тромбоцитопенией, позволяющей эффективно и безопасно профилактировать развитие трансиммунной неонатальной тромбоцитопении.
Верификация диагноза трансиммунной тромбоцитопении проводится на основании результатов иммуногематологического обследования, в основе которого лежит проведение проб совместимости сыворотки ребенка, матери, отца с тромбоцитами, соответственно, ребенка, матери, отца. Если отмечается взаимодействие сыворотки матери с собственными тромбоцитами, а также с тромбоцитами ребенка и отца и одновременно сыворотка ребенка взаимодействует со своими собственными тромбоцитами, а также с тромбоцитами матери и тромбоцитами отца, то подтверждается трансиммунный вариант (рис. 3). Объясняется это тем, что аутоиммунные антитромбоцитарные антитела матери передаются ребенку через плаценту и еще несколько недель и даже месяцев после рождения будут циркулировать в его кровотоке. Аутоиммунные антитела направлены против общих HPA, присутствующих на тромбоцитах всех людей, и сыворотки крови, в которых они находятся (в данном случае – в материнской и у новорожденного), будут взаимодействовать с тромбоцитами не только матери, ребенка, но и отца. В связи с тем, что в сыворотке крови отца аутоиммунных антитромбоцитарных антител нет, она не взаимодействует ни с собственными тромбоцитами, ни с тромбоцитами ребенка и матери (рис. 3).
Изоиммунная (аллоиммунная) тромбоцитопения встречается с частотой 1 случай на 1 тыс. новорожденных [8]. Патогенез последней во многом сходен с механизмом развития гемолитической анемии новорожденных при резус-конфликте и является результатом проникновения через плаценту к матери тромбоцитов плода. При несовместимости матери и плода по HPA женщина иммунизируется и вырабатывает антитела к антигенам плода, которых нет на ее тромбоцитах, но они унаследованы ребенком от отца. В подавляющем большинстве случаев изосенсибилизация матери происходит к антигену НPА-1а. Образовавшиеся в организме беременной антитела класса IgG к HPA плода в последующем передаются через плаценту и связываются с тромбоцитами плода, что приводит к их повышенному разрушению уже внутриутробно. При этом установлено, что в половине всех случаев внутричерепных геморрагий, обусловленных изоиммунной (аллоиммунной) тромбоцитопенией, кровоизлияния развиваются еще внутриутробно. В целом риск внутричерепных кровоизлияний при данной форме иммунной неонатальной тромбоцитопении, по некоторым данным, достигает 20% [8].
Показано, что развитие изоиммунной (аллоиммунной) тромбоцитопении возможно даже при первой беременности, но наиболее тяжелое течение заболевания отмечается при последующих беременностях от этого же партнера. В связи с этим в случае выявления у новорожденного изоиммунной тромбоцитопении родители должны быть предупреждены о высоком риске рождения детей с тяжелыми формами заболевания. При этом единых подходов к ведению беременных, изоиммунизированных к НPА, нет, но большинство исследователей придерживаются тактики еженедельного введения ИГВВ в дозе 1 г/кг, в некоторых случаях в комбинации с глюкокортикоидами (0,5 мг/кг по преднизолону), начиная с 20-й нед. гестации. Следует отметить, что в ряде клиник достигнуты хорошие результаты при мониторировании уровня тромбоцитов у плодов в пуповинной крови для выявления тех критических случаев тромбоцитопении, когда необходимо внутрипуповинное (под УЗИ-контролем) введение ИГВВ и тромбоцитарного концентрата.
Диагностика изоиммунной (аллоиммунной) тромбоцитопении основана на уточнении анамнеза (указание на предшествующую беременности изоиммунизацию матери из-за неоднократного переливания тромбоцитов и/или рождение детей с изоиммунной тромбоцитопенией), а также результатов иммуно-гематологического обследования. При этом взаимодействие сыворотки крови матери и ребенка с тромбоцитами ребенка и отца при отсутствии взаимодействия их с тромбоцитами матери свидетельствует об изоиммуной (аллоиммунной) тромбоцитопении. Объяснением этому является тот факт, что антитромбоцитарные антитела матери, выработанные на отсутствующий у нее антиген, но имеющийся у ребенка (унаследован от отца), трансплацентарно передаются плоду. Таким образом, сыворотка крови матери и сыворотка крови ребенка содержат эти антитела, мишенью для которых являются тромбоциты ребенка и отца (рис. 2).
Тактика ведения новорожденных детей с иммунными тромбоцитопениями предусматривает необходимость обязательного ежедневного контроля за количеством тромбоцитов в течение раннего неонатального периода. При тяжелой тромбоцитопении обязательны также контроль за неврологическим статусом новорожденного, проведение нейросонографии и осмотр глазного дна в динамике. В тех случаях, когда количество тромбоцитов снижается до 50х109/л и ниже, а геморрагический синдром прогрессирует, показано назначение ИГВВ. Доказано, что терапевтический эффект ИГВВ достигается при курсовой дозе 2 г/кг, которую вводят за 5 ежедневных инфузий (400 мг/кг/введение) или за 2 ежедневных введения (1 г/кг/введение). При отсутствии эффекта от проводимой терапии или при исходно критически низком уровне тромбоцитов показано срочное введение отмытых материнских тромбоцитов [8].
Представленное клиническое наблюдение свидетельствует о том, что при развитии тромбоцитопении у новорожденного ребенка необходимо проводить дифференциальную диагностику с целым рядом патологических состояний. При этом нельзя забывать о том, что в основе неонатальных тромбоцитопений могут лежать иммунные механизмы, а их своевременная верификация позволит избежать диагностических ошибок и неадекватного лечения.