Маб в онкологии что это такое
Маб в онкологии что это такое
После многолетних исследований mAb заняли свое место среди противоопухолевых препаратов. Это стало возможным благодаря техническим достижениям, среди которых следующие.
1. Гуманизация мышиных антител, не приводящая к образованию к ним антител у человека.
2. Получение высокоаффинных антител с использованием бактериофагов.
3. Получение антител различного размера и обладающих различным сродством, а также различной способностью проникать в ткани.
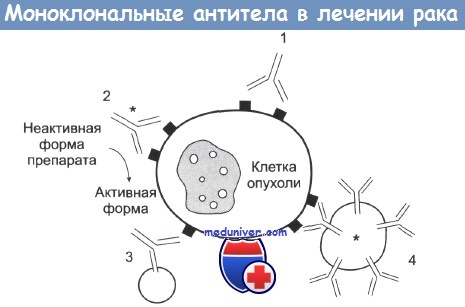
1 — антитело mAb связывается с антигеном опухолевой клетки и вызывает или ее комплемент-зависимую гибель, или гибель в результате антителозависимой атаки макрофагами.
2 — с mAb связан радиоактивный изотоп, токсин или цитокин, вызывающие гибель клетки. Также с антителами может быть связан фермент, участвующий в превращении препарата в активную форму.
3 — биспецифические mAb. Один сайт связывается с опухолевой клеткой, другой — с киллерной эффекторной клеткой.
4 — антитела mAb связаны с липосомами, которые содержат химотерапевтические препараты или токсины.
Существует много способов изменения антител для проявления у них противоопухолевого эффекта. Наиболее часто использующийся прием схематически представлен на рисунке. Подробности приведены в подписи к рисунку. Каждый из способов имеет свои возможности и ограничения.
1. Прямое цитотоксическое действие, вызываемое комплементом или антителами. При этом Fc-часть молекулы антитела должна связаться с Fc-рецептором (I или II) эффекторной клетки, но во избежание проявления ингибирующего эффекта не должна присоединяться к FcRIII. Таким механизмом цито-токсического действия обладает трастузумаб, который связывается с ERB В2 рецепторами опухоли молочной железы, а также ритуксимаб — mAb к CD20, применяющееся для лечении больных с В-клеточной лимфомой.
2. Примером mAb, доставляющих к раковой клетке токсин или радиоактивный изотоп, являются гуманизированные анти-CD33, конъюгированные с калихеамицином (гемтузумаб). Калихеамицин представляет собой агент, связывающийся с ДНК в области малой бороздки. CD33 экспрессируется на поверхности бластных клеток при остром миелоидном лейкозе. При рецидивах, устойчивых к медикаментозным препаратам, гемтузумаб вызывает ремиссию.
Подход с применением токсинов, например рицина, конъюгированных с mAb, не привел к получению клинических препаратов из-за высокой их токсичности для кровеносных сосудов. Присоединение к антителам радиоактивных изотопов (иттрия-90 или йода-131) представляет собой привлекательный путь, поскольку при этом появляется возможность воздействовать на опухолевые клетки, расположенные на некотором расстоянии от клетки-мишени. В настоящее время проходят клинические испытания aнmu-CD20, меченые иттрием-90 и анти-СЕА, меченые иодом-131.
Антитела, содержащие фермент, способный переводить лекарственный препарат в активную форму (ADEPT, antibody-dependent enzyme prodrug therapy), показали обнадеживающие результаты при лечении больных с метастазирующими колоректальными раками. Ферменты, конъюгированные с антителами, проявляют иммуногенные свойства, что ограничивает диапазон назначаемых доз.
3. Подход с использованием биспецифических антител пока еще находится на ранней стадии развития. Присоединение антител к эффекторным Т-клеткам вызывает мощный выброс цитокинов, приводящий к токсическим проявлениям. Это ограничивает применение подобных препаратов.
4. Иммунолипосомальные препараты являются эффективными средствами адресной доставки токсинов или радиоактивных изотопов к клеткам опухоли, однако получение их технически трудно. Эти препараты могут оказаться перспективными в случае, когда необходимо воздействовать на сосудистую систему опухоли.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Гормональное лечение рака предстательной железы
Рецензент материала
Профессор Капранов С.А. — Доктор медицинских наук, дважды Лауреат Государственных Премий Правительства Российской Федерации в области науки и техники, Лауреат Премии Ленинского Комсомола, автор более 350 научных работ по медицине, 7 монографий, и 10 патентов на изобретения по медицине, за 30 лет личного опыта провел более чем 10 000 различных эндоваскулярных операций
Рак простаты – один из самых акутальныхвопросов современной онкомедицины. Ключевая проблема заключается в том, что по уровню летальности злокачественные образования, формирующиеся на предстательной железе, занимают 2-3 место среди прочих видов онкологии. План лечения рака предстательной железы определяет исключительно профильный специалист. Часто обращаются к гормональной разновидности медикаментозной терапии. Подробнее о нюансах и особенностях гормонального лечения рака предстательной железы узнайте из этой статьи.
Причины появления опухолей
Однозначного ответа о том, каковы причины, по которым формируется рак предстательной железы, до сих пор не существует. Можно выделить массу провоцирующих факторов, которые статистически имеют место в жизни мужчин, страдающих от онкологии с такой локализацией. В этот перечень входит:
Внимание! Рекомендуется не только отказаться от животных жиров, но и насытить свой ежедневный рацион соей, фитоэстрогенами, изофлавоноидами, токоферолом, селеном и каротиноидами.
Показания к гормональному лечению
Не всегда гормональная терапия рака простаты является действенным методом. Дать корректное назначение может только лечащий врач, имеющий полное представление о клинической картине ведомого пациента. Востребована гормонотерапия среди мужчин, чей возраст превышает 67-70 лет. Также прибегают к гормональному типу лечения на следующих стадиях развития образования:
Статистически наибольшая эффективность у лечения рака простаты при помощи радикальной простатэктомии с полным иссечением предстательной железы. Однако оперативные процедуры не всегда возможны, как и альтернативная им терапия (химическая, лучевая). Фактически гормонотерапией пользуются как методом, который, если и не помогает излечить рак простаты, то хотя бы продлевает жизнь пациенту.
Разновидности гормонотерапии
Ранее лечение рака простаты посредством гормонального контроля заключалось в проведении двусторонней орхиэктомии (удаление яичек) – это позволяло снизить уровень тестостерона в организме (считается, что именно переизбыток этого гормона в организме является одной из причин рака предстательной железы). Современная онкомедицина исключает необходимость операции, т.к. можно использовать специальные медикаменты, понижающие уровень тестостерона до необходимого в целях лечения.
В здоровом мужском организме содержание тестостерона составляет от 300 до 1000 нг/дл. Медикаментозно этот уровень может быть понижен до 50 нг/дл, но зачастую медики стремятся к минимально возможному уровню гормона – 20-30 нг/дл. Рассмотрим подробнее, какие виды гормональных препаратов используются при лечении поражения простаты.
Агонисты ЛГРГ
Освобождающий лютеинизирующий гормон (ЛГРГ) – это пептидный гормон, направляющий химическую реакцию к мозговым клеткам, вызывая продукцию тестостерона. Агонисты данного гормона отвечают за блокировку его функций, соответственно предотвращая выработку тестостерона половой системой.
Данные медикаментозный вариант лечения является одним из самых распространенных и востребованных при борьбе с раком предстательной железы. Выпускается необходимый препарат не в таблеточном, а в жидком ампульном виде для введения через мышечные или жировые ткани, поскольку пептиды растворяются в ЖКТ, не достигая цели.
Введение препарата осуществляется раз в месяц, либо для его автоматической подачи в организм используется специальный имплантат, вводимый под кожу. В этом случае вещество поступает в организм медленно, а установленный элемент заменяется раз в полгода или год.
Стоит отметить, что в первые 3-4 недели после первичного введения агонистов ЛГРГ уровень тестостерона возрастает, вызывая обострение симптоматики рака предстательной железы. При сильном болевом синдроме или выявлении активного роста опухоли за пределы простаты врач может назначить вспомогательный курс антиандрогенов. Со временем дискомфорт и плохое самочувствие уйдут, а уровень тестостерона начнет снижаться, что и требуется для эффективного лечения.
Побочные эффекты от гормонотерапии с использованием агонистов ЛГРГ:
Крайне популярно при терапии рака с помощью агонистов ЛГРГ использовать схему дискретного дозирования. Суть такого лечения заключается в периодической приостановке введения препаратов и последующем возобновлении. Статистика показывает, что выраженность побочных эффектов при таком подходе уменьшается. Однако преимущества и эффективность такой терапии не изучены до конца.
Антагонисты ЛГРГ
В сравнении с агонистами данный вид препаратов используется крайне редко. На данный момент является изученной и производимой лишь одна форма такого медикамента для гормонотерапии – дегареликс (отечественный вариант – «Фирмагон»). В онкомедицине к нему обращаются преимущественно на 3-4 стадии развития рака предстательной железы с метастазированием в костную ткань. Медикамент позволяет предотвратить компрессию спинного мозга, вызываемую сдавливанием опухолью.
Антагонист ЛГРГ не повышает уровень тестостерона, а симптоматика, которой сопровождается рак простаты, блокируется. Первичная доза составляет 2 шприца по 120 мг, а потом 80 мг через 1 месяц. В дальнейшем процедура повторяется раз в месяц.
Зачастую побочные эффекты такой гормонотерапии:
Случаев передозировки препаратом не выявлено.
Антиандрогены
Это препараты периферического действия, которые блокируют продукцию мужских гормонов надпочечниками. Стоит отметить, что действующие компоненты антиандрогенов вызывают минимум побочных эффектов в сравнении с другими препаратами, используемыми при лечении посредством гормонотерапии. Однако эффективность данных средств снижается, если рак предстательной железы начинает распространяться в ближайшие органы и ткани.
Первичный эффект от использования в сочетании с агонистами ЛГРГ – это сильнейшее увеличение уровня тестостерона в организме, что приводит к росту предстательной железы в размерах и усложнению мочеиспускательного процесса. Если рак простаты метастазировал в костную ткань, то использование антиандрогенов усиливает болевой синдром в костях, повышает риск получения травмы, перелома или ущемления нервных окончаний.
Если же проводить гормонотерапию попеременно, сначала используя антиандрогенные медикаменты, а затем переходя на агонисты ЛГРГ, то количество побочных эффектов уменьшится. Как показывает практика, если от использования антиандрогенов нет эффекта, то временное прекращение лечения способствует улучшению самочувствия пациента. Медицинская терминология определяет для такого состояния название «андрогенное отторжение».
Эстрогены
Синтетически выведенный гормон эстроген (он является сугубо женским) может быть использован в гормонотерапии при лечении у мужчин рака предстательной железы. Снижение уровня тестостерона в этом случае происходит за счет принудительного выделения лютеинизирующего вещества гипоталамусом. Даже при допустимой дозировке в 3-5 мг эстрогеносодержащие препараты провоцируют образование хронических патологий сердечно-сосудистой системы, а также увеличивают риск сердечного приступа.
В качестве защитной меры для организма пациента в процессе лечения медики снижают дозировку до суточного приёма в 1 мг. Но при этом уже через 6-12 месяцев тестостерон вновь начинает накапливаться в организме, что сводит борьбу с раком предстательной железы на нет, если положительный эффект от проводимого лечения не был достигнут ранее.
Орхиэктомия
Если всё же врач прибегает к использованию орхиэктомии, то проводится оперативное вмешательство с иссечением яичек. На их место для сохранения эстетичности в мошонку могут быть помещены искусственные заменители (имплантаты). Подобная операция эффективно уменьшает уровень тестостерона в организме. Вся процедура занимает около 1,5 часа и небольшого реабилитационного периода вплоть до снятия швов со сделанных ранее надрезов. При всей радикальности операции у неё те же побочные эффекты, что и агонистов ЛГРГ.
Однако, как уже было сказано ранее, оперативное вмешательство – это не безальтернативный вариант. Современные медикаментозные подходы к лечению поражения предстательной железы достаточно эффективны. От них отказываются в случае нехватки финансов или продолжительного отсутствия положительных результатов. Также орхиэктомия назначается пожилым пациентам, которые не могут посещать медкабинет с целью проведения гормональной терапии (введения препаратов по графику).
Сочетанная блокировка андрогенов
Гормональная терапия при раке, проводимая по этому принципу, заключается в одновременном приёме медикаментов, воздействующих на мозговую активность и периферически на функционал надпочечников. Тестостерон не только перестаёт вырабатываться, но и прекращает действовать непосредственно в простате. Однако количество побочных эффектов от такого метода лечения превышает его положительные качества. Выраженными проявлениями зачастую являются: отсутствие сексуального желания, импотенция, понос, тошнота, дисфункция печени.
Общие побочные эффекты гормональной терапии
Помимо того, что у конкретных методов имеются собственные недостатки, стоит указать на те проявления, которые могут формироваться при приёме любых медикаментов. К ним относятся:
Однако столь широкий перечень побочных эффектов проявляется в полном объеме крайне редко. Грамотно спланированный процесс лечения, построенный на использовании оптимальных медикаментозных средств, имеет предельно высокую эффективность и даёт положительные результаты в борьбе со злокачественной опухолью. Однако полного выздоровления посредством терапии добиться крайне сложно, если быть точнее, то она должна применяться в комплексе с другими современными методами лечения.
Зачастую гормональную терапию используют для замедления интенсивности развития онкологического образования. Она необходима для контроля над онкологической патологией и сохранения привычного режима жизнедеятельности пациента. С помощью терапии можно повышать эффективность других методов, либо просто продлевать срок жизни для мужчины, чей клинический случай является бесперспективным в ракурсе полного выздоровления.
Прогноз и оценка эффективности метода
Когда онкологическое поражение только диагностируется, прогноз может быть рассчитан исходя из результатов дифференцирования выявленного новообразования (злокачественное или доброкачественное) и определения стадии его развития. Для мужчин с опухолью М1 (1-2 стадия) уровень выживаемости составляет от 28 до 53 месяцев. Для малой доли пациентов (7%), прошедших курс терапии при раке простаты, он составляет более 10 лет.
Важно! «Уровень выживаемости» – это не термин, который становится приговором. Это срок, который прошел с момента прохождения лечебного курса конкретным пациентом. По истечению данного срока он был снят с учета, потому в историю болезни записывается обозримый период жизни.
Прогнозировать перспективы развития опухоли и лечебного воздействия на неё можно, основываясь на следующие показатели:
В случае местно-распространенного развития рака выживаемость составляет более 10 лет.
Именно уровень ПСА является контрольным значением. Нормальным уровнем его понижения спустя 1,5-2 месяца после того, как было начато гормональное лечение рака предстательной железы, является значение в 1/10 нг/мл. Однако и при уровне в 5/10 нг/мл можно рассчитывать на благоприятный прогноз. Помимо контроля за уровнем ПСА многое зависит от агрессивности злокачественного образования и схематики воздействия метастазов на организм пациента.
Профилактические меры
Завершение лечебного курса – это не последняя стадия борьбы с заболеванием. В случае со злокачественными опухолями необходимо предотвращать возможный рецидив, контролируя каждый свой шаг вне стен медицинского учреждения. К набору профилактических мероприятий, которые назначаются мужчинам, прошедшим один из вышеперечисленных лечебных курсов, относятся:
Мужчина также должен быть ограждён от стресса и нервного перенапряжения. Осторожность в целях предотвращения механических повреждений также должна стать ключевым принципом жизнедеятельности.
Обращение в Центр эндоваскулярной хирургии
Медицинский центр профессора Капранова – это профильное учреждение, где помощь может получить любой онкобольной. Обращение к нашим специалистам гарантирует вам качественную диагностику с точным дифференцированием и определением стадии развития опухоли. Врачи центра находят индивидуальный подход к каждому пациенту, формируя оптимальный план лечебных курсов. При этом хирургическое вмешательство не назначается никогда, если существует возможность альтернативного подхода к борьбе с раковым образованием.
Изучите внимательно наш сайт, ознакомившись с ключевыми особенностями работы центра. Прочитайте и другие статьи, чтобы узнать о методах онкомедицины. Имейте представление о наших возможностях. Многое о нас можно узнать из отзывов других пациентов, прошедших лечебные курсы у медиков центра. Можно оставить собственный комментарий, если у вас уже сложилось впечатление о нас.
Ответственность и профессионализм – это лишь малая часть достоинств наших врачей и медперсонала. Всем обратившимся гарантируются выгодные условия и комфорт пребывания в центре. Будьте здоровы, а мы вам в этом поможем, исходя из особенностей и потребностей каждого пациента!
Основные направления деятельности центра эндоваскулярной хирургии а также другие популярные материалы:
Эмболизация маточных артерий в гинекологии
ЭМА в Москве
Эмболизация сосудов аденомы простаты
ГОРМОНАЛЬНАЯ ТЕРАПИЯ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Абсолютное число заболевших в 2000 г. в России составило 11 039 человек. Радикальное лечение РПЖ (радикальная простатэктомия, дистанционная лучевая терапия и брахитерапия) возможно только при локализованной форме заболевания, которая диагностируется у 33,7% больных. На момент постановки диагноза 2/3 опухолей предстательной железы являются местно-распространенными или генерализованными [4].
Показанием к проведению гормонотерапии при раке простаты является наличие метастазов, местно-распространенный процесс (T3-4NxM0), принадлежность к группе высокого риска (т.е. ПСА > 10 нг/мл + Глисон >= 7, Глисон 8-10 независимо от Т и ПСА, ПСА > 20 нг/мл незаисимо от Т и Глисона, T2C-T4, N0, N+), а также повышение ПСА после радикальной простатэктомии и/или лучевой терапии.
Методами гормонотерапии при раке простаты являются хирургическая кастрация, медикаментозная кастрация агонистами или антагонистами ЛГРГ, применение антиандрогенов (стероидных или нестероидных), эстрогенов и других агентов, таких как кетоконазол, спиронолактон, аминоглютетемид, кальцитриол, аналоги соматостатина и финастерид.
До конца 80-х годов лечение III или IV стадии РПЖ сводилось к хирургической кастрации (билатеральная орхидэктомия) или к терапии эстрогенами. До настоящего времени в некоторых клиниках двусторонняя орхидэктомия является методом выбора при лечении генерализованного РПЖ. Терапевтический эффект наступает быстро у 60-80% больных с прогрессирующим РПЖ, невысокая стоимость лечения и относительная техническая простота выполнения операции до сих пор кажутся заманчивыми. Однако на сегодняшний день, данный метод не является \золотым\ стандартом [5]. Это связано со многими причинами. Во-первых, хирургическая кастрация позволяет избавить организм только от 60% вырабатываемых андрогенов, во-вторых, гормонорезистентный РПЖ встречается в 15- 30% случаев, применение хирургической кастрации в данном случае является не только бессмысленной, но и вредной манипуляцией, так как пагубно отражается на качестве жизни пациентов и, как и любое хирургическое вмешательство, сопряжено с определенным риском послеоперационных осложнений [6]. После этой операции нельзя проводить интермиттирующую андрогенную блокаду, которая, по данным ряда авторов, позволяет дольше поддерживать гормоночувствительность опухоли, а значит, и терапевтический контроль над ней. Также нельзя забывать о феномене отмены антиандрогенной терапии, в результате чего может наступить клиническая ремиссия [7]. Среднее время до прогрессирования составляет 12-33 месяца. Через 18-24 месяца у большинства больных развивается рефрактерность к дальнейшей гормональной терапии. После перехода заболевания в гормонорезистентную фазу медиана выживаемости составляет 23-37 месяцев (Hellerstedt, 2002).
Метод эстрогенотерапии при распространенном РПЖ также обладает невысокой стоимостью и достаточно высокоэффективен (объективный эффект отмечается у 70-80% больных). Однако по результатам многочисленных исследований данный вид лечения приводит к большому числу побочных реакций и осложнений (инфаркт миокарда, тромбоэмболии, нарушения функций печени, желудочно-кишечного тракта, задержка жидкости в организме, гипертония и др.), в то же время терапия эстрогенами уступает по эффективности современным методам андрогенной депривации.
В пятидесятых годах была сформулирована теория нейрогуморального контроля гипофиза со стороны гипоталамической подбугорной области головного мозга. Было выделено и изучено несколько гипоталамических гормонов, в том числе и релизинг- гормон. Его другое название лютеинизирующий гормон- релизинг гормон (ЛГРГ). Возникла идея путем создания различных аналогов ЛГРГ проконтролировать в нужном направлении синтез эндогенных половых гормонов (андрогенов). Эксплуатировались два подхода: создание агонистов ЛГРГ и антагонистов ЛГРГ. Первый связан с непрерывной стимуляцией гипофиза, в результате чего наступает сбой в регуляции синтеза половых гормонов. Введение агонистов обязательно должно быть повторено. Второй подход предусматривает немедленное подавление секреции гипофизарных гормонов антагонистами ЛГРГ [8]. Как оказалось, введение агонистов ЛГРГ приводит к тому, что наступает глубокое подавление синтеза гонадотропина, что приводит к полному расстройству гипофизарно- гонадной оси и заканчивается прекращением синтеза эстрогенов и тестостерона [9]. При этом кастрационный уровень тестостерона достигается в течение 2-3 недель после начала лечения. У больных, начавших лечение агонистами ЛГРГ, отмечается первичная гиперсекреция тестостерона (синдром \вспышки\). Для подавления клинических проявлений повышения уровня тестостерона (усиление костных болей и пр.) возможно применение антиандрогенов перед введением агонистов ЛГРГ. Разницы результатов применения различных препаратов данной группы не обнаружено. Не выявлено различий между результатами лечения агонистами ЛГРГ и ДСЭ при большей частоте сердечно-сосудистых осложнений со стороны эстрогенов (Seidenfeld, 2000).
Антагонисты ЛГРГ вызывают блокаду выработки ЛГ и ФСГ, приводя к резкому снижению продукции тестостерона. В рандомизированном исследовании доказано отсутствие эффекта \вспышки\, а также более быстрое достижение кастрационных уровней сывороточного тестостерона у пациентов, получавших антагонисты ЛГРГ.
Монотерапия антиандрогенами была предложена как метод андрогенной блокады, который может предотвратить побочные эндокринные эффекты, в том числе и подавление сексуальной функции. Монотерапия флутамидом продемонстрировала одинаковые отдаленные результаты с максимальной андрогеной блокадой (МАБ) и орхэктомией, уступив эстрогенам в отношении выживаемости и времени до прогрессирования (Pavone-Macaluso, 1994, Boccon-Gibod, 1997). Ципротерон-ацетат (ЦПА) в монорежиме продемонстрировал отдаленные результаты, аналогичные использованию эстрогенов (EORTC 30761). Бикалютамид в дозе 50 мг/сут уступал кастрации в отношении медианы выживаемости и времени до прогрессирования. Увеличение дозы до 150 мг позволило добиться результатов, аналогичным таковым при использовании МАБ, у пациентов со стадией М0 (Tyrell, 1998).
В урологическом отделении Российского онкологического научного центра им. Н.Н. Блохина РАМН было проведено исследование препарата \Билумид\, имеющим активное вещество бикалутамид.
В исследование были включены 15 пациентов, имеющих диагноз РПЖ T2-3N0M0, ранее не получавших специфического лечения. Пациенты получали Билумид в дозе 150 мг в сутки в монорежиме на протяжении 3-х месяцев. При контрольном обследовании выяснилось, что титр ПСА достоверно снизился у 100 % пациентов, а титр тестостерона сыворотки крови достоверно возрос у 94 %. Не было зарегистрировано ни одного случая почечной или печеночной токсичности, требующей отмены препарата.
Понятие МАБ подразумевает сочетание кастрации (медикаментозной или хирургической) и антиандрогенов, приводящих к блокаде как продукции тестостерона, так и его взаимодействия с рецепторами. Концепция МАБ впервые была предложена Labrie (1983), в работе которого 2-летняя выживаемость пациентов, получавших МАБ, была достоверно больше, чем у больных, подвергнутых только кастрации. Результаты автора были воспроизведены в нескольких исследованиях. Однако в ряде работ не было достигнуто преимуществ выживаемости при использовании МАБ по сравнению с кастрацией. Это послужило причиной проведения больших рандомизированных исследований, в которых были получены противоречивые результаты. В крупнейшем метаанализе, включившем данные более 8 000 больных преимуществ выживаемости в группе, получавшей МАБ, не выявлено (Seidenfeld,2000).
Было высказано предположение, что преимущество МАБ в ранних исследованиях обусловлено подавлением инициального повышения уровня тестостерона, вызванного введением агонистов ЛГРГ, антиандрогенами. В связи с этим производились попытки нивелировать данный фактор за счет применения хирургической кастрации, что не привело к разрешению проблемы. Так, в работе Moinpour (1998), рандомизировавшего больных на орхэктомию в сочетании с флутамидом или плацебо, 10-процентное преимущество выживаемости в первой группе было недостоверным. Напротив, в исследовании EORTC 30853, выживаемость пациентов, получавших МАБ, была значимо выше, чем в группе, подвергнутой кастрации.
С целью разрешения противоречий относительно реальной эффективности МАБ были выполнены многочисленные метаанализы результатов ряда исследований, в которых также получены противоречивые результаты. В метаанализе Bennett C.L. (1999), включившем 9 исследований (4128 больных) выявлено увеличение выживаемости в группе пациентов, получавших МАБ с включением флутамида, на 10%, по сравнению с больными, подвергнутыми кастрации. Аналогичные результаты получены в метаанализе 18 исследований (5 485 больных) The Agency for Health Care Policy Research, выявившем 3-9% увеличение 5-летней выживаемости при использовании МАБ. В другом метаанализе 20 исследований, включивших 6320 больных, отмечено умеренное увеличение продолжительности жизни без признаков прогрессирования у больных, получавших МАБ, по сравнению с кастрацией, при наблюдении в течение 1 года. Преимущество специфической и общей выживаемости оказались значимыми только при сроке наблюдения 5 лет. Denis L. (1994), проведший метаанализ 23 исследований, отметил преимущество МАБ с включением агонистов ЛГРГ и антиандрогенов только в отношении времени до прогрессирования.
В метаанализе 1997 г., включившем данные 5000 больных из 22 исследований не подтверждено увеличения продолжительности жизни у пациентов, получавших комбинированное лечение. В метаанализе результатов 29 исследований (1998) МАБ также не продемонстрировала преимуществ относительно кастрации.
В 2000 г. Prostate Cancer Trialists Collaborative Group (PCTCG) провела крупнейший метаанализ, включивший данные 8275 больных из 27 исследований. При этом выявлена тенденция к увеличению 5-летней выживаемости при использовании МАБ по сравнению с монотерапией (25.4% и 23.6% соответственно), однако разница результатов не достигла статистической значимости (2p=0.11).
При анализе данных подгрупп пациентов отмечена зависимость результатов лечения от вида применявшихся антиандрогенов. Стероидные антиандрогены (флутамид, бикалютамид, нилютамид) в составе комбинированного лечения обеспечивали значимое преимущество МАБ перед кастрацией (2p

