Миелолейкоз что это за заболевание симптомы причины
Хронический миелоидный лейкоз
Хронический миелоидный лейкоз (ХМЛ) занимает третье место среди всех лейкозов. На его долю приходится около 20% случаев рака крови. На данный момент в России зарегистрировано более 3 тысяч больных. Самому маленькому из них всего 3 года, самому старшему – 90.
Заболеваемость ХМЛ составляет 1-1,5 случая на 100 000 населения в год (15-20% от всех случаев гемобластозов у взрослых). Болеют преимущественно люди среднего возраста: пик заболеваемости приходится на возраст 30-50 лет, около 30% составляют больные старше 60 лет. У детей ХМЛ встречается редко, составляя не более 2-5%о от числа всех лейкозов. Мужчины болеют несколько чаще женщин (соотношение 1:1,5).
Что провоцирует / Причины Хронического миелоидного лейкоза:
Как и подавляющее большинство других лейкозов, хронический миелоидный лейкоз возникает в результате приобретенного (т. е. не врожденного) повреждения хромосомного аппарата одной-единственной стволовой клетки костного мозга.
Точная причина такого изменения хромосом у пациентов с ХМЛ пока неизвестна. Скорее всего, происходит случайный обмен генетическим материалом между хромосомами, которые на определенной стадии жизни клетки расположены в непосредственной близости друг от друга.
Остается спорным вопрос о влиянии на заболеваемость ХМЛ таких факторов, как малые дозы радиации, слабое электромагнитное излучение, гербициды, инсектициды и т. д. Достоверно доказано увеличение частоты развития ХМЛ у лиц, подвергшихся воздействию ионизирующей радиации. Среди химических агентов связь с возникновением ХМЛ установлена только для бензола и иприта.
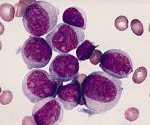
Субстрат хронического миелолейкоза составляют в основном созревающие и зрелые клетки гранулоцитарного ряда (метамиелоциты, палочкоядерные и сегментоядерные гранулоциты).
Патогенез (что происходит?) во время Хронического миелоидного лейкоза:
Способность химерных белков вызывать опухолевую трансформацию нормальных стволовых кроветворных клеток продемонстрирована in vitro.
Об онкогенности белка p210BCR-ABL1 свидетельствуют также эксперименты на мышах, получивших летальную дозу облучения. Когда им трансплантировали клетки костного мозга, которые были заражены несущим ген BCR-ABL1 ретровирусом, у половины мышей развивался миелопролиферагавный синдром, напоминавший хронический миелолейкоз.
Другие доказательства роли белка p210BCR-ABL1 в развитии хронического миелолейкоза следуют из экспериментов с антисмысловыми олигонуклеотидами, комплементарными транскрипту гена BCR-ABL1. Показано, что эти олигонуклеотиды подавляют рост колоний опухолевых клеток, при этом нормальные гранулоцитарные и макрофагальные колонии продолжают расти.
Слияние гена BCR с геном ABL1 приводит к тому, что увеличивается тирозинкиназная активность белка Abl1, ослабевает его способность связываться с ДНК, а связывание с актином усиливается.
В то же время детальный механизм перерождения нормальных клеток костного мозга в опухолевые неизвестен.
Механизм перехода заболевания от развернутой стадии к бластному кризу тоже неясен. Опухолевому клону присуща ломкость хромосом: помимо транслокации t(9;22) в опухолевых клетках могут появиться трисомия по 8-й хромосоме, делеция в 17р. Накопление мутаций приводит к изменению свойств опухолевых клеток. По данным одних исследователей, скорость развития бластного криза зависит от локализации точки разрыва гена BCR. Другие исследователи эти данные опровергают.
У ряда больных развитию бластного криза сопутствуют разнообразные мутации гена TP53 и гена RB1. Изредка встречаются мутации генов RAS. Есть единичные сообщения о появлении у больных хроническим миелолейкозом белка p190BCR-ABL1 (его часто обнаруживают у больных острыми лимфобластными лейкозами и иногда у больных острыми миелоидными лейкозами), а также мутаций гена MYC.
Перед бластным кризом может происходить метилирование ДНК в локусе гена BCR-ABL1.
Есть также сведения об участии в прогрессии хронического миелолейкоза ИЛ-1бета.
Представленные данные свидетельствуют о том, что опухолевая прогрессия обусловлена несколькими механизмами, однако точная роль каждого из них неизвестна.
Симптомы Хронического миелоидного лейкоза:
Хронический миелоидный лейкоз (хронический миелоз) протекает в две стадии.
В типичном случае характерен нейтрофильный лейкоцитоз (повышение уровня нейтрофильных лейкоцитов) с появлением молодых форм нейтрофилов, сопровождающийся увеличением количества тромбоцитов, уменьшением содержания лимфоцитов. По мере развития болезни нарастают анемия и тромбоцитопения. У детей чаще наблюдается ювенильная форма хронического миелолейкоза без увеличения количества тромбоцитов, но с повышенным содержанием моноцитов. Часто увеличивается число базофилов, имеет место повышенный уровень эозинофилов. В первую доброкачественную стадию клетки костного мозга по всем параметрам соответствуют норме. Во вторую стадию в костном мозге и крови появляются бластные формы, отмечается быстрый рост числа лейкоцитов в крови (до нескольких миллионов в 1 мкл). Характерными признаками конечной стадии является обнаружение в крови осколков ядер мегакариоцитов, угнетение нормального кроветворения.
Диагностика Хронического миелоидного лейкоза:
Картина крови и костного мозга В типичном случае характерен нейтрофильный лейкоцитоз с появлением молодых форм нейтрофилов, сопровождающийся гипертромбоцитозом, лимфоцитопенией. По мере развития болезни нарастают анемия и тромбоцитопения. У детей чаще наблюдается ювенильная форма хронического миелолейкоза без гипертромбоцитоза, но с высоким моноцитозом. Часто увеличивается число базофилов, имеет место эозинофилия. В первую доброкачественную стадию клетки костного мозга по всем параметрам соответствуют норме. Во вторую стадию в костном мозге и крови появляются бластные формы, отмечается быстрый рост числа лейкоцитов в крови (до нескольких миллионов в 1 мкл). Характерными признаками терминальной стадии является обнаружение в крови осколков ядер мегакариоцитов, угнетение нормального кроветворения.
Диагноз хронического лейкоза устанавливается на основании жалоб, осмотра, анализов крови, биопсии, цитогенетического анализа. Помогают в установлении диагноза и такие вспомогательные методы обследования, как ПЭТ-КТ, КТ, МРТ.
Диагноз ставится по картине крови. Решающее значение имеет пункция костного мозга. Дифференциальный диагноз проводят с лимфогранулематозом и лимфосаркоматозом.
Лечение Хронического миелоидного лейкоза:
В развернутой стадии болезни назначают малые дозы миелосана, обычно в течение 20–40 дней. При падении лейкоцитов до 15 000–20 000 в 1 мкл (15–20 Г/л) переходят к поддерживающим дозам. Параллельно с миелосаном используют облучение селезенки. Кроме миелосана, возможно назначение миелоброма, 6-меркаптопурина, гексафосфамида, гидроксимочевины. На этапе бластного криза хороший результат дает комбинация препаратов: винкристин-преднизолон, цитозар-рубомицин, цитозартиогуанин. Применяют трансплантацию костного мозга.
Профилактика Хронического миелоидного лейкоза:
К каким докторам следует обращаться если у Вас Хронический миелоидный лейкоз:
Хронический миелоидный лейкоз – диагностика в Израиле
Злокачественная болезнь развивается очень медленно. Многие люди не нуждаются в лечении на протяжении нескольких месяцев и даже лет. Однако в некоторых случаях оно необходимо сразу же.
Доказано, что раннее выявление рака крови способствует составлению адекватного терапевтического протокола, который способен исцелить болезнь с наименьшим уроном для организма.
Компания Tlv.Hospital предлагает пройти полный диагностический контроль и получить экспертную оценку состояния здоровья в Израиле.
Мы максимально быстро подберем лучшего врача, оформим пребывание пациента в ведущем госпитале по коррекции раковых патологий, сформируем эффективный план лечения болезни по разумным ценам. Напрример, доктор Тавор Сигаль давно занимается лечением различных видов рака крови.
Оказавшись в сложной жизненной ситуации, позвоните нам, доверьте свои проблемы профессионалам.
У людей с хроническим миелолейкозом в крови присутствует избыточное количество белых клеток крови – гранулоцитов (зернистых лейкоцитов), поэтому эту болезнь иногда называют хронической гранулоцитарной лейкемией. При исследовании под микроскопом видно, что гранулоциты не полностью развиты (незрелые). С течением времени они накапливаются в селезенке, приводя к увеличению ее объема. Она расположена на левой стороне брюшной полости, под ребрами. Этот орган производит небольшое количество лимфоцитов, сохраняет клетки крови и разрушает старые, поврежденные.
Также гранулоциты заполняют костный мозг, снижая количество здоровых лейкоцитов, эритроцитов и тромбоцитов.
Чтобы лучше понять, что представляет собой хронический миелолейкоз и его лечение, будет полезно узнать несколько больше о крови человека.
Кровь в организме человека
Кровь состоит из клеток, которые находятся в плазме, жидкости.
Клетки крови производятся в костном мозге, губчатом веществе, которое заполняет внутреннюю, центральную часть костей, особенно в области таза и позвоночника. Обычно миллионы новых клеток крови синтезируются ежедневно, чтобы заменить старые и изношенные.
Все клетки крови образуются из стволовых. Различают два их типа:
Новые клетки крови являются незрелыми и называются бластными. Они не могут выполнять свою функцию. До созревания они пребывают в костном мозге. Здесь стволовые клетки делятся и растут, пока не образуют полностью развитые (зрелые) эритроциты, тромбоциты и лейкоциты.
Потом они высвобождаются в кровоток, чтобы выполнять различные функции:
Лейкоциты предупреждают развитие инфекций и борются с ними. Есть несколько видов белых клеток крови, два наиболее важных из них – это нейтрофилы и лимфоциты. Уровни этих клеток измеряются при общем анализе крови.
Как развивается хронический миелолейкоз?
У всех клеток есть определенный «набор инструкций», что делать и когда. Он хранится внутри них, в генах. Каждый ген контролирует тот или иной аспект поведения клеток. Например, некоторые определяют время отдыха, другие – роста, момент трансформации в зрелую клетку. Гены организованы в структуры или хромосомы.
Болезнь возникает, когда по ошибке ген переносится от одной хромосомы к другой во время деления клетки. Они объединяются. Это аномальное слияние останавливает процесс созревания бластов. Данные клетки являются лейкозными или бластными.
Филадельфийская хромосома
У большей части людей с данным заболеванием (95 из 100) в патологических клетках есть филадельфийская хромосома.
Основная часть клеток содержит 23 пары хромосом. Филадельфийская хромосома образуется, когда ген ABL на 9-й хромосоме ошибочно переносится к хромосоме 22 и прикрепляется к гену BCR. В результате образуется новый ген под названием BCR-ABL. Он синтезирует белок, который именуется тирозинкиназа. Избыток этого белка приводит к аномальному поведению клеток и изменениям в крови и костном мозге. Новые методы лечения хронического миелоидного лейкоза направлены на блокирование действий тирозинкиназы. Несмотря на то, что болезнь генетическая, она не является наследственной.
Причины хронического миелолейкоза
Существует ряд факторов, которые способны увеличить риск развития данного заболевания, хотя у большинства людей неизвестно, почему оно возникает.
В последние годы муссируется информация о том, что проживание вблизи атомных электростанций может оказывать определенное влияние. Исследования продолжаются до сих пор, но пока нет никаких доказательств.
Также не обнаружено связи между вероятностью ХМЛ и воздействием электромагнитных полей и бытового радона.
Симптомы хронического миелолейкоза
Признаки заболевания развиваются медленно, у многих людей нет никаких симптомов на ранних стадиях. Чаще всего миелоидную лейкемию выявляют случайно, когда анализ крови делают по другой причине, к примеру, перед операцией или во время регулярных медицинских осмотров.
Если признаки на ранних стадиях заболевания все же наблюдаются, то развиваются медленно и носят, как правило, мягкий характер. Они неспецифические, и их легко спутать с симптомами других распространенных болезней, таких как грипп.
Клинические проявления хронического миелолейкоза могут включать:
Если имеют место какие-либо из данных симптомов, стоит помнить, что они типичны для многих других заболеваний.
Диагностика хронического миелолейкоза в Израиле
В связи с незначительными симптомами болезнь обычно выявляется случайно. Анализ крови показывает высокое количество белых клеток крови – незрелых гранулоцитов.
Диагностикой и лечением заболевания занимается команда врачей в израильской клинике.
Первоначально гематолог собирает анамнез, обследует пациента, проверяет, не увеличены ли лимфатические узлы, селезенка или печень. Выполняется несколько анализов крови. Если их результаты показывают наличие лейкозных клеток, проводятся дополнительные тесты, которые помогают выявить тип лейкоза, степень развития заболевания. Это помогает спланировать лечение в Израиле.
Биопсия костного мозга
Иногда требуется проведение трепанобипсии, когда вместе с жидкостью извлекают костный фрагмент.
Дальнейшие тесты
В израильских клиниках могут быть задействованы и методы медицинской визуализации:
Цитогенетический тест исследует пробы крови и костного мозга с целью обнаружения филадельфийской хромосомы. Его результаты помогают врачам выбрать наилучший вариант лечения хронического миелолейкоза.
Стадии хронического миелолейкоза
Выделяют не стадии, а фазы ХМЛ: хроническую, ускоренную (фазу акселерации) и финальную (терминальную).
Хроническая фаза
Болезнь развивается очень медленно и часто стабильна в течение длительного времени. Могут отсутствовать какие-либо симптомы, и большинство людей ведет нормальный образ жизни.
В данный период больным редко необходимо посещать клинику. Лечение хронического миелолейкоза проводится амбулаторно и не вызывает множество побочных эффектов. Выполняются регулярно анализы крови, чтобы проверить, насколько хорошо организм отвечает на терапию.
У большинства пациентов, которые начинают лечить миелолейкоз в хронической фазе, болезнь хорошо контролируется, не вызывая симптомов. И если терапия постоянно продолжается, заболевание можно держать под контролем в течение многих лет и, возможно, десятилетий.
У некоторых людей ХМЛ плохо отвечает на лечение. И на протяжении приблизительно пяти лет после постановки диагноза болезнь может прогрессировать, перейдя из хронической фазы в более продвинутую.
Ускоренная фаза (акселерации)
У небольшого числа людей хронический миелоидный лейкоз может постепенно переходить на данный этап. Заболевание развивается быстрее, больше бластных клеток присутствует в крови и костном мозге. Иногда эти изменения можно увидеть с помощью анализов крови, применяя микроскоп. Если пациент плохо себя чувствует или обнаруживает новые симптомы, необходимо обязательно о них сообщить врачу.
Финальная фаза
Спустя некоторое время в ускоренной фазе (обычно месяц) болезнь переходит в терминальную, приобретая симптомы острого миелолейкоза. На этом этапе большое количество бластных клеток заполняют костный мозг, высокий их уровень присутствует в крови.
Иногда болезнь не отвечает на лечение. Тогда она минует ускоренную фазу и сразу переходит в финальную или фазу бластного криза.
Ремиссия
При ремиссии нормализуется состояние крови и костного мозга после проведенного лечения. Различают разные ее уровни.
Клиники Израиля могут обеспечить точную и быструю диагностику хронического миелолейкоза, подобрать наиболее подходящий вариант лечения, чтобы достичь наилучшего результата. Если вы нуждаетесь в помощи, обращайтесь к нам.
Острый миелоидный лейкоз
Острый миелоидный лейкоз – злокачественное заболевание системы крови, сопровождающееся неконтролируемым размножением измененных лейкоцитов, снижением количества эритроцитов, тромбоцитов и нормальных лейкоцитов. Проявляется повышенной склонностью к развитию инфекций, лихорадкой, быстрой утомляемостью, потерей веса, анемией, кровоточивостью, образованием петехий и гематом, болями в костях и суставах. Иногда выявляются изменения кожи и припухлость десен. Диагноз устанавливается на основании клинических симптомов и данных лабораторных исследований. Лечение – химиотерапия, трансплантация костного мозга.
МКБ-10
Общие сведения
Острый миелоидный лейкоз (ОМЛ) – злокачественное поражение миелоидного ростка крови. Неконтролируемая пролиферация лейкозных клеток в костном мозге влечет за собой подавление остальных ростков крови. В результате количество нормальных клеток в периферической крови уменьшается, возникают анемия и тромбоцитопения. Острый миелоидный лейкоз является самым распространенным острым лейкозом у взрослых. Вероятность развития болезни резко увеличивается после 50 лет. Средний возраст пациентов составляет 63 года. Мужчины и женщины молодого и среднего возраста страдают одинаково часто. В старшей возрастной группе наблюдается преобладание лиц мужского пола. Прогноз зависит от вида острого миелоидного лейкоза, пятилетняя выживаемость колеблется от 15 до 70%. Лечение осуществляют специалисты в области онкологии и гематологии.
Причины острого миелоидного лейкоза
Непосредственной причиной развития ОМЛ являются различные хромосомные нарушения. В числе факторов риска, способствующих развитию таких нарушений, указывают неблагоприятную наследственность, ионизирующее излучение, контакт с некоторыми токсическими веществами, прием ряда лекарственных препаратов, курение и болезни крови. Вероятность возникновения острого миелоидного лейкоза увеличивается при синдроме Блума (низкий рост, высокий голос, характерные черты лица и разнообразные кожные проявления, в том числе гипо- или гиперпигментация, кожная сыпь, ихтиоз, гипертрихоз) и анемии Фанкони (низкий рост, дефекты пигментации, неврологические расстройства, аномалии скелета, сердца, почек и половых органов).
Острый миелоидный лейкоз достаточно часто развивается у больных с синдромом Дауна. Прослеживается также наследственная предрасположенность при отсутствии генетических заболеваний. При ОМЛ у близких родственников вероятность возникновения болезни повышается в 5 раз по сравнению со средними показателями по популяции. Самый высокий уровень корреляции выявляется у однояйцевых близнецов. Если острый миелоидный лейкоз диагностируется у одного близнеца, риск у второго составляет 25%. Одним из важнейших факторов, провоцирующих ОМЛ, являются заболевания крови. Хронический миелоидный лейкоз в 80% случаев трансформируется в острую форму болезни. Кроме того, ОМЛ нередко становится исходом миелодиспластического синдрома.
Ионизирующее излучение вызывает острые миелоидные лейкозы при превышении дозы 1 Гр. Заболеваемость увеличивается пропорционально дозе облучения. На практике имеет значение пребывание в зонах атомных взрывов и аварий на атомных электростанциях, работа с источниками излучения без соответствующих защитных средств и радиотерапия, применяемая при лечении некоторых онкологических заболеваний. Причиной развития острого миелоидного лейкоза при контакте с токсическими веществами является аплазия костного мозга в результате мутаций и поражения стволовых клеток. Доказано негативное влияние толуола и бензола. Обычно ОМЛ и другие острые лейкозы диагностируются спустя 1-5 лет после контакта с мутагеном.
В числе лекарственных средств, способных провоцировать острые миелоидные лейкозы, специалисты называют некоторые препараты для химиотерапии, в том числе ингибиторы ДНК-топоизомеразы II (тенипозид, этопозид, доксорубицин и другие антрациклины) и алкилирующие средства (тиофосфамид, эмбихин, циклофосфамид, хлорамбуцил, кармустин, бусульфан). ОМЛ также может возникать после приема хлорамфеникола, фенилбутазона и препаратов мышьяка. Доля лекарственных острых миелоидных лейкозов составляет 10-20% от общего количества случаев заболевания. Курение не только повышает вероятность развития ОМЛ, но и ухудшает прогноз. Средняя пятилетняя выживаемость и продолжительность полных ремиссий у курильщиков ниже, чем у некурящих.
Классификация острого миелоидного лейкоза
Классификация острого миелоидного лейкоза по версии ВОЗ очень сложна и включает в себя несколько десятков разновидностей заболевания, разделенных на следующие группы:
Тактика лечения, прогноз и продолжительность ремиссий при разных видах ОМЛ могут существенно различаться.
Симптомы острого миелоидного лейкоза
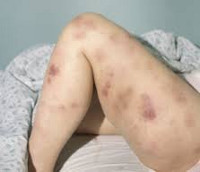
Клиническая картина включает в себя токсический, геморрагический, анемический синдромы и синдром инфекционных осложнений. На ранних стадиях проявления острого миелоидного лейкоза неспецифичны. Отмечается повышение температуры без признаков катарального воспаления, слабость, утомляемость, потеря веса и аппетита. При анемии присоединяются головокружения, обморочные состояния и бледность кожных покровов. При тромбоцитопении наблюдаются повышенная кровоточивость и петехиальные кровоизлияния. Возможно образование гематом при незначительных ушибах. При лейкопении возникают инфекционные осложнения: частые нагноения ран и царапин, упорные повторные воспаления носоглотки и т. д.
В отличие от острого лимфобластного лейкоза при остром миелоидном лейкозе отсутствуют выраженные изменения со стороны периферических лимфатических узлов. Лимфоузлы небольшие, подвижные, безболезненные. Иногда выявляется увеличение лимфатических узлов в шейно-надключичной области. Печень и селезенка в пределах нормы или незначительно увеличены. Характерны признаки поражения костно-суставного аппарата. Многие больные острым миелоидным лейкозом предъявляют жалобы на боли различной степени интенсивности в области позвоночника и нижних конечностей. Возможны ограничения движений и изменения походки.
В числе экстрамедуллярных проявлений острого миелоидного лейкоза – гингивит и экзофтальм. В отдельных случаях наблюдаются припухлость десен и увеличение небных миндалин в результате инфильтрации лейкозными клетками. При миелоидной саркоме (составляет около 10% от общего количества случаев острого миелоидного лейкоза) на коже пациентов появляются зеленоватые, реже – розовые, серые, белые или коричневые опухолевидные образования (хлоромы, кожные лейкемиды). Иногда при поражениях кожи обнаруживается паранеопластический синдром (синдром Свита), который проявляется воспалением кожных покровов вокруг лейкемидов.
В развитии острого миелоидного лейкоза выделяют пять периодов: начальный или доклинический, разгара, ремиссии, рецидива и терминальный. В начальном периоде острый миелоидный лейкоз протекает бессимптомно или проявляется неспецифической симптоматикой. В периоде разгара токсический синдром становится более выраженным, выявляются анемический, геморрагический и инфекционный синдромы. В период ремиссии проявления острого миелоидного лейкоза исчезают. Рецидивы протекают аналогично периоду разгара. Терминальный период сопровождается прогрессирующим ухудшением состояния больного и завершается летальным исходом.
Диагностика и лечение острого миелоидного лейкоза
Решающую роль в процессе диагностики играют лабораторные анализы. Используют анализ периферической крови, миелограмму, микроскопические и цитогенетические исследования. Для получения образца тканей выполняют аспирационную биопсию костного мозга (стернальную пункцию). В анализе периферической крови больного острым миелоидным лейкозом обнаруживается снижение количества эритроцитов и тромбоцитов. Количество лейкоцитов может быть как повышенным, так и (реже) пониженным. В мазках могут выявляться бласты. Основанием для постановки диагноза «острый миелоидный лейкоз» становится обнаружение более 20% бластных клеток в крови либо в костном мозге.
Основой лечения острого миелоидного лейкоза является химиотерапия. Выделяют два этапа лечения: индукцию и консолидацию (постремиссионную терапию). На этапе индукции выполняют лечебные мероприятия, направленные на уменьшение количества лейкозных клеток и достижение состояния ремиссии. На этапе консолидации устраняют остаточные явления болезни и предотвращают рецидивы. Лечебную тактику определяют в зависимости от вида острого миелоидного лейкоза, общего состояния больного и некоторых других факторов.
Наиболее популярная схема индукционного лечения – «7+3», предусматривающая непрерывное внутривенное введение цитарабина в течение 7 дней в сочетании с одновременным быстрым периодическим введением антрациклинового антибиотика в течение первых 3 дней. Наряду с этой схемой в процессе лечения острого миелоидного лейкоза могут применяться другие лечебные программы. При наличии тяжелых соматических заболеваний и высоком риске развития инфекционных осложнений в результате подавления миелоидного ростка (обычно – у больных старческого возраста) используют менее интенсивную паллиативную терапию.
Программы индукции позволяет добиться ремиссии у 50-70% пациентов с острым миелоидным лейкозом. Однако без дальнейшей консолидации у большинства больных наступает рецидив, поэтому второй этап лечения рассматривается, как обязательная часть терапии. План консолидационного лечения острого миелоидного лейкоза составляется индивидуально и включает в себя 3-5 курсов химиотерапии. При высоком риске рецидивирования и уже развившихся рецидивах показана трансплантация костного мозга. Другие методы лечения рецидивных ОМЛ пока находятся в стадии клинических испытаний.
Прогноз острого миелоидного лейкоза
Прогноз определятся разновидностью острого миелоидного лейкоза, возрастом больного, наличием или отсутствием миелодиспластического синдрома в анамнезе. Средняя пятилетняя выживаемость при разных формах ОМЛ колеблется от 15 до 70%, вероятность развития рецидивов – от 33 до 78%. У пожилых людей прогноз хуже, чем у молодых, что объясняется наличием сопутствующих соматических заболеваний, являющихся противопоказанием для проведения интенсивной химиотерапии. При миелодиспластическом синдроме прогноз хуже, чем при первичном остром миелоидном лейкозе и ОМЛ, возникшем на фоне фармакотерапии по поводу других онкологических заболеваний.