Митохондриальная днк что это такое
Митохондриальная ДНК
Митохондриальная ДНК (мтДНК) — ДНК, находящаяся (в отличие от ядерной ДНК) в митохондриях, органоидах эукариотических клеток.
Содержание
История открытия
Митохондриальная ДНК была открыта Маргит Насс и Сильвен Насс в 1963 году в Стокгольмском университете при помощи электронной микроскопии [2] и, независимо, учёными Эллен Харлсбруннер, Хансом Туппи и Готтфридом Шацем при биохимическом анализе фракций митохондрий дрожжей в Венском университете в 1964 году. [3]
Теории возникновения митохондриальной ДНК
На основании сходства в последовательностях нуклеотидов ДНК ближайшими родственниками митохондрий среди ныне живущих прокариот считают альфа-протеобактерий (выдвигалась также гипотеза, что к митохондриям близки риккетсии). Сравнительный анализ геномов митохондрий показывает, что в ходе эволюции происходило постепенное перемещение генов предков современных митохондрий в ядро клетки. Необъяснимыми с эволюционной точки зрения остаются некоторые особенности митохондриальной ДНК (например, довольно большое число интронов, нетрадиционное использование триплетов и др.). Ввиду ограниченного размера митохондриального генома бо́льшая часть митохондриальных белков кодируется в ядре. При этом бо́льшая часть митохондриальных тРНК кодируются митохондриальным геномом.
Формы и число молекул митохондриальной ДНК
У большинства изученных организмов митохондрии содержат только кольцевые молекулы ДНК, у некоторых растений одновременно присутствуют и кольцевые, и линейные молекулы, а у ряда протистов (например, инфузорий) имеются только линейные молекулы. [5]
Митохондрии млекопитающих обычно содержат от двух до десяти идентичных копий кольцевых молекул ДНК. [6]
У растений каждая митохондрия содержит несколько молекул ДНК разного размера, которые способны к рекомбинации.
У протистов из отряда кинетопластид (например, у трипаносом) в особом участке митохондрии (кинетопласте) содержится два типа молекул ДНК — идентичные макси-кольца (20-50 штук) длиной около 21 т.п.о. и мини-кольца (20 000 — 55 000 штук, около 300 разновидностей, средняя длина около 1000 п.о.). Все кольца соединены в единую сеть (катенаны), которая разрушается и восстанавливается при каждом цикле репликации. Макси-кольца гомологичны митохондриальной ДНК других организмов. Каждое мини-кольцо содержит четыре сходных консервативных участка и четыре уникальных гипервариабельных участка. [7] В мини-кольцах закодированы короткие молекулы направляющих РНК (guideRNA), которые осуществляют редактирование РНК, транскрибируемых с генов макси-колец.
Устойчивость митохондриальной ДНК
Митохондриальная ДНК особенно чувствительна к активным формам кислорода, генерируемым дыхательной цепью, в связи с непосредственной их близостью. Хотя митохондриальная ДНК связана с белками, их защитная роль менее выражена, чем в случае ядерной ДНК. Мутации в ДНК митохондрий могут вызывать передаваемые по материнской линии наследственные заболевания. Также имеются данные, указывающие на возможный вклад мутаций митохондриальной ДНК в процесс старения и развитие возрастных патологий. [8] У человека митохондриальная ДНК обычно присутствует в количестве 100—10000 копий на клетку (сперматозоиды и яйцеклетки являются исключением). С множественностью митохондриальных геномов связаны особенности проявления митохондриальных болезней — обычно позднее их начало и очень изменчивые симптомы.
Митохондриальная наследственность
Наследование по материнской линии
У большинства многоклеточных организмов митохондриальная ДНК наследуется по материнской линии. Яйцеклетка содержит на несколько порядков больше копий митохондриальной ДНК, чем сперматозоид. В сперматозоиде обычно не больше десятка митохондрий (у человека — одна спирально закрученная митохондрия), в небольших яйцеклетках морского ежа — несколько сотен тысяч, а в крупных ооцитах лягушки — десятки миллионов. Кроме того, обычно происходит деградация митохондрий сперматозоида после оплодотворения. [9]
При половом размножении митохондрии, как правило, наследуются исключительно по материнской линии, митохондрии сперматозоида обычно разрушаются после оплодотворения. Кроме того, большая часть митохондрий сперматозоида находятся в основании жгутика, которое при оплодотворении иногда теряется. В 1999 году было обнаружено, что митохондрии сперматозоидов помечены убиквитином (белком-меткой, которая приводит к разрушению отцовских митохондрий в зиготе). [10]
Так как митохондриальная ДНК не является высококонсервативной и имеет высокую скорость мутирования, она является хорошим объектом для изучения филогении (эволюционного родства) живых организмов. Для этого определяют последовательности митохондриальной ДНК у разных видов и сравнивают их при помощи специальных компьютерных программ и получают эволюционное древо для изученных видов. Исследование митохондриальных ДНК собак позволило проследить происхождение собак от диких волков. [11] Исследование митохондриальной ДНК в популяциях человека позволило вычислить «митохондриальную Еву», гипотетическую прародительницу всех живущих в настоящее время людей.
Наследование по отцовской линии
Геном митохондрий
Один из наиболее маленьких митохондриальных геномов имеет малярийный плазмодий (около 6.000 п.о., содержит два гена рРНК и три гена, кодирующих белки).
Недавно открытые рудиментарные митохондрии (митосомы) некоторых протистов (дизентерийной амёбы, микроспоридий и лямблий) не содержат ДНК. [25]
Некоторые растения имеют огромные молекулы митохондриальной ДНК (до 25 миллионов пар оснований), при этом содержащие примерно те же гены и в том же количестве, что и меньшие мтДНК. Длина митохондриальной ДНК может широко варьировать даже у растений одного семейства. В митохондриальной ДНК растений имеются некодирующие повторяющиеся последовательности.
Геном митохондрий человека кодирует следующие белки и РНК:
Особенности митохондриальной ДНК
Применение
Кроме изучения для построения различных филогенетических теорий, изучение митохондриального генома — основной инструмент при проведении идентификации. Возможность идентификации связана с существующими в митохондриальном геноме человека групповыми и даже индивидуальными различиями.
Особенности митохондриальных заболеваний
Митохондриальные заболевания – особый класс наследственных патологий, в основе которых лежит нарушение функционирования митохондрий, клеточных структур, чьей основной функцией принято считать выработку энергии в виде АТФ путем окислительного фосфорилирования. К дефектам работы митохондрий могут приводить как мутации в ДНК самих этих органелл(мтДНК), так и мутации генов ядерной ДНК (яДНК), продукты которых задействованы в метаболизме митохондрий. Клинически, дефекты в функционировании митохондрий по-разному проявляются со стороны конкретных органов и тканей, однако, в первую очередь страдают наиболее энергозависимые ткани, коими являются нервная и мышечная. Установлено, что митохондриальные заболевания относятся к наиболее частым наследственным неврологическим расстройствам. По некоторым мутациям частота встречаемости достигает 1 на 400 человек в европейской популяции, хотя фенотипически мутация проявляется значительно реже, примерно 1 на 8000 человек [1].
Мутации митохондриальной ДНК
В настоящее время выявлено более 400 точковых мутаций мтДНК, а также различных делеций и перестроек мтДНК. Известно более 200 заболеваний, вызванных этими мутациями [2]. Для митохондриальных заболеваний свойственна клиническая и генетическая гетерогенность. Одни мутации приводят к строго определенным клиническим признакам. Так, например, мутация 11778 G→A приводит только к наследственной оптической нейропатии Лебера (LHON). Другая мутация, например 3243 A→G, вызывает огромное количество клинических проявлений, которые могут затрагивать центральную нервную систему, периферическую нервную систему, эндокринную систему, сердце, глаза, уши, желудочно-кишечный тракт, почки и кожу. Причем, все эти органы и системы органов могут поражаться как в совокупности, так и индивидуально. Третьим вариантом гетерогенности является синдром Лея, который могут вызывать около 30 мутаций мтДНК, а также мутации более чем в 20 генах ядерной ДНК, кодирующей белки биогенеза митохондрий.
Особенностью митохондриальных заболеваний, обусловленных мутациями мтДНК, является материнский тип наследования (в норме митохондрии передаются только через ооциты). Стоит отметить, однако, что митохондриальное наследование, на первый взгляд, можно спутать с X-сцепленным рецессивным наследованием – в обоих случаях болеют дети больной женщины. Разница же заключается в соотношении полов больного потомства: при митохондриальном наследовании все дети имеют равный шанс заболеть, в то время как при X-сцепленном рецессивном наследовании мутация клинически проявляется лишь у мужского пола. Отдельно стоит выделить спорадические случаи – мутация, возникшая в мтДНК de novo, также может спутать понимание характера наследования. Таким образом, анализ родословных является неотъемлемой частью постановки диагноза.
Исследование митохондриальной ДНК
В отличие от яДНК, которая представлена в большинстве клеток человека в двух копиях, мтДНК насчитывает от сотен до тысяч копий на клетку. С практической точки зрения, огромное число копий мтДНК является несомненным преимуществом при анализе структуры этой молекулы, поскольку позволяет работать с минимальным количеством имеющегося биологического материала. Другой, не менее важной особенностью, являющейся следствием многокопийности мтДНК, является феномен гетероплазмии, то есть состояние, когда в рассматриваемой системе (клетка, орган, организм) наблюдается сосуществование мутантной и нормальной мтДНК, в отличие от гомоплазмии, когда все мтДНК идентичны. Интересно, что состояние гетероплазмии является одним из критериев патогенности мутации. Величина гетероплазмии, а также распределение мутантных мтДНК в организме, во многом определяет фенотипическое проявление мутации мтДНК, на практике – клиническую картину заболевания.
Для того чтобы патогенная мутация проявилась фенотипически, количество мтДНК, содержащее эту мутацию (уровень ее гетероплазмии) должны превысить определенное критическое значение. Считается, что превышение 70% барьера приводит к клиническому проявлению той или иной патогенной мутации мтДНК, и носит название порогового эффекта. Тем не менее, определенные мутации могут иметь довольно низкий пороговый эффект, что может привести к сложностям в выявлении таких мутации некоторыми молекулярно-генетическими методами (например, ПДРФ-анализом). Таким образом, существует необходимость точной оценки количества мутантных мтДНК [2]. Следует заметить, что оценка уровня гетероплазмии уже включает детекцию мутаций, в то время как некоторые используемые в лабораторной практике методы обнаружения мутации не всегда учитывают уровень ее гетероплазмии.
Диагностика наследственного заболевания
Молекулярно-генетическое подтверждение, в идеале, является конечным этапом дифференциальной диагностики любого наследственного заболевания, однако, в случае митохондриальной патологии лишь меньше, чем в половине случаев удается обнаружить патогенную мутацию. Для установления вердикта «митохондриальное заболевание», однако, достаточно выявить «рваные красные волокна» в биоптатах скелетных мышц и повышение уровня лактата и пирувата в крови и/или ликворе (лактатный ацидоз). С другой стороны, оба этих признака сами по себе не являются специфическими для митохондриальных заболеваний. В качестве диагностического критерия может быть наличие, на первый взгляд, не связанных между собой клинических признаков. Определение активности комплексов окислительного фосфорилирования также является одним из ключевых моментов дифференциальной диагностики [3, 4].
Свои особенности имеет биохимический профиль биологических жидкостей при митохондриальных патологиях. Сразу стоит отметить, что лабораторная диагностика митохондриальных заболеваний – это подчас весьма специфические исследования, которые может позволить себе не каждая лаборатория. В плазме и спинномозговой жидкости выявляют повышенный уровень таких аминокислот как аланин, глицин, пролин, саркозин и тирозин. Со стороны органических кислот наблюдаются следующая картина: повышен уровень компонентов цикла трикарбоновых кислот, этилмалоновой кислоты, 3-метилглутаконовой кислоты и бикарбоновых кислот. В крови наблюдается снижение уровня общего карнитина.
Возможно ли лечение?
Несмотря на значительный прогресс диагностике и понимании молекулярного патогенеза данного класса заболеваний, к настоящему времени, митохондриальные заболевания остаются неизлечимы. Используемые в клинической практике стратегии симптоматического лечения включают применение фармакологических средств, специальных диет, а также физических нагрузок. В некоторых случаях применяется хирургическое вмешательство. Также в настоящее время разрабатываются различные экспериментальные подходы, направленные на устранение дефектов дыхательной цепи митохондрий на молекулярном уровне [2, 5].
На сегодняшний день наиболее приемлемым методом предотвращения митохондриального заболевания остается предотвращение передачи мутантных генов следующему поколению [6]. Основными стратегиями предотвращения передачи дефектов генетического материала потомству принято считать пренатальную диагностику (ПНД) и преимплантационную генетическую диагностику (ПГД). Для мутаций ядерного генома такие процедуры считаются приемлемыми. Применение же подобных процедур к дефектам митохондриального генома имеет известные ограничения. Главным образом для большинства мутаций мтДНК это связано с плохой корреляцией между уровнем гетероплазмии и тяжестью заболевания, неравномерным распределением мутантной ДНК в тканях организма, и изменением уровня гетероплазмии в течение жизни человека [7].
Список литературы:
1. Turnbull H.E., Lax N.Z., Diodato D., Ansorge O., Turnbull D.M. The mitochondrial brain: From mitochondrial genome to neurodegeneration // Biochim. Biophys. Acta. 2010. V. 1802. P. 111–121.
2. Мазунин И.О., Володько Н.В., Стариковская Е.Б., Сукерник Р.И. Митохондриальный геном и митохондриальные заболевания человека // Мол. Биол. 2010. Т. 44. №. 5. С. 755– 772.
3. Иллариошкин С.Н. Алгоритм диагностики митохондриальных энцефаломиопатий // Атмосфера. Нервные болезни. 2007. Т. 3. С. 23–27.
4. Haas R.H., Parikh S., Falk M.J., Saneto R.P., Wolf N.I., Darin N., Wong L.J., Cohen B.H., Naviaux R.K. The in-depth evaluation of suspected mitochondrial disease // Mol. Genet. Metab. 2008. V. 94. P. 16–37.
5. Finsterer J. Treatment of mitochondrial disorders // Eur. J. Paediatr. Neurol. 2010. V. 14. P. 29–44.
6. Мазунин И.О., Володько Н.В. Митохондрии: жизнь в клетке и ее последствия // ПРИРОДА. 2010. № 10. С. 3–14.
Митохондриальная днк что это такое
Некоторые родословные наследственных болезней не могут объясняться типичным менделирующим наследованием ядерных генов. Теперь известно, что они вызваны мутациями митохондриального генома и проявляют материнское наследование. Болезни, вызываемые мутациями в митДНК, демонстрируют множество необычных особенностей, происходящих из уникальных характеристик биологии и функции митохондрий.
Митохондриальный геном
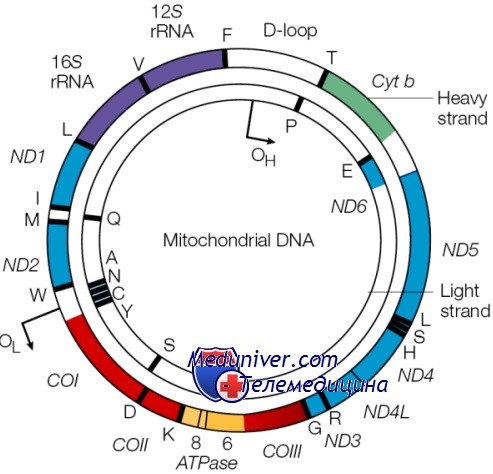
Не вся РНК и белок, синтезируемые в клетке, кодируются ДНК ядра; небольшая, но важная доля кодируется в генах митохондриального генома. Этот геном состоит из кольцевой хромосомы размером 16,5 килобазы, располагающейся в органеллах митохондриях, а не в ядре. Большинство клеток содержит по крайней мере 1000 молекул митДНК, распределенных по сотням отдельных митохондрий. Важное исключение — зрелый овоцит, имеющий более 100 000 копий митДНК, формирующих до одной трети общего содержания ДНК в этих клетках.
Митохондриальная хромосома содержит 37 генов. Они кодируют 13 полипептидов — компонентов ферментов окислительного фосфорилирования, два типа рРНК и 22 тРНК, необходимых для трансляции транскриптов генов митохондрий. Остальные полипептиды комплекса окислительного фосфорилирования кодируются ядерным геномом.
В митДНК обнаружено более 100 различных перестроек и 100 разных точковых мутаций, вызывающих болезни у человека, часто поражающие ЦНС и мышечно-скелетную систему (например, миоклонус-эпилепсия с «рваными» красными волокнами — MERRF). Болезни, вызванные этими мутациями, имеют отличающийся тип наследования из-за трех необычных характеристик митохондрий: репликативной сегрегации, гомоплазмии и гетероплазмии, а также материнского наследования.
Репликативная сегрегация митохондриальной хромосомы
Первая уникальная характеристика митохондриальной хромосомы — отсутствие управляемой сегрегации, наблюдаемой в митозе и мейозе 46 ядерных хромосом. При делении клетки многочисленные копии митДНК в каждой митохондрии клетки копируются и произвольно расходятся во вновь синтезированные митохондрии. Митохондрии, в свою очередь, случайно распределяются между дочерними клетками. Этот процесс известен как репликативная сегрегация.
Гомоплазмия и гетероплазмия митохондриальной хромосомы
Вторая уникальная характеристика генетики митДНК возникает из-за того, что большинство клеток содержат много копий молекул митДНК. Когда мутация возникает в митДНК, она сначала присутствует только в одной из молекул в митохондрии. В ходе репликативной сегрегации митохондрия, содержащая мутантную митДНК, производит многочисленные копии мутантнои молекулы.
При делении клетка, содержащая смесь нормальных и мутантных митохондриальных ДНК, может передавать в дочерние клетки весьма различающиеся пропорции мутантнои и дикой митДНК. Одна дочерняя клетка может случайно получить митохондрии, содержащие чистую популяцию нормальных или чистую популяцию мутантных митохондриальных ДНК (ситуация, известная как гомоплазмия). Кроме того, дочерняя клетка может получить смесь митохондрий с мутацией и без нее (гетероплазмия).
Поскольку фенотипическая экспрессия мутации в митДНК зависит от относительных пропорций нормальной и мутантнои митДНК в клетках, формирующих различные ткани, неполная пенетрантность, переменная экспрессивность и плейотропия — типичные характеристики митохондриальных болезней.
Материнское наследование митохондриальной ДНК
Результат, определенный характеристиками генетики митДНК, называется материнским наследованием. Митохондрии сперматозоидов обычно отсутствуют в эмбрионе, поэтому митДНК наследуется от матери. Таким образом, все дети женщины, гомоплазмической по мутации митДНК, унаследуют мутацию, тогда как ни один из потомства мужчины, несущего ту же мутацию, не унаследует дефектную ДНК.
Материнское наследование гомоплазмической мутации митДНК, вызывающей наследственную нейропатию зрительного нерва Лебера.
Особенности материнского наследования при гетероплазмии у матери выявляют дополнительные характеристики генетики митДНК, имеющие медицинское значение. Во-первых, небольшое число молекул митДНК в развивающихся овоцитах впоследствии увеличивается до огромного количества, наблюдаемого в зрелых овоцитах. Это ограничение с последующим умножением митДНК в ходе овогенеза характеризуют так называемое «бутылочное горлышко» генетики митохондрий.
Именно поэтому вариабельность процентного содержания мутантных молекул митДНК, обнаруживаемая в потомстве матери с гетероплазмией, возникает, по крайней мере частично, вследствие увеличения только части митохондриальных хромосом в овогенезе. Можно ожидать, что мать с высокой пропорцией мутантных молекул митДНК более вероятно произведет яйцеклетки с высокой пропорцией мутантных молекул митДНК, и, следовательно, более клинически пораженное потомство, чем мать с более низкой пропорцией. Есть одно исключение из материнского наследования, когда у матери имеется гетероплазмия по делеции в митДНК; по неизвестным причинам делеционная молекула митДНК обычно не передается от клинически больных матерей их детям.
Хотя митохондрии почти всегда наследуются исключительно через мать, существует, по крайней мере, один пример отцовского наследования митДНК у пациентов с митохондриальной миопатией. Следовательно, у пациентов с наблюдаемыми спорадическими мутациями митДНК должна учитываться редкая возможность отцовского наследования митДНК.
Точное определение семейной родословной — важная часть работы с каждым пациентом. Родословные могут демонстрировать как типичные менделирующие варианты наследования, так и более редкие, вызванные митохондриальными мутациями и половым мозаицизмом; или сложные варианты семейных случаев, не соответствующие ни одному из типов наследования. Определение типа наследования важно не только для установления диагноза у пробанда, это также идентифицирует других индивидуумов в семье, находящихся в группе риска и нуждающихся в обследовании и консультировании.
Несмотря на сложные цитогенетические и молекулярные анализы, используемые генетиками, точная семейная история, включая родословную семьи, остается фундаментальным средством для всех врачей и генетических консультантов, используемым при планировании индивидуального лечения пациентов.
Характеристика митохондриального наследования:
• Женщины, гомоплазматические по мутации, передают эту мутацию всем детям; мужчины с аналогичной мутацией — нет.
• Женщины, гетероплазматические по точко-вым мутациям и дупликациям, передают их всем детям. Доля мутантных митохондрий у потомков и, следовательно, риск развития и тяжесть болезни могут значительно меняться в зависимости от доли мутантных митохондрий у матери, а также случайно, вследствие небольшого числа митохондрий в «бутылочном горлышке» при созревании овоцитов. Гетероплазматические делеции обычно не наследуются.
• Доля мутантных митохондрий в разных тканях гетероплазматических по мутации пациентов может значительно меняться, вызывая различные проявления болезни в одной семье с гетероплазмией митохондриальной мутации. Часто наблюдаются плейотропизм и вариабельная экспрессивность у разных больных в одной семье.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Анализ митохондриальной ДНК в «Медикал Геномикс» в Санкт-Петербурге
Представьте, что у вас есть небольшой, состаренный костный фрагмент или обгоревшие останки после пожара, зуб, который был похоронен и подвергался воздействию окружающей среды в течение многих лет или десятилетий, или, возможно, один волос. Как бы вы начали делать идентификацию, чтобы заново связать эти останки с членами семьи?
В этих небольших и скомпрометированных образцах часто ядерной ДНК недостаточно для получения полезных результатов с помощью современных методов типирования. С начала 1990-х годов анализ митохондриальной ДНК (мтДНК) использовался в этих наиболее сложных случаях. Клетки человека содержат только две копии ядерной ДНК, но могут содержать примерно 500-1000 копий небольшого генома мтДНК (16,5).
Анализ мтДНК в лаборатории Медикал Геномикс обеспечивает повышенную дискриминационную силу, что приводит к созданию более уникальных гаплотипов, помогающих улучшить идентификации, обеспечивая результат не ниже 99,999%.
Что такое Митохондриальная ДНК
Митохондрии представляют собой структуры внутри клеток, которые преобразуют энергию из пищи в форму, которую клетки могут использовать. Каждая клетка содержит от сотен до тысяч митохондрий, которые находятся в жидкости, которая окружает ядро (цитоплазму). Хотя большая часть ДНК упакована в хромосомы внутри ядра, митохондрии также имеют небольшое количество собственной ДНК.
Этот генетический материал известен как митохондриальная ДНК или мтДНК. У человека митохондриальная ДНК охватывает около 16 500 строительных блоков ДНК (пар оснований), представляющих небольшую долю общей ДНК в клетках. Митохондриальная ДНК содержит 37 генов, каждый из которых необходим для нормальной функции митохондрий.
Митохондриальный анализ ДНК
Митохондриальный ДНК-тест (мтДНК-тест) отслеживает матрилинейное или материнское происхождение человека с использованием ДНК в его или ее митохондриях. мтДНК передается матерью без изменений всем ее детям, как мужчинам, так и женщинам. Таким образом, анализ митохондриальной ДНК может проходить как мужчина, так и женщина. Если будет найдено идеальное совпадение с результатами теста мтДНК другого человека, можно найти общего предка в «информационной таблице» другого родственника (матрилинейной).
Основные показания к проведению анализа митохондриальной ДНК
Данный тип исследований используется при: