Младенческая нейтропения что это такое
Младенческая нейтропения что это такое

Поиск
Нейтропении у детей
Нейтропении встречаются в виде синдрома или диагностируются как первичное заболевание нейтрофильных лейкоцитов и/или их предшественников. Критерием нейтропении является абсолютное уменьшение количества нейтрофилов (палочкоядерные + сегментоядерные): у детей до 1 года ниже 1 тыс. в 1 мкл, после 1 года — менее 1,5 тыс. в 1 мкл крови.
I. Нарушение продукции нейтрофилов в костном мозге вследствие дефекта клеток-предшественниц и/или микроокружения, или миграция нейтрофилов в периферическое русло (наследственные нейтропении, синдром нейтропении при апластической анемии).
II. Нарушение соотношения циркулирующих клеток и пристеночного пула, накопление нейтрофилов в очагах воспаления — перераспределительные нейтропении.
III. Деструкция нейтрофилов в периферическом русле и в различных органах фагоцитами — иммунные нейтропении и гемофагоцитарные синдромы, секвестрация при инфекциях, воздействие других факторов.
Могут быть сочетания различных вышеуказанных этиологических факторов.
Синдром нейтропении характерен для многих заболеваний крови (острый лейкоз, апластическая анемия, синдром Швахмана-Дайемонда, миелодиспластический синдром), соединительной ткани, первичных иммунодефицитов (Х-сцепленная агаммаглобулинемия, Х-сцепленный гипер Ig M, общая вариабельная иммунологическая недостаточность), вирусных и некоторых бактериальных инфекций.
Нейтропении делят на первичные и вторичные, наследственные и приобретенные.
Среди первичных нейтропений выделяют генетически детерминированные (наследственные), иммунные и хроническую доброкачественную нейтропению детского возраста.
Клиническая картина обусловлена прежде всего выраженностью нейтропении, а течение болезни зависит от ее причины и формы.
Легкие нейтропении могут протекать бессимптомно, или у больных возникают частые ОРВИ, локализованная бактериальная инфекция, хорошо поддающаяся стандартным методам лечения.
Среднетяжелые формы характеризуются частыми рецидивами локализованной гнойной инфекции, ОРВИ, рецидивирующей инфекцией ротовой полости (стоматит, гингивит, пародонтоз). Может быть бессимптомное течение, но с агранулоцитозом.
Тяжелые нейтропении сопровождаются выраженной интоксикацией, лихорадкой, частыми тяжелыми бактериальными и грибковыми инфекциями, некротическими поражениями слизистых, реже кожи, деструктивными пневмониями, повышенным риском развития сепсиса и высокой летальностью при неадекватной терапии.
1) развитие болезни, отягощенный семейный анамнез;
2) клиническая симптоматика;
3) гемограмма в динамике с подсчетом количества тромбоцитов еженедельно в течение месяца (2-3 раза в неделю в течение 2-х месяцев при подозрении на циклическую форму);
4) миелограмма при тяжелой и среднетяжелой нейтропении;
5) определение сывороточных иммуноглобулинов;
6) исследование титра антигранулоцитарных антител (АГАТ) в сыворотке крови больного с определением антител к мембране и цитоплазме нейтрофилов с помощью моноклональных антител — по показаниям (характерно для вирус-ассоциированных форм);
7) по показаниям — специальные тесты (культуральные, цитогенетические, молекулярно-биологические).
Больному с абсолютным количеством нейтрофилов менее 500 в мкл и лихорадкой, независимо от предполагаемой причины нейтропении, немедленно должна быть начата эмпирическая антибактериальная терапия. Дальнейшая тактика определяется характером и течением нейтропении.
Среди первичных наследственных нейтропений выделяют:
1) хронические нейтропении с нарушением созревания нейтрофилов в костном мозге на уровне про- и миелоцитов («с высоким обрывом созревания»), включая болезнь Костмана;
2) циклические нейтропении;
3) хроническая нейтропения с нарушением выхода гранулоцитов из костного мозга (миелокахексия).
Общими диагностическими критериями наследственных нейтропений являются:
· манифестная клиническая картина с первых месяцев жизни;
· постоянная или циклическая нейтропения (200-1000 нейтрофилов в мкл) в сочетание с моноцитозом и в половине случаев с эозинофилией;
· изменения в миелограмме определяются формой заболевания;
· молекулярно-биологические методы могут выявить генетический дефект.
Синдром Костмана (детский генетически детерминированный агранулоцитоз) — наиболее тяжелая форма наследственной нейтропении. Тип наследования — аутосомно-рецессивный, но могут быть спорадические случаи и доминантный тип наследования.
Дебют заболевания в первые месяцы жизни или в период новорожденности в виде тяжелых рецидивирующих бактериальных инфекций — стоматита, гингивита, пневмонии, в том числе деструктивной. У ребенка выраженный агранулоцитоз: количество нейтрофилов менее 300 в 1 мкл. Миелограмма: только промиелоциты и/или миелоциты, увеличено число эозинофилов и моноцитов. В промиелоцитах встречаются атипичные ядра, крупные азурофильные гранулы и вакуоли в цитоплазме. У части больных (преимущественно при спорадических случаях) выявляется мутация гена (ген ELA-2), кодирующего образование эластазы нейтрофилов. В процессе жизни часть больных синдромом Костмана (13-27%) приобретают точечную мутацию гена рецептора — G-CSF. Эти пациенты относятся к группе высокого риска по развитию острого миелобластного лейкоза и миелодиспластического синдрома.
Лечение: 1) колониестимулирующие факторы (КСФ) — G-CSF (филграстим и ленограстим) в суточной терапевтической дозе 6-10 мкг/кг подкожно. Поддерживающая доза индивидуальная, она необходима для поддержания абсолютного количества нейтрофилов более 1000 в 1 мкл. Применяется пожизненно;
2) в период обострения инфекций — антибиотики широкого спектра действия, противогрибковые препараты;
3) в крайне тяжелых случаях показаны трансфузии донорских гранулоцитов;
4) при резистентности к лечению КСФ или появлении мутации гена рецептора G-CSF показана аллогенная трансплантация костного мозга.
Без специального лечения больные раньше погибали в раннем возрасте.
Циклическая нейтропения (ЦН)
ЦН — редкое (1-2 случая на 1 млн населения) аутосомно-рецессивное заболевание. Семейные варианты имеют доминантный тип наследования и дебютируют, как правило, на первом году жизни. Встречаются спорадические случаи — в любом возрасте. В основе ЦН лежит нарушение регуляции гранулоцитопоэза с нормальным, даже повышенным содержанием КСФ — в период выхода больного из криза.
Клинически заболевание проявляется регулярно повторяющимися с определенной периодичностью нейтропеническими кризами, во время которых у больных возникает лихорадка, стоматиты, гингивит, фарингиты, лимфадениты и другие очаги локализованной бактериальной инфекции, редко могут быть абсцессы в легких и септицемия. Вне криза состояние больных нормализуется. Развитие инфекций обусловлено падением числа нейтрофилов до единичных; кроме того, в гемограмме отмечается моноцитоз и эозинофилия. Длительность криза — 3-10 дней, после чего показатели гемограммы нормализуются. Интервалы между кризами составляют 21 день (14 дней — 3 месяца). Диагноз ЦН документируется результатами анализов крови 2-3 раза в неделю в течение 8 недель.
Лечение: 1) G-CSF 3-5 мкг/кг подкожно. Препарат вводят за 2-3 дня до криза и продолжают до нормализации гемограммы. Другая тактика — постоянная терапия КСФ ежедневно или через день 2-3 мкг/кг. Этого достаточно, чтобы поддерживать число нейтрофилов более 500 в мкл, что обеспечивает удовлетворительное качество жизни;
2) при развитии инфекций — антибиотики и местная терапия.
Хроническая генетически детерминированная нейтропения с нарушением выхода нейтрофилов из костного мозга (миелокахексия)
Заболевание с аутосомно-рецессивным типом наследования. Нейтропения обусловлена двумя дефектами: укорочением жизни нейтрофилов, их ускоренным апоптозом на территории костного мозга и снижением хемотаксиса. Кроме того, снижена фагоцитарная активность нейтрофилов.
Клиника: на первом году рецидивирующая локализованная бактериальная инфекция (пневмония, стоматиты, гингивит). В периферической крови нейтропения и лейкопения в сочетании с моноцитозом и эозинофилией. На фоне бактериальных осложнений — нейтрофильный лейкоцитоз, который через 2-3 дня сменяется лейкопенией. Миелограмма: костный мозг нормо- или гиперклеточный, увеличен гранулоцитарный ряд с нормальным соотношением клеточных элементов и преобладанием зрелых клеток. Наблюдается гиперсегментация ядер сегментоядерных нейтрофилов костного мозга, вакуолизация цитоплазмы, количество гранул снижено.
Лечение: антибиотики, КСФ, донорские гранулоциты.
Хроническая доброкачественная нейтропения детского возраста
Возникает спонтанно на 1-2 году жизни, разрешается самостоятельно к 2-5 годам. Протекает в нетяжелой форме. Количество нейтрофилов 500-1000 в 1 мкл. В пунктате костного мозга снижено количество сегментоядерных нейтрофилов, повышено число палочкоядерных нейтрофилов.
Лечение стандартное. Профилактические прививки проводятся по возрасту при абсолютном числе нейтрофилов более 800 в 1 мкл.
· трансиммунная — при наличии у матери аутоиммунной нейтропении;
· диффузные заболевания соединительной ткани (системная красная волчанка, ювенильный ревматоидный артрит, склеродермия);
· лимфопролиферативные заболевания (болезнь Ходжкина, неходжкинские лимфомы, хронический лимфолейкоз);
Первичные иммунные нейтропении встречаются преимущественно у детей первых двух лет жизни.
Изоиммунная (аллоиммунная) нейтропения возникает у плода вследствие антигенной несовместимости нейтрофилов его и матери. Изоантитела матери (Ig G) проникают через плаценту и разрушают нейтрофилы плода.
Частота — 2 на 1000 новорожденных. Течение бессимптомное или нетяжелое, редко — тяжелое. Диагноз ставится в периоде новорожденности или в первые 3 месяца жизни. В сыворотке крови ребенка выявляют изоантитела.
При отсутствии инфекций лечения не требуется. В случае их наличия — антибиотики, при среднетяжелой форме дополнительно внутривенный иммуноглобулин G (ВВИГ G), тяжелой — G-CSF в сочетании с ВВИГ G и антибиотиками широкого спектра действия.
Аутоиммунная нейтропения (АИН) составляет 65% от первичных нейтропений.
· наличие аутоантигранулоцитарных антител в сыворотке крови больного — основной критерий;
· связь с перенесенной инфекцией (чаще вирусной) и/или с приемом лекарств (сульфаниламиды, нестероидные противовоспалительные средства и др.);
· повышение уровня плазматических клеток в периферической крови;
· другие иммунные цитопении.
По течению выделяют острые (до 4-х мес.) и хронические (более 4-х мес.) аутоиммунные нейтропении; по степени тяжести — легкие, среднетяжелые и тяжелые.
У детей раннего возраста преобладают острые нетяжелые нейтропении. Абсолютная нейтропения составляет 500-1000 в 1 мкл. У детей старшего возраста чаще развивается острая тяжелая АИН — это острый иммунный агранулоцитоз. Клинически проявляется лихорадкой, фарингитом, стоматитом, пневмонией, при неадекватной терапии быстро развивается сепсис с высокой летальностью.
Лечение. Легкие формы лечения не требуют. При среднетяжелой и тяжелой форме АИН назначают кортикостероиды из расчета 2-5 мг/кг/сутки, а также ВВИГ G в курсовой дозе 1,5-2 г/кг. Препаратами выбора являются G-CSF 8-10 мкг/кг/сутки в сочетании с базисной терапией (антибиотики, противогрибковые и противовирусные средства). При хронической АИН эффективны G-CSF и ВВИГ G.
Профилактические прививки рекомендуются через год. При тяжелых формах и хроническом течении тактика индивидуальная.
У детей развиваются редко, чаще в старшем возрасте. Механизм развития: иммунный или цитотоксический. Может быть лекарственная идиосинкразия, обусловленная ферментопатией или расстройствами метаболизма у пациента. В качестве лечения рекомендуется отменить препарат или уменьшить дозу. В тяжелых случаях назначаются КСФ и проводится посиндромная терапия.
А.М. Ожегов
Ижевская государственная медицинская академия
Ожегов Анатолий Михайлович — доктор медицинских наук, профессор, заведующий кафедрой педиатрии и неонатологии
1. Алмазов В.А., Афанасьев Б.В., Зарицкий А.Ю., Шишков А.Л. Лейкопении. Л.: Медицина, 1981. 240 с.
2. Практическое руководство по детским болезням: гематология/онкология детского возраста. Под общей ред. Коколиной В.Ф. и Румянцева А.Г. М.: Медпрактика, 2004. 791 с.
3. Резник Б.Я., Зубаренко А.В. Практическая гематология детского возраста. Киев.: Здоровья, 1989. 400 с.
4. Руководство по гематологии. Под ред. Воробьева А.И. М.: Медицина, 1985. 447 с.
Анализ крови у детей и прививки
Поделиться:
Клинический анализ крови в РФ входит в стандарт обследования перед вакцинацией. Мое мнение, что чаще всего он совершенно не нужен, если например ребенок с виду здоров и никаких жалоб нет. Тем не менее анализ сдают и нередко трактуют результаты совершенно неадекватно.
Многие лаборатории банально «забивают» на тот факт, что интерпретация результатов анализа крови у ребенка имеет свои особенности. И просто пишут анализы на стандартных бланках, где рядом с результатами анализа в столбике напечатаны «нормы». Но с этими нормами детские показатели сравнивать нельзя!
О детских нормах гемоглобина
Сколько нервотрепки доставляют родителям эти бланки с «отклонениями» от нормы! Сколько тревожных звонков и писем обрушивается на педиатра! Я и мои коллеги ежедневно вынуждены развеивать страхи родителей, которые пытаются самостоятельно оценить полученные анализы своих детей.
Например, гемоглобин. У взрослых его норма составляет от 120 до 150 г/л. У детей же все сложнее. Если сразу после рождения «нормальный» гемоглобин составляет 180–220 г/л, то уже к 2–3 месяцам жизни его уровень стремительно падает до нижней границы нормы, которая начинается от 90 г/л. Это так называемая физиологическая анемия. И поскольку это норма, лечить ее не надо.
Читайте также:
Таблетки для гемоглобина
Тем не менее этот факт почему-то всеми дружно забывается, и вот двухмесячному ребенку с очень неплохим для его возраста уровнем гемоглобина 105 г/л ставится диагноз анемия.
Медотвод от прививок
И ладно если бы все дело ограничилось только назначением препаратов железа. Но некоторые мои коллеги почему-то обожают в этой ситуации назначать медотвод от вакцинации. Мол, человек ослаблен, с прививкой надо повременить.
Читайте также:
Вакцина от коклюша
Но, во-первых, анемии нет, смотрим нормы выше. (Для окончательного решения можно сдать дополнительные анализы.)
Во-вторых, если разобраться, вакцина нам нужна для чего? Чтобы пациента защитить. А кто наиболее подвержен заболеванию? У кого будет протекать инфекция тяжелее? Правильно, у ослабленного. Получается, что даже если у пациента и есть легкая анемия, это не является противопоказанием к вакцинации. Наоборот, ослабленных пациентов нужно прививать в первую очередь.
О детских нормах лейкоцитов
Вообще, благодаря определению концентрации в крови лейкоцитов можно решить, какая у пациента инфекция — бактериальная (если повышены) или вирусная (если понижены). А соответственно, нужен антибиотик или нет.
У взрослых людей содержание лейкоцитов в норме колеблется от 4 до 9 тысяч в мкл. Но у детей опять все по-другому. Так, при рождении верхняя граница нормы лейкоцитов может достигать 30–34 тысяч в мкл, до года содержание лейкоцитов — от 5 до 18 тысяч в мкл, после года — от 4 до 12 тысяч в мкл. И это все — ЗДОРОВЫЕ дети.
Лейкоцитарная формула
Кроме лейкоцитов в лаборатории могут посчитать количество нейтрофилов (палочкоядерных и сегментоядерных) и лимфоцитов. Повышенное содержание нейтрофилов (нейтрофилез) часто свидетельствует о бактериальной инфекции, лимфоцитоз — о вирусной.
У взрослых в норме больше нейтрофилов, чем лимфоцитов. У детей опять же все сложнее. Сразу после рождения лимфоцитов меньше, чем нейтрофилов, как и у взрослого человека. Но уже на пятый день жизни возникает так называемый «первый перекрест», когда количество нейтрофилов становится равным лимфоцитам.
Сразу после этого количество лимфоцитов начинает расти и в норме остается выше, чем содержание нейтрофилов, вплоть до 4–5 лет жизни, когда возникает «второй перекрест». И это не лимфоцитоз, это норма. После 5 лет ситуация меняется и количество лимфоцитов снова начинает уступать нейтрофилам, как и у взрослых людей.
Детская доброкачественная нейтропения
Отдельно остановлюсь на одном отклонении от нормы в анализе крови, при котором снижается количество нейтрофилов. Это так называемая доброкачественная нейтропения детского возраста. В норме у детей до года нейтрофилов должно быть больше 1000 в мкл, после года — больше 1,5 тысяч. Но бывает, что нейтрофилов оказывается «ощутимо» меньше.
Встречается этот феномен очень часто, но клинически себя никак не проявляет. Несмотря на то что нейтрофилы отвечают за сопротивление бактериальным инфекциям, их в организме человека всегда «с запасом», поэтому такое снижение никак не отражается на здоровье.
Безусловно, для дифференциального диагноза с другими нейтропениями может потребоваться осмотр гематолога. Но если диагноз доброкачественной нейтропении подтверждается, то никаких ограничений нет, лечение не требуется.
Тем не менее и эту особенность детского анализа крови зачем-то используют для того, чтобы отсрочить вакцинацию. Хотя опять же возвращаясь к вышесказанному: кого нужно защитить в первую очередь? Ослабленных, со сниженным иммунитетом. А значит, пациентов с доброкачественной нейтропенией нужно прививать в первую очередь, по крайней мере инактивированными вакцинами.
Нейтропения (пониженное количество белых кровяных клеток)
Эта информация разъясняет, что такое нейтропения (пониженное количество белых кровяных клеток) и как предотвратить инфекцию при нейтропении.
Информация о нейтропении
Нейтропения — это состояние, при котором снижено количество нейтрофилов (разновидность белых кровяных клеток) в вашей крови. Уровень нейтрофилов считается низким, если он ниже 500 клеток/мм3. Нейтропения часто возникает после определенных видов лечения рака.
Нейтрофилы помогают вашему организму бороться с инфекцией. При нейтропении у вас повышенный риск возникновения инфекции. Повышение температуры до 100,4 °F (38,0 °C) и выше обычно является первым признаком развития инфекции. Для предотвращения развития инфекции вы должны следовать указаниям этого материала до тех пор, пока количество нейтрофилов не станет нормальным.
Следите за любыми признаками инфекции, перечисленными в этом материале. Если у вас есть какие-либо признаки или симптомы инфекции, позвоните своему медицинскому сотруднику. Обязательно измеряйте температуру перорально (во рту) в соответствии с указаниями вашего медицинского сотрудника. Сообщите своему медицинскому сотруднику, если температура поднялась до 100,4 °F (38 °C) или выше.
Соблюдайте правила личной гигиены
При нейтропении важно соблюдать правила личной гигиены. Следуйте рекомендациям этого раздела. Для получения дополнительной информации о гигиене рук ознакомьтесь с материалом Гигиена рук и предотвращение инфекций
Как предотвратить инфекцию
Ниже описаны некоторые способы предотвращения инфекции:
Когда следует обращаться к своему медицинскому сотруднику?
Немедленно свяжитесь со своим медицинским сотрудником, если у вас появился какой-либо из следующих признаков инфекции:
Нейтропения
Нейтропения — заболевание, при котором в крови снижается уровень нейтрофилов или нарушается их выработка. Нейтрофилы — главные защитные клетки организма от грибковых, вирусных и бактериальных инфекций.
Причины нейтропении
Нейтрофилы развиваются в костном мозге в срок до двух недель. После этого они поступают в кровеносную систему в поисках болезненных микроорганизмов. В случае их обнаружение нейтрофилы вырабатывают токсические вещества и уничтожают вредителей. Это всем известный процесс, когда воспаление на коже краснеет и слегка припухает. Когда нейтрофилы понижены, организм становится чрезвычайно уязвимым для различных инфекций.
Причины нейтропении:
Помимо этого, нейтропения у детей может развиться в связи с нарушением функционирования поджелудочной железы (синдром Швахмана-Даимонда-Оски).
Симптоматика нейтропении
Нейтропения не имеет специфических симптомов. Более того хроническая форма может развиваться в течение нескольких лет практически незаметно. Проявления нейтропении связаны с возникновением инфекционных заболеваний и невозможностью организма бороться с ними.
Общие симптомы острой формы заболевания:
Кроме того симптомами нейтропении у детей, которые страдают синдромом Швахмана-Даимонда-Оски, является заторможенные рост и умственное развитие.
Диагностика и лечение нейтропении
Для установления диагноза проводится общий анализ крови. Однако могут потребоваться и дополнительные исследования. Часто для этого используют миелограмму — анализ клеточного состава пункции костного мозга. У детей до года диагностируют нейтропению, когда количество нейтрофилов ниже 1 тысячи, а у детей старше года — меньше 1,5 тысяч в 1 миллилитре крови.
После того как причина возникновения нейтропении будет установлена, врач назначит индивидуальную терапию. При острой форме заболевания требуется незамедлительная госпитализация. В таких случаях проводят интенсивную антибактериальную терапию. Больного помещают в изолированную стерильную комнату и регулярно облучают УФ лучами.
Как правило, в первую очередь лечение направлено на борьбу с инфекцией и повышение иммунитета. В курс медикаментозного лечения входят антибиотики, глюкокортикоиды и витаминотерапия (фолиевая кислота и витамин B12). В тяжелых случаях может потребоваться пересадка костного мозга.
Для удаления язв их обрабатывают перекисью водорода, раствором хлоргексидина и физиологическим раствором. С целью устранения болевых симптомов используют различные болеутоляющие средства.
Младенческая нейтропения что это такое
ФГБУ “Онкологический научный центр им. Н.Н. Блохина” РАМН, Москва
Одним из наиболее частых и опасных побочных эффектов цитостатической терапии
является нейтропения. Цитостатики, действуя на быстроделящиеся клетки, затрагивают и систему кроветворения. Циркулирующие нейтрофилы живут в среднем 6–9 часов, и система гемопоэза постоянно вырабатывает около 50 млн этих клеток в 1 минуту для замещения выбывших. Снижение
продукции нейтрофилов после воздействия химиопрепаратов приводит к быстрому уменьшению содержания этих клеток в периферической крови, что повышает риск развития инфекционных осложнений.
Длительная нейтропения зачастую не позволяет проводить химиотерапию (ХТ) в запланированные сроки, заставляет редуцировать дозы цитостатиков, что в свою очередь снижает эффективность противоопухолевого лечения. Кроме того, инфекционные осложнения на фоне нейтропении в
отсутствие адекватной терапии характеризуются стремительным течением и высокой летальностью. В связи с этим существует необходимость тщательной оценки миелотоксического потенциала современных режимов химиотерапии и выявления групп больных с высоким риском развития нейтропении, которым требуется профилактическое назначение колониестимулирующих факторов (КСФ).
Повышенный риск развития инфекции на фоне нейтропении обусловил выделение симптомокомплекса
“фебрильная нейтропения” (ФН). Согласно руководству NCCN (National Comprehensive Cancer Network) [1], ФН характеризуется повышением температуры в ротовой полости выше 38,5 °С при однократном измерении или выше 38,0 °С при двух последовательных измерениях в течение 2 часов при абсолютном числе нейтрофилов (АЧН) в крови менее 0,5 × 109/л или ожидаемом снижении 10 дней или ФН
после ХТ; вовлечение в опухолевый процесс костного мозга; лучевая терапия в анамнезе; недавно перенесенное оперативное вмешательство; наличие раневого процесса; плохой соматический статус пациента; нарушение функции печени и почек; пневмония; присоединившаяся грибковая инфекция.
Риск развития инфекционных осложнений у больных нейтропенией обусловлен не только уменьшением АЧН, но и нарушением функциональных свойств нейтрофилов (ослабление хемотаксиса и фагоцитоза; нарушение экзогенной продукции ростовых факторов, таких как интерлейкин-1,
интерлейкин-3, гранулоцитарно-макрофагального КСФ, Г-КСФ; изменение активности ферментов; снижение образования активных форм кислорода).
Оценка риска развития ФН должна проводиться перед каждым курсом ХТ. Если пациент в течение предыдущего цикла ХТ перенес эпизод ФН или дозолимитирующей нейтропенической инфекции и проводимая ХТ направлена на выздоровление, проведение последующих курсов ХТ в прежних дозах влечет за собой “высокий риск” развития ФН. В таких случаях необходимо рассмотреть вопрос об использовании КСФ. Если пациент перенес эпизод ФН, несмотря на использование КСФ, NCCN рекомендует провести редукцию доз химиопрепаратов во время последующих циклов или изменить
режим ХТ.
Эти рекомендации основаны на результатах крупных рандомизированных исследований, показавших, что риск развития ФН может быть значи-тельно снижен благодаря проведению первичной профилактики с использованием КСФ.
Vogel и соавт. [4] в двойном слепом рандомизированном плацебо-контролируемом многоцентровом
исследовании установили, что при первом и всех последующих циклах ХТ профилактическое назначение КСФ (пегилированный филграстим) значительно снижает риск развития ФН при режимах ХТ, которые прежде ассоциировались с “высоким риском” этого осложнения. В исследование
были включены больные РМЖ, получавшие доцетаксел 100 мг/м2 каждые 3 недели. Пациентки были распределены в 2 группы: 1-я группа (465 жен-щин) получала инъекции плацебо; 2-я группа (463 женщины) – пегфилграстим подкожно (вводился через 24 часа после завершения цикла ХТ). В группе
плацебо частота развития ФН составила 17 %, в группе пегфилграстима – 1 %. Потребность в госпитализации уменьшилась с 14 до 1%, а в использовании внутривенной антибактериальной терапии (АБТ) – с 10 до 2 % (p 50·× 109/л Граноген следует немедленно отменять.
Успех лечения ФН во многом зависит от раннего распознавания возможной инфекции и раннего начала терапии. Нейтропения значительно ослабляет иммунный ответ организма, что не позволяет развиваться характерным клиническим проявлениям инфекции, затрудняя ее клиническую диагностику у онкологических больных. Гипертермия у пациентов с нейтропенией часто бывает единственным
признаком инфекционного процесса.
Согласно клиническим рекомендациям ESMO, необходимо проводить тщательные первичный осмотр и
обследование на выявление возможных очагов инфекции [8]:
1. Наличие длительно стоящего центрального венозного катетера.
2. Симптомы и признаки наличия инфекции дыхательной системы, сердечно-сосудистой системы,
желудочно-кишечного тракта, кожных покровов, мочеполовой системы, центральной нервной системы.
3. Данные о предшествующих положительных результатах микробиологического анализа.
4. Рутинные лабораторные и инструментальные исследования:
• общий и биохимический анализы крови, коагулограмма, С-реактивный белок;
• посев крови (минимум 2 раза), включая посев из центрального венозного катетера; микроскопическое исследование и посев мочи;
• микроскопическое исследование мокроты и ее посев;
• микроскопическое исследование кала и его посев (при диарее);
• исследование очагов инфекции на коже (аспират, биопсия, мазок);
• рентгенография органов грудной клетки.
5. Дальнейшие исследования (при длительной и глубокой нейтропении): компьютерная томография органов грудной клетки (если лихорадка сохраняется, несмотря на адекватную АБТ, более 72 часов).
Немедленный подсчет формулы крови для установления числа нейтрофилов параллельно с другими исследованиями, представленными выше, имеют ключевое значение для определения необходимости начала ранней терапии ФН.
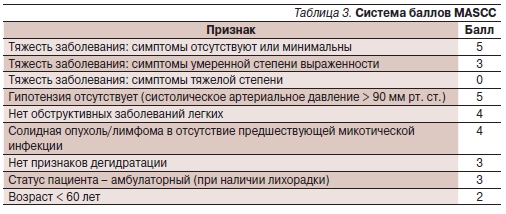
Международной ассоциацией поддерживающей терапии при раке (MASCC) разработан прогностический индекс [9, 10]. Он позволяет быстро оценивать риск осложнений – до того, как станет известно содержание нейтрофилов в крови пациента. Эффективность данного метода подтверждена во многих проспективных исследованиях.
Критерии индекса MASCC представлены в табл. 3.
Показателем “низкого риска” осложнений является сумма баллов > 21. Частота серьезных осложнений при этом не превышает 6 %, а смертность – 1 %. При сумме баллов
1. Crawford J, Althaus D, et al. National Comprehensive Cancer Network. Myeloid growth factors clinical practice guidelines in oncology. J Nat Compreh Cancer Network 2005;3:540–55.
2. ASCO Recommendations for the use of hematopoietic colony-stimulating factors: evidencebased,
clinical practice guidelines. J Clin Oncol 1994;12:2471–250.
3. Zielinski CC, Awada A, Cameron DA, et al. The impact of new European Organisation for Research and Treatment of Cancer guidelines on the use of granulocyte colony-stimulating factor on the management of breast cancer patients. Eur J Cancer 2008;44: 353–65.
4. Vogel CL, Wojtukiewicz MZ, Carroll RR, et al. First and subsequent cycle use of pegfilgrastim prevents febrile neutropenia in patients with breast cancer: a multicenter, double-blind, placebo-controlled phase III study. J Clin Oncol2005;23:1178–84.
5. Timmer-Bonte JN, de Boo TM, Smith HJ, et al. Prevention of chemotherapyinduced febrile neutropenia by prophylactic antibiotics plus or minus granulocyte colony-stimulating factor in small cell lung cancer: a Dutch randomized phase III study. J Clin Oncol 2005;23:7974–84.
6. Yoshida M, Ohno R. Antimicrobial prophylaxis in febrile neutropenia. Clin Infect Dis 2004;39 (1):65–7.
7. Cullen M, Steven N, Billingham L, et al. Antibacterial prophylaxis after chemotherapy for solid tumours and lymphomas. N Engl J Med 2005;353:988–98.
8. Минимальные клинические рекомендации Европейского общества медицинской онкологии (ESMO). М., 2010. C. 375–91.
9. Klastersky J, Paesmans M, Rubenstein E B et al. The Multinational Association for Supportive Care in Cancer risk index: a multinational scoring system for identifying low-risk febrile neutropenic cancer patients. J Clin Oncol 2000; 18:3038–51.
10. Innes H, Lim SL, Hall A, et al. Management of febrile neutropenia in solid tumours and lymphomas
using the Multinational Association for Supportive Care in Cancer (MASCC) risk index: feasibility and safety in routine clinical practice. Supp Care Cancer 2008;16:485–491.
11. Vidal L, Paul M, Ben Dor I, et al. Oral versus intravenous antibiotic treatment for febrile neutropenia
in cancer patients: a systematic review and meta-analysis of randomized trials. J Antimicrob Chemother 2004;54:29–37.
12. Kovacs J, Masour H. Evolving health effects of Pneumocystis: one hundred years of progress of diagnosis and treatment. JAMA 2009;301:2578–85.
13. 13 Wolf H-H, Leithauser M, Maschmeyer G, et al. Central venous catheter-related infections in hematology and oncology. Guidelines of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Oncology (DGHO). Ann Hematol 2008;87:863–76.
14. Raad I, Kassar R, Dany G, et al. Management of the catheter in documented catheterrelated coagulase-negative staphylococcal bacteremia: remove or retain? Clin Infect Dis 2009;49:1187–194.
15. Kim SH, Kang CI, Kim HB, et al. Outcomes of hickman catheter salvage in febrile neutropenic cancer patients with Staphylococcus aureus bacteremia. Infect Control Hosp Epidemiol 2003;24:897–904.
16. Walsh TJ, Teppler H, Donowitz GR, et al. Caspofungin versus liposomal amphotericin B for empirical antifungal therapy in patients with persistent fever and neutropenia. N Engl J Med 2004;351:1391–402.
17. Herbrecht R, Denning DW, Patterson TF, et al. Voriconazole versus amphotericin B for primary therapy of invasive aspergillosis. N Engl J Med 2002;347:408–15.
18. Dockrell DH. Salvage therapy for invasive aspergillosis. J Antimicrob Chemother 2008;61:41–4.
19. Schmutzhard E, Williams KJ, Vukmirovits G, et al. A randomised comparison of meropenem with cefotaxime or ceftriaxone for the treatment of bacterial meningitis in adults. Meropenem Meningitis Study Group. J Antimicrob Chemother 1995;36:85–97.



 Читайте также:
Читайте также: