Молекулы водорода сходны с молекулами сахара чем
Молекулы кислорода сходны с молекулами сахара
Ответы 2
1)В кристаллических веществах атомы расположены в узлах кристаллической решетки. В аморфных веществах атомы расположены беспорядочно, так же как в жидкостях. Кристаллические вещества имеют строго определенную температуру плавления. Аморфные вещества не имеют строго определенной температуры плавления.
3)Кристаллическиминазывают вещества, в которых частицы располагаются в строгом порядке.
Примеры кристаллических веществ: алмаз, сахар, металлы, соли, щёлочи, большинство оксидов и простых веществ
Твёрдые вещества делят на аморфные и кристаллические.
Отличие аморфных и кристаллических веществ заключается в степени упорядоченности их внутреннего строения.
В кристаллических веществах все частицы располагаются в определённом порядке.
В аморфных веществах этот порядок относительный.
Твёрдые вещества делят на аморфные и кристаллические.
Отличие аморфных и кристаллических веществ заключается в степени упорядоченности их внутреннего строения.
В кристаллических веществах все частицы располагаются в определённом порядке.
dymontiger
Интересное в сети!
Курьезы, юмор, а иногда и жесть, все это вы найдете здесь;)
Все разнообразие нашего мира построено из атомов и молекул. Удивительно, как проявления форм жизни образовались лишь на основе протонов, нейтронов и электронов. Элементарная основа позволяет каждому веществу и организму выполнять свою функцию. Так из семи нот пишется музыка разных направлений, разных стилей. Мы собрали 10 самых интересных фактов об атомах и молекулах.
Самый легкий из атомов – атом водорода
В периодической таблице химических элементов водород стоит на первом месте. Его ядро состоит лишь из одного протона, вокруг которого вращается единственный электрон. Простейшее строение определяет минимальную массу, которую может иметь атом – 1,008 а.е.м. или 1,7х10-24 г.
На Земле водород существует в виде соединений с другими веществами или образует двухатомную молекулу Н2. Если считать в массовом отношении, на его долю приходится 1% земной коры. Если перевести массу в количество атомов, то содержание водорода окажется более внушительным – 17%. Этот показатель ставит элемент на второе место после кислорода (52%).
Во Вселенной водород составляет 88,6% от общей доли атомов, находящихся в космосе в виде звездного вещества и космической пыли.
Главной молекулой живой природы является молекула ДНК
В молекуле ДНК сосредоточена информация о строении каждой клетки живого организма, словно это проектное бюро города, где собраны подробные планы всех зданий. Внешне она напоминает перевитую веревочную лестницу, состоящую из двух нитей и соединенную водородными связями. ДНК вирусов может представлять одну цепочку.
Информация зашифрована в генах, то есть участках молекулы. Ген представляет собой определенную последовательность нуклеотидов, способных передать код для построения белков и РНК (информационных, транспортных, рибосомных, матричных).
Спираль ДНК человека, если ее вытянуть, протянется почти на 2 м. Это тем более удивительно, что она умещается в ядре размером меньше микрометра. Свернуться в компактную хромосому молекуле помогают нуклеосомы. На них ДНК наматывается, как на катушку.
Пыль – это частица, состоящая из квадриллиона атомов
Пылью называют твердые минеральные или органические частицы размером не более 0,05 мм. Природа образования может быть как естественной, так и связанной с деятельностью человека (антропогенной). В воздух поднимаются вулканический пепел, морская соль, сухая почва, продукты горения после пожаров, пыльца растений. Человек способствует загрязнению воздуха продуктами отопления и горных разработок, выхлопами автотранспорта, удобрениями. Вспашка земли и оголение почвы выкосами травы опасны выветриванием и переносом верхнего слоя грунта ветром.
Если сравнивать твердую взвесь с газообразными загрязнителями воздуха, то последние присутствуют в виде отдельных молекул. Пыль же в каждой частице содержит огромное число молекул и еще большее число атомов.
Атом может иметь электрический заряд
В составе атома электроны несут отрицательный заряд, протоны – положительный. Нейтроны не имеют заряда, то есть нейтральны. Когда количество протонов равно количеству электронов, заряд атома равен нулю. В случае, если электронов больше или меньше, чем протонов, у атома появляется заряд. Он становится ионом.
Ядро, состоящее из нейтронов и протонов, обладает ощутимой массой. Нужно определенное количество энергии, чтобы заставить его терять протоны. Электроны, которые вращаются вокруг него, значительно легче могут перемещаться от одного атома к другому. Добавление электронов приводит к образованию отрицательного заряда, потеря частиц – положительного. Атомы с положительным зарядом называют катионами, атомы с избытком электронов становятся анионами.
Самый тяжелый из атомов – атом урана
Из природных элементов атом урана имеет самую большую массу – 238,0289 а.е.м. В природе находится в основном в виде изотопа U-238. Атом с его 92 протонами чрезвычайно перегружен, при любой возможности выбрасывает протоны и нейтроны с огромной скоростью.
Открыл элемент германский химик Мартин Клапрот в 1789 году при анализе отработанной руды после добычи серебра. «Странное вещество», похожее на металл было диоксидом урана, но выяснилось это только через 50 лет. Клапрот назвал находку в честь далекой планеты, открытой к этому времени Гершелем.
В конце 19 века во Франции Анри Беккерель обнаружил радиоактивность урана, то есть способность терять частицы. Распад может иметь 14 циклов. Уран превращается в радий, радон и другие элементы, образуя на последней стадии свинец.
Слово «атом» происходит из древнегреческого языка и означает «неделимый»
Еще в Древней Греции философ и математик Демокрит предположил, что окружающее состоит из мельчайших частичек. Отсюда произошел термин «атом» или «atomos». Однако подтверждение теория получила только в результате работы ученых в последние 150 лет и с помощью изобретенного микроскопа.
Первое исследование провел англичанин Джон Дальтон на рубеже 18-19 веков. Он установил, что химические элементы вступают в реакции в строго определенном соотношении (закон кратных отношений).
Сейчас мы знаем, что атом представляет собой наименьшую частицу химического элемента и не всегда является неделимым. В состав атома входит ядро с протонами и нейтронами или просто нуклонами от латинского слова «nucleus» – ядро. Снаружи вокруг атома расположено электронное облако.
Стекло не является твердым телом
Твердость вещества – характеристика, основанная на прочности химических связей между атомами и молекулами. В жидкости частицы могут перемещаться относительно друг друга. В твердых телах они лишены такой возможности.
При производстве стекла молекулы кремния, обычно принимающие структуру кристаллической решетки, не успевают занят положенное им место. Стекло быстро остывает и частицы остаются перемешанными хаотично. Такое вещество называют аморфным, однако все же оно твердое.
Вязкость стекла сопоставима с вязкостью свинца, но ведь свинец никто не называет жидкостью. Бытует мнение, что со временем оконные стекла «стекают» вниз. В пример ставят витражи в средневековых храмах. Следует уточнить, что утолщения в их основании появились не с течением времени, а были изначально. Причина кроется в несовершенстве технологии производства.
Молекула меньше яблока во столько же раз, во сколько яблоко меньше Земли
Чтобы представить видимые и невидимые параметры окружающего мира, представим все молекулы одного кубического сантиметра воздуха в виде кирпичей. Их количества хватило бы для покрытия поверхности планеты на высоту 40-этажного дома.
Размеры молекул и атомов настолько малы, что в решении задач молекулярной физики используют относительные величины. Установить их удалось лишь с изобретением электронного микроскопа. Средний диаметр атома и простейшей молекулы составляет порядка 10-10 м. Так, размер молекулы белка – 43х10-10 м. Крупные молекулы достигают 10-7 м.
В ионный микроскоп можно разглядеть строение кристалла и даже определить межатомные расстояния.
Ученые смогли охладить молекулы монофторида стронция практически до абсолютного нуля
Выбор пал на монофторид стронция (SrF) неслучайно. Принцип охлаждения атомов основан на периодическом повторении поглощения и испускания фотонов под воздействием лазера. Таким образом атом теряет кинетическую энергию. Молекулы не настолько чувствительны. Мешает колебательная и вращательная энергия межатомных связей. У фторида стронция эти явления минимальны.
Группа ученых Йельского университета во главе с Д. Демиллем добилась охлаждения молекулы до 300 мкК (0,0003 К). За счет подобранной длины волны лазер погасил вращательные межатомные движения. В дальнейшем молекулы вели себя аналогично атому.
Практически такое достижение в перспективе можно использовать в квантовых компьютерах.
Скорость движения молекул воды может достигать 650 м/с
Молекулы воды находятся в постоянном тепловом движении. Они колеблются с большой частотой (одно колебание за 10-12 … 10-13 с) возле определенного положения, изредка прыгая на освободившееся соседнее место. Скорость движения при этом может приближаться к 600-650 м/с.
И все же молекулы не разлетаются, остаются жидкостью. Происходит это за счет водородных связей. В молекуле H2O пары электронов смещены в сторону кислорода. Водород, оставшийся практически без электрона, представляет собой положительно заряженное ядро. В результате протон водорода притягивает соседние атомы кислорода, образуя прочную межмолекулярную связь.
Благодаря такому сцеплению вода в условиях Земли принимает в основном жидкое состояние, а не кипит как аналогичные гидриды (серы, селена) при –80°С. Водородные связи определяют физические и химические свойства воды, на которых основана жизнь на нашей планете.
©
МОЛЕКУЛА
В комнату внесли букет черёмухи, а по всему дому распространился её чудесный ЗАПАХ.
На листьях черёмухи были водяные капли. Прошло немного времени, и они исчезли: вода испарилась.
В стакан чая бросили кусок сахару. Сахар растворился.
Есть ли что-нибудь общее между испарением воды, растворением сахара и запахом цветов?
В рассказе «АТОМ» говорится, что все на свете тела состоят из мельчайших частиц— атомов. Но если сказать точнее — не просто из атомов, а из групп атомов. Такие «компании» атомов называют молекулами. Ведь атомы в природе — всё равно что материалы в строительстве. Из немногих видов стройматериалов — кирпичей, досок, брёвен, балок — строят сотни различных домов. А из 92 сортов атомов природа и человек создали сотни тысяч разных веществ: в каждом веществе атомы соединяются в разные группы, образуют разные молекулы.
Когда кусок сахару растворяется, все его молекулы, до той поры соединённые вместе в твёрдый кусок, отделяются друг от друга и перемешиваются с молекулами воды. При испарении воды её молекулы смешиваются с молекулами КИСЛОРОДА и АЗОТА, из которых состоит воздух. И точно так же любое пахучее вещество (в том числе и нектар черёмуховых цветов) посылает свои молекулы в воздух. Эти молекулы движутся вместе с молекулами воздуха и попадают в наш нос, вызывая в нём ощущение запаха.
У каждого вещества свои молекулы. Некоторые из них очень просты. Например, молекула кислорода состоит из двух атомов кислорода, а молекула водорода — из двух атомов водорода. Это простые вещества.
Но если смешать водород и кислород и поджечь, как это делал ЛАВУАЗЬЕ, мы получим воду. При поджигании этой смеси молекулы водорода и кислорода сначала распадутся на атомы, а затем соединятся, образуя молекулы воды. Вода — это уже сложное вещество.
Существуют и очень сложные молекулы. У таких веществ, как БЕЛОК, каучук, древесина, у многих СИНТЕТИЧЕСКИХ МАТЕРИАЛОВ молекулы состоят из нескольких сотен и даже тысяч атомов.
Свойства веществ зависят в первую очередь от свойств их молекул. Если молекулы связаны друг с другом слабо, состоящее из них вещество будет газообразным, как например водяной пар. Молекулы в нём движутся быстро и свободно, только случайно сталкиваясь между собой. Если охлаждать водяной пар, молекулы воды будут двигаться медленнее, начнут соединяться одна с другой и пар превратится в жидкость. В жидкости молекулы связаны уже гораздо теснее, но всё-таки они могут ещё двигаться сравнительно свободно. Если же понизить температуру до 0° или ниже, вода замёрзнет и образуется твёрдое кристаллическое вещество — лёд, в котором молекулы воды могут только колебаться, почти не двигаясь с места.
Разнообразны и формы молекул. Молекулы воды похожи на шарики, а молекулы каучука — на длинные нити, так тесно переплетающиеся, что их почти невозможно отделить одну от другой. Потому-то, кстати, каучук так легко растягивается.
Много удивительных превращений может происходить с молекулами. Эти превращения называются ХИМИЧЕСКИМИ РЕАКЦИЯМИ. С их помощью можно получать новые вещества и материалы. Вот почему так важна химия, которую иногда называют наукой о превращениях молекул.
МОЛЕКУЛА
В комнату внесли букет черёмухи, а по всему дому распространился её чудесный ЗАПАХ.
На листьях черёмухи были водяные капли. Прошло немного времени, и они исчезли: вода испарилась.
В стакан чая бросили кусок сахару. Сахар растворился.
Есть ли что-нибудь общее между испарением воды, растворением сахара и запахом цветов?
В рассказе «АТОМ» говорится, что все на свете тела состоят из мельчайших частиц— атомов. Но если сказать точнее — не просто из атомов, а из групп атомов. Такие «компании» атомов называют молекулами. Ведь атомы в природе — всё равно что материалы в строительстве. Из немногих видов стройматериалов — кирпичей, досок, брёвен, балок — строят сотни различных домов. А из 92 сортов атомов природа и человек создали сотни тысяч разных веществ: в каждом веществе атомы соединяются в разные группы, образуют разные молекулы.
Когда кусок сахару растворяется, все его молекулы, до той поры соединённые вместе в твёрдый кусок, отделяются друг от друга и перемешиваются с молекулами воды. При испарении воды её молекулы смешиваются с молекулами КИСЛОРОДА и АЗОТА, из которых состоит воздух. И точно так же любое пахучее вещество (в том числе и нектар черёмуховых цветов) посылает свои молекулы в воздух. Эти молекулы движутся вместе с молекулами воздуха и попадают в наш нос, вызывая в нём ощущение запаха.
У каждого вещества свои молекулы. Некоторые из них очень просты. Например, молекула кислорода состоит из двух атомов кислорода, а молекула водорода — из двух атомов водорода. Это простые вещества.
Но если смешать водород и кислород и поджечь, как это делал ЛАВУАЗЬЕ, мы получим воду. При поджигании этой смеси молекулы водорода и кислорода сначала распадутся на атомы, а затем соединятся, образуя молекулы воды. Вода — это уже сложное вещество.
Существуют и очень сложные молекулы. У таких веществ, как БЕЛОК, каучук, древесина, у многих СИНТЕТИЧЕСКИХ МАТЕРИАЛОВ молекулы состоят из нескольких сотен и даже тысяч атомов.
Свойства веществ зависят в первую очередь от свойств их молекул. Если молекулы связаны друг с другом слабо, состоящее из них вещество будет газообразным, как например водяной пар. Молекулы в нём движутся быстро и свободно, только случайно сталкиваясь между собой. Если охлаждать водяной пар, молекулы воды будут двигаться медленнее, начнут соединяться одна с другой и пар превратится в жидкость. В жидкости молекулы связаны уже гораздо теснее, но всё-таки они могут ещё двигаться сравнительно свободно. Если же понизить температуру до 0° или ниже, вода замёрзнет и образуется твёрдое кристаллическое вещество — лёд, в котором молекулы воды могут только колебаться, почти не двигаясь с места.
Разнообразны и формы молекул. Молекулы воды похожи на шарики, а молекулы каучука — на длинные нити, так тесно переплетающиеся, что их почти невозможно отделить одну от другой. Потому-то, кстати, каучук так легко растягивается.
Много удивительных превращений может происходить с молекулами. Эти превращения называются ХИМИЧЕСКИМИ РЕАКЦИЯМИ. С их помощью можно получать новые вещества и материалы. Вот почему так важна химия, которую иногда называют наукой о превращениях молекул.
Вода | Строение молекулы и структура воды в жидком, твердом и газообразном виде.
Содержание:
1. Современные представления о составе и структуре воды. Строение молекулы воды. Легкая и тяжелая вода.
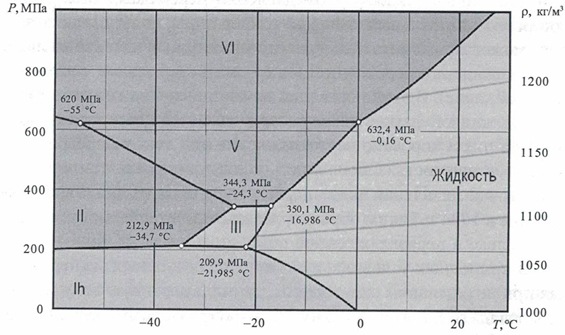
В «тройной» точке на диаграмме может одновременно существовать вода во всех трех агрегатных состояниях.
В «критической» точке все свойства жидкости и пара (энергия, плотность, структура, характер движения частиц и т.п.) становятся равны. При более высоком давлении и/или температуре агрегатное состояние воды называют «сверхкритическим».
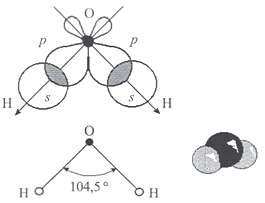
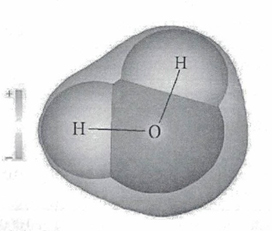
В стабильном энергетическом состоянии молекула воды имеет тетраэдрическую пространственную структуру. При изменении агрегатного состояния воды длина сторон и угол между ними меняются. Если бы мы увидели молекулу воды, то обнаружили, что она имеет сфероидальную форму с двумя выпуклостями (рисунок 3).
Наличие неподеленных пар электронов у кислорода и смещение обобществленных электронных пар обуславливает возникновение водородных связей, что способствует ассоциации молекул воды в группы.
Обладая значительным дипольным моментом, молекулы воды также сильно взаимодействуют с полярными молекулами других веществ.
Идеально чистую воду практически невозможно получить. По факту, мы всегда будем иметь дело хоть и с очень разбавленными, но растворами.
В природе на 1 000 000 молекул воды в среднем приходится:
— 997 284 молекул легкой воды 1 H2 16 O;
— 311 молекул 1 HD 16 O;
— 390 молекул 1 H2 17 O;
— 2005 молекул 1 H2 18 O.
Если из глубинной океанической воды, отвечающей стандарту SMOW (Standard Mean Ocean Water) удалить все тяжелые изотопы и заменить их на 1 H2 16 O, то масса 1 л такой воды станет меньше на 250 мг, т.е. на четверть.
2. Структура воды. Водородные связи.
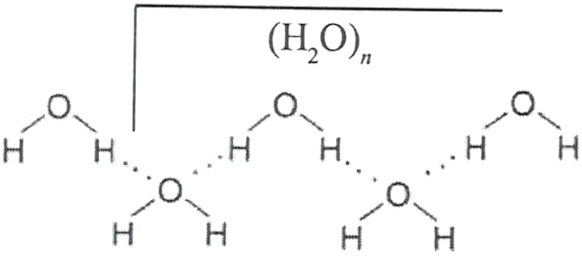
В ходе современных физико-химических исследований были выявлены характерные структурные агрегаты воды, формирующиеся с помощью водородных связей.
Для формирования трехмерных структур необходимо, кроме способности молекул создавать водородные связи, выполнение еще двух условий. Этих связей должно быть не менее четырех на одну молекулу и геометрические размеры молекулы не должны противоречить оптимальным направлениям водородных связей. Вода удовлетворяет этим требованиям. Так, нагревая лед мы получаем смесь жидкой воды и кристаллов льда, температура которой останется неизменной до тех пор, пока все кристаллики не расплавятся. Это говорит о том, что подводимое нами тепло будет расходоваться в первую очередь на разрушение водородных связей льда.
3. Структура воды в жидком виде.
Жидкость, как известно, отличается от других агрегатных состояний вещества своей текучестью, т.е. способностью неограниченно менять форму под действием касательных механических напряжений, сохраняя при этом объем. Жидкость способна течь даже под свей неподвижной поверхностью. Молекулы жидкости не имеют своего строго определенного места, но, все же, им недоступна полная свобода перемещения, как в паре.
Структура жидкости есть статистическая закономерность межмолекулярных расстояний и ориентаций, характерных для плотно упакованных систем.
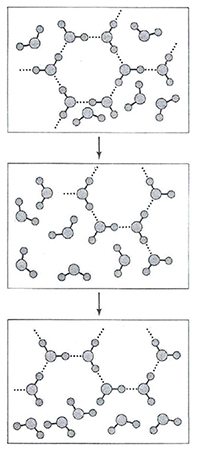
Согласно одной из первых моделей воды Бернала и Фаулера, основанной на рентгеноструктурном анализе, существует три формы расположения молекул в жидкой воде:
В 1951 г. Дж. Попл предложил модель воды в виде непрерывной сетки (рисунок 5), отличной от модели Бернала и Фаулера. Отличия заключались в том, что сетка была случайной, связи в ней искривлены и имеют различную длину.
Попл объяснял уплотнение воды при плавлении искривлением связей. Однако, данная модель не могла объяснить нелинейность зависимости свойств воды от температуры и давления.
Почти одновременно с идеей Попла возникли кластерные и клатратные модели, которые можно обозначить как «смешанные».
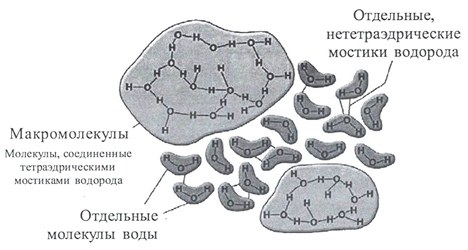
Кластерная модель представляла жидкую воду как кластеры из молекул, связанных водородными связями, плавающих в объеме свободных молекул. В группе кластерных моделей выделяется теория Г.Немети и Х.Шераги (рисунок 6). Отметим, что в данной модели разрушение одной водородной связи приводит к разрушению всего кластера. Разрушение и образование кластеров происходит постоянно.
Кластерная модель не говорит о расположении молекул в гроздьях, но авторы предполагают наличие отдельных «роев». При этом постулируется тот факт, что большинство молекул должно быть тетракоординировано. Состояние молекул будет определяться количеством водородных связей, которые она образует (0-5).
Удар по кластерной теории наносят исследования Г.Стэнли на основе теории перколяции (протекания). Г.Стэнли доказывает невозможность существования в воде изолированных кластеров.
Клатратная модель говорила о воде как о непрерывной сетке-каркасе связанных молекул, внутри которого содержались пустоты со свободными молекулами.
Первую модель клатратного типа предложил О.Я.Самойлов в 1946 году. В ее основе лежало представление о жидкой воде как о испорченной, размытой структуре льда Ih с частичным заполнением полостей мономерами. В процессе движения молекул решетка постоянно перестраивается. Настройкой свойств и концентраций микрофаз, а также параметрами пустот легко можно было объяснить все закономерности свойств воды.
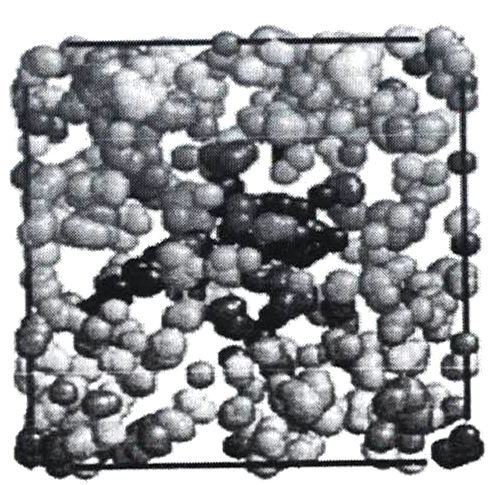
Пустоты в воде по результатам моделирования имеют тенденцию объединяться друг с другом, образуя еще более крупные пустоты, как показано на рисунке 7.
Рассмотрим кластерную и клатратную модели строения жидкой воды подробнее.
3.1 Кластерная модель строения жидкой воды.
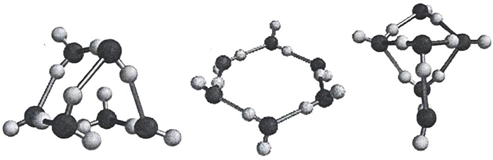
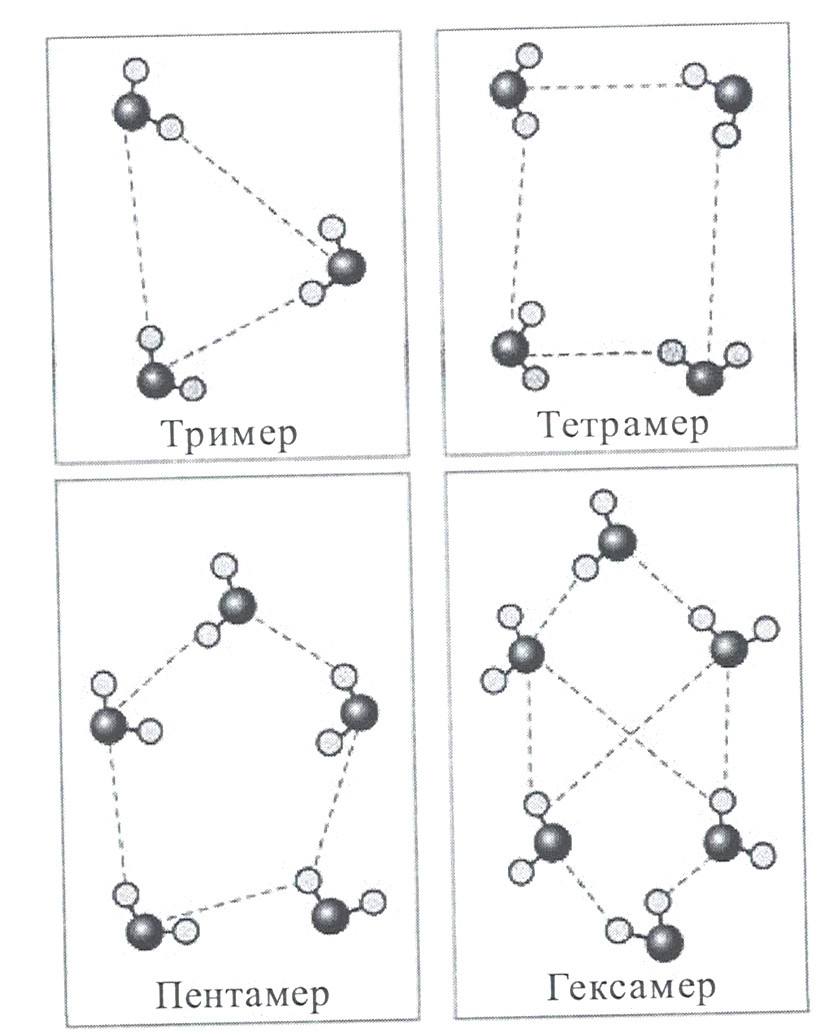
Согласно квантово-химическим расчетам большей устойчивостью обладают линейного «открытого» димера воды, по сравнению с циклическими формами. В случае цикла выгодными являются трех-четырех- и пятичленные образования, в которых водородные связи имеют одинаковое направление. Для шестичленного цикла выгодным становится структура типа «кресло».
Одно из первых изображений формирования циклических кластеров воды приведено на рисунке 9.
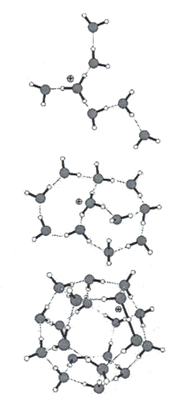
Большой вклад в возможность формирования и устойчивость кластеров воды во времени внесли работы Г.А.Домрачева и Д.А. Селивановского. Они доказывали существование механохимических реакций радикальной диссоциации воды. Доказательство основывалось на том, что вода, по их мнению, представляет собой динамически нестабильную полимероподобную систему и по аналогии с механохимическими реакциями в полимерах при механическом воздействии на воду поглощенная водой энергия используется для разрыва химических связей H-OH. Реакция разрыва связи может выглядеть так:
Рассчитав эффективность механодиссоциации воды, авторы пришли к выводу, что кислород на Земле появился при диссоциации воды.
В 1993 г. К.Джордан предложил свои варианты устойчивых «ассоциатов воды», которые состоят из 6 молекул (рисунок 10).
По Джордану кластеры могут объединяться и друг с другом, и со свободными молекулами воды за счет водородных связей, формируя более крупные ассоциаты. Такие кластеры могут объединяться как друг с другом, так и со свободными молекулами воды.
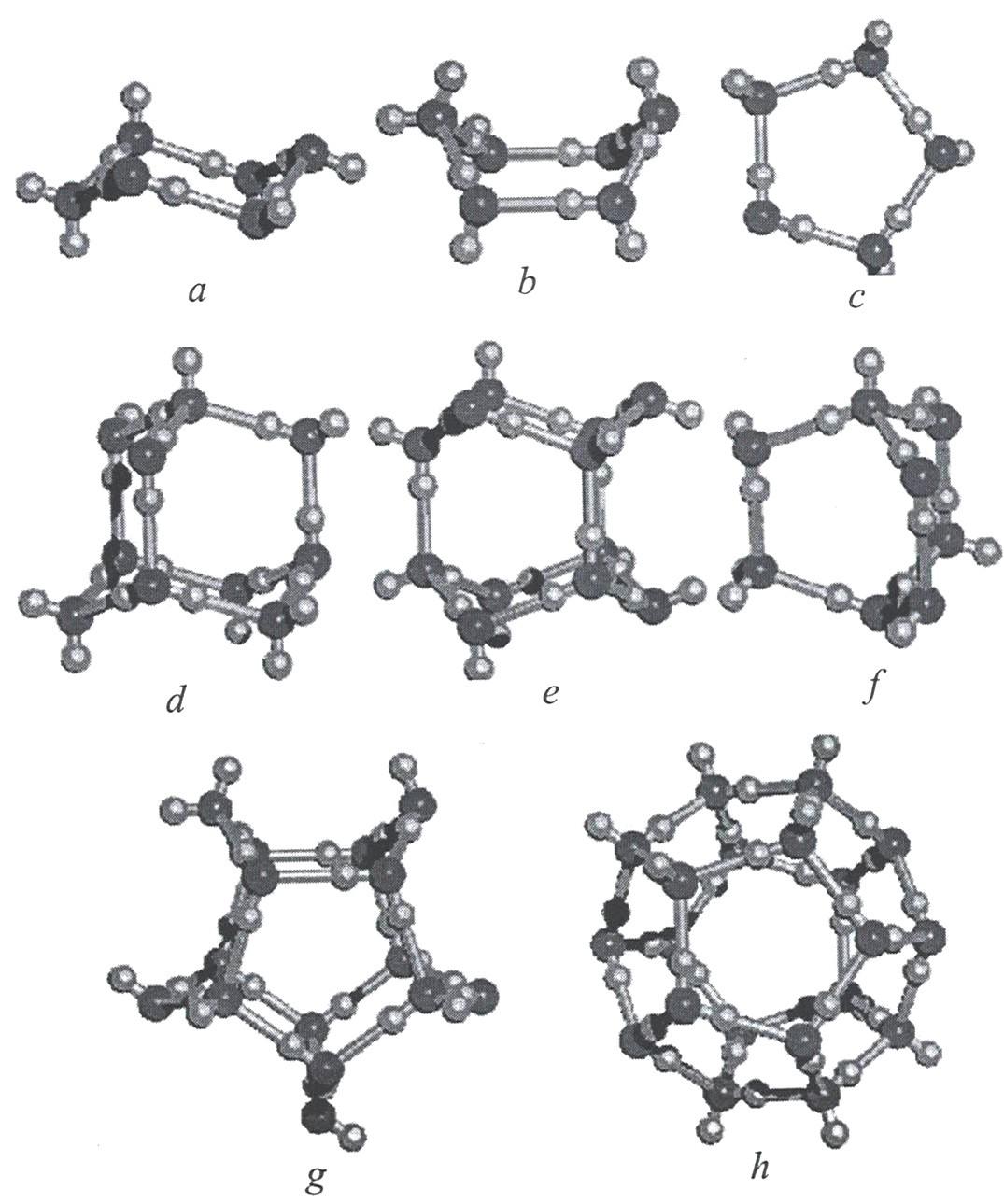
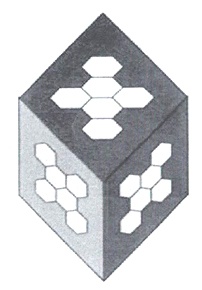
Квантово-химические расчеты нанокластеров с общей формулой (H2O)n с n=6-20 показали, что самые устойчивые структуры образуются посредством взаимодействия тетрамерных и пентамерных кольцевых структур (рисунок 11). На рисунке ниже показаны возможные структуры конформации кластеров воды.
Оригинальной кластерной моделью является теория С.В.Зенина. Согласно модели С.В.Зенина вода представляет собой иерархию геометрически правильных объемных структур «ассоциато». Согласно его теории элементарной структурной ячейкой воды являются тетраэдры, в которых может содержаться 4 (простой тетраэдр) или 5 (объемно-центрированный тетраэдр) молекул воды. При этом у каждой молекулы воды в простых тетраэдрах сохраняется способность образовывать водородные связи, благодаря чему создаются более сложные структуры, как показано на рисунке 13.
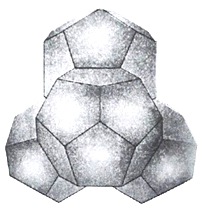
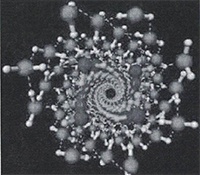
Кластеры, содержащие 20 молекул воды (додэкаэдры) более стабильны. Схема их образования показана на рисунке 14.
Из 57 молекул такого образования 17 составляют гидрофобный каркас с полностью насыщенными связями, а по 10 молекул на поверхности каждого додекаэдра формируют центры образования водородных связей.
Методами жидкостной хроматографии было подтверждено существование пяти- и шестиквантовых структур типа «четырехконечной звезды» и «шестилучевой снежинки».
На уровне 24 центров связывание по водородным связям практически прекращается ввиду того, что поверхность образований становится насыщенной (нейтральной).
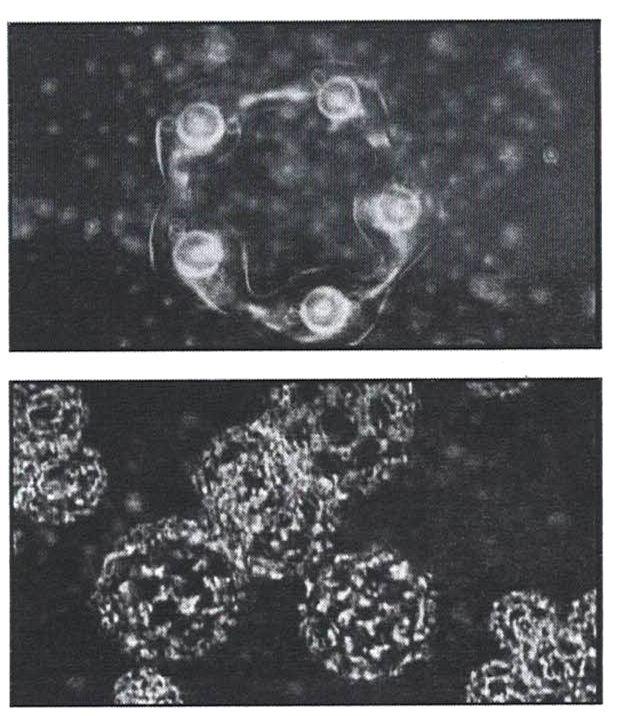
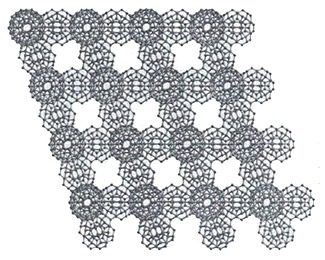
Кластеры почти не взаимодействуют между собой, а скользят друг по другу, поэтому вода не отличается высокой вязкостью. В таком «режиме» из кластеров формируются метастабильные структуры, пример которых показан на рисунке 17 (микроизображение в режиме фазового контраста).
Теория Зенина хорошо объясняет электропроводные свойства воды, уменьшение плотности при плавлении, но плохо согласуется с большими значениями коэффициента самодиффузии и малым временем диэлектрической релаксации.
Однако практически существование регулярных матриц в воде маловероятно. Кластеры из 280 молекул также могут формировать цепочки, но с более напряженными водородными связями.
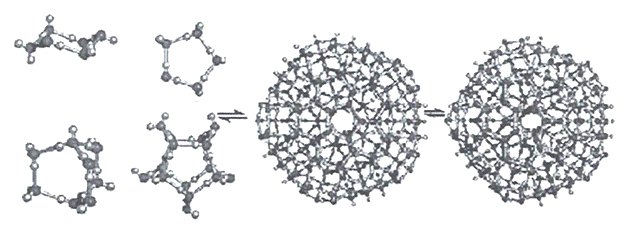
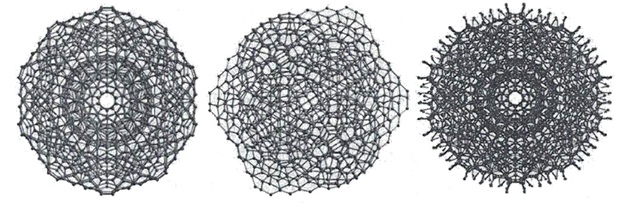
Кластеры могут разрастаться в суперкластеры (гигантские икосаэдры), примеры которых приведены на рисунке 19.
В 2002 Беркли методом рентгеноструктурного анализа показала, что молекулы воды действительно способны образовывать структуры, представляющие собой топологические цепочки и кольца из множества молекул.
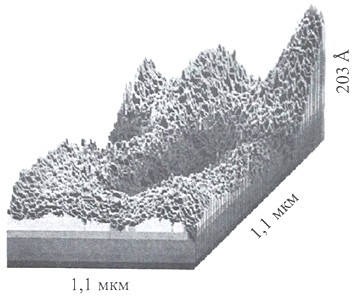
А.Н.Смирновым в бидистиллированной воде и некоторых растворах методами акустической эмиссии, лазерной интерферометрии и термического анализа удалось визуализировать надмолекулярные образования с размерами частиц от 1 до 100 мкм, распределенных в водной среде (рисунок 20). Свойства таких частиц были сходны со свойствами частиц, образующих эмульсию, поэтому они были названы «эмулонами».
Размеры и пространственная организация эмулонов зависят от состава водного раствора, температуры и предыстории раствора. Наибольшее число фракций имеют размеры 30, 70 и 100 мкм.
Температурная динамика структуры эмулонов имеет следующие отсечки:
3.2 Клатратная модель строения жидкой воды.
Клатраты в целом (не только вода) делятся на два класса, зависящие от соединения-хозяина. Молекулярные клатраты образуются «хозяевами», имеющими внутримолекуярные полости. Такие клатраты могут существовать как в растворе, так и в кристаллическом состоянии. Если «хозяин» способен образовывать только межмолекулярные или кристаллические полости, то из него получаются решетчатые клатраты (рисунок 21), устойчивые лишь в твердом состоянии.
В поздних модификациях клатратной модели воды допускается образование водородных связей между молекулами в каркасе и молекулами в пустотах. При этом сами молекулы в обеих микрофазах соединены водородными связями.
В заключение отметим, что существует целый ряд воздействий, которые могут приводить к определенному структурированию воды:
Более подробно структурирование воды под воздействием внешних сил будет рассмотрено в отдельной статье.
4. Особенности строения воды в твердом виде. Лед.
• Всего насчитывается около 15 структурных модификаций льда (рисунок 22).
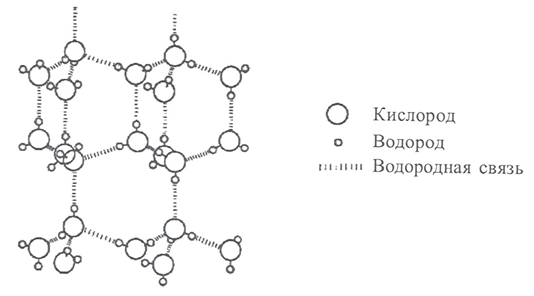
1922 г. У.Г.Брэгг в статье «Кристаллическая структура льда» пытается выяснить причины возможных ошибок при расшифровке положений ядер кислорода. Он убежден, что ни Джон, ни Деннисон не смогли найти истинного расположения ядер кислорода в структуре льда. Брэгг сделал важное замечание: каждый атом кислорода в структуре льда должен быть окружен четырьмя другими. Атом же водорода располагается между двумя кислородами как бусинки на нитке. При этом, что важно, бусинки сдвинуты, смещены, относительно центра льда. Т.е. ядра водорода расположены асимметрично.
Кристаллическая решетка льда называется ажурной (рисунок 23). Паутина связей между молекулами воды во льду содержит много крупных пустот, больших по размеру, чем сами молекулы. Именно поэтому лед более легкий, чем жидкая вода. При плавлении льда водородные связи начинают разрушаться и в пустотах оставшихся ассоциатов поместиться освободившиеся молекулы воды.
• При давлении в 2 ГПа можно получить лед со структурой VI (горячий лед), который не будет плавиться даже при 80 о С.
• При очень высоких давлениях внутри нанотрубок с диаметром от 1,35 до 1,90 нм вода может кристаллизоваться в форме двойных спиралей (рисунок 24).
• Современные представления о структуре льда говорят о наличии кластерного строения. Чем ниже температура, тем крупнее кластеры. Наиболее устойчивы кластеры из 8, 12, 24, 36 молекул.
5. Особенности строения воды в газообразном виде. Пар.
В паре водородные связи на 99% разорваны. При этом в нем сохраняется до 1% димеров. Полностью разорвать все связи в паре можно лишь при температура 600 о С.
Расстояние между молекулами во много раз больше самих молекул. При этом сами молекулы хаотично двигаются, сталкиваются со стенками сосуда, в котором заключены, и между собой. Скорость их тем выше, чем выше температура системы.
Вода может длительное время находиться и в перегретом состоянии до 200 о С. При введении пузырька воздуха в такую перегретую воду она мгновенно вскипает и ее температура падает до 100 о С.