Морфологическая картина что это значит
Морфологическая диагностика
Морфологическая диагностика — это тип исследования, применяемый для подтверждения наличия злокачественного новообразования, выявления его этиологии и составления наиболее подходящей тактики лечения.
Акции
Запись на консультацию со скидкой 10%.
Онкоконсилиум может потребоваться как при лечении в «СМ-Клиника», так и пациентам других медицинских учреждений с целью получения альтернативного мнения.
«СМ-Клиника» предоставляет своим пациентам предоперационное обследование со скидкой до 72%!
Консультация врача-хирурга по поводу операции бесплатно!
Морфологические исследования позволяют диагностировать все виды злокачественных и доброкачественных опухолей различной локализации.
Морфологическая диагностика в онкологии
Морфологический анализ – изучение тканей новообразований на клеточном уровне. С его помощью подтверждают либо опровергают онкодиагноз, дифференцируют доброкачественные и злокачественные опухоли, определяют их характеристики. Никакие другие методы диагностики – УЗИ, МРТ, онкомаркеры – не дают точных и окончательных данных. Пока нет результатов морфологического анализа, рак только предполагается.
Заключение врача-патоморфолога – основа выбора лечебной стратегии и тактики. Для каждого морфологического типа опухоли разработаны протоколы лечения с доказанной эффективностью. Врач-онколог использует результаты морфологического анализа и протоколы при разработке индивидуальной терапевтической схемы.
Забор биоматериала: пункция и биопсия
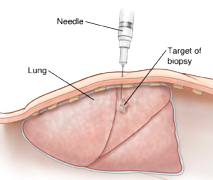
Ткани для анализа получают во время пункции с помощью шприца, методом биопсии либо после их хирургической резекции. В ходе пункции можно взять образцы слюны, мочи, мокроты, жидкости из плевральной и брюшной полостей, смывы и мазки из дыхательных и половых путей, отпечатки/соскобы эрозий и язв.
Биопсия представляет собой иссечение участка опухолевой ткани – биоптата. Выполняетсямикрохирургическимиинструментами под визуальнымконтролем УЗ, КТ или другого аппарата.
Биопсия бывает наружной и внутренней (эндоскопической – через зонд, оснащенный микровидеокамерой). В ряде случаев – когда она может спровоцировать распространение опухолевых клеток по организму – новообразование сначала радикально иссекают, а потом отправляют на морфологический анализ для определения дальнейшей лечебной тактики.
Виды морфологических исследований в онкологии
Морфологическая диагностика представляет собой изучение тканей опухоли под микроскопом.
Цитологическое исследование
Оценка структурных характеристик клеток образца. Позволяет отличать злокачественные и доброкачественные опухоли, а также не опухолевые образования.
Основано на сравнении микроскопических особенностей строения клеток в норме и при патпроцессах. В отличие от гистологического анализа изучаются не срезы тканей, а клетки.
Гистологическое исследование
Позволяет определить вид опухоли и установить ее инвазивность. Для этого образцы проходят предварительную обработку. Обезвоженные ткани равномерно пропитывают парафином. Полученные блоки нарезают тончайшими пластинами, размещают их на предметных стеклах,высушивают и окрашивают. Подготовленный таким образом материал изучают под микроскопом.
По результатам анализа делают вывод о степени атипичности опухоли (предрак или рак) и ее агрессивности с точки зрения ангиогенеза (количества кровеносных сосудов). Исследование позволяет судить об инвазивности – взаимодействии опухоли с близлежащими тканями.
Иммуногистохимическое исследование
В ряде клинических случаев для определения эффективной лечебной тактики необходимо знать специфические белки опухоли. Их определяют с помощью иммуногистохимического анализа на основе специфической реакции антиген-антитело.
Исследование позволяет определять,какая ткань стала источникомзлокачественногоперерождения клеток, по метастазам выявлять первичный опухолевый очаг, прогнозировать варианты развития опухоли и ее резистентность к разным видам терапии.
Особенности морфологической диагностики в «СМ-Клиника»
Забор биоматериала для морфологического исследования производится с помощью биопсии. После забора тканей, они направляются в лабораторию, где происходит их изучение под микроскопом. Если такое изучение тканей недостаточно информативно, то проводятся дополнительные исследования.
Взятие образцов тканей проводится опытными специалистами в стерильных условиях как в условиях процедурного кабинета, так и стационара. В ходе процедуры пациенту вводится местная анестезия, поэтому процедура проходит в максимально комфортных условиях. Способ забора материала зависит от локализации новообразования.
Лаборатория медицинского центра «СМ-Клиника» располагает специальным оборудованием для обработки и хранения материала, чтобы его можно было использовать повторно для уточнения диагноза. Изучение образца производится на мощных световых и электронных микроскопах, что позволяет добиться высокой эффективности исследования.
Показания к морфологической диагностике
Данный вид исследования назначается при:
Интерпретация результатов
В результатах морфологического исследования указывают:
Морфологическое исследование опухоли делают 10 дней. В нашем центре в Санкт-Петербурге результат проходит двойную верификацию – подтверждение двумя врачами-патоморфологами. Это позволяет свести к нулю вероятность ошибочного результата. Предметные стекла и блоки сохраняем – вы можете запросить их для анализа в сторонней лаборатории.
Записаться на прием онколога в «СМ‑Клиника» вы можете круглосуточно, позвонив по телефону в Санкт-Петербурге +7 (812) 435 55 55 или заполнив форму обратной связи
Морфологические методы исследования
Морфологические методы исследования
Для чего необходимо морфологическое исследование опухолевой ткани?
Практически во всех случаях точный диагноз онкологического заболевания может быть установлен только на основании результатов исследования образца опухолевой ткани, полученной у пациента. Наиболее часто с этой целью используются следующие методы получения биологического материала:
В большинстве случаев забор опухолевой ткани осуществляется с использованием того или иного метода обезболивания (анестезии).
Пункция
Во время пункции возможно получить небольшое количестве клеток для цитологического исследования. Во время выполнения этого вмешательства врач вводит в опухоль тонкую иглу и при помощи шприца забирает небольшое количество материала. После этого полученная ткань (жидкость и содержащиеся в ней клетки) помещается на специальное предметное стекло. Данный метод исследования называется цитологическое исследование (цитология), он дает возможность получить информацию об отдельных клетках, из которых состоит исследованная ткань. Пункция является наименее травматичным методом получения материала для исследования, однако его информативности в некоторых случаях может быть недостаточно. К примеру, отрицательные результаты пункции не всегда означают отсутствие опухолевого роста.
Для цитологического исследования также может быть использована слюна, мокрота, моча, жидкость, скопившаяся в брюшной или плевральной полости (асцит или плеврит), а также мазки или смывы из половых путей, дыхательных путей и т.д. Также используют отпечатки с патологических образований (язв, эрозий). В последнем случае предметное стекло прикладывается к интересующей зоне, после чего изготавливается материал, аналогичным образом может быть взят мазок-отпечаток при котором с патологического образования соскребается материал при помощи шпателя, скальпеля или других инструментов.
Биопсия
В отличие от пункции при проведении биопсии удается получить значительно большее количество опухолевой ткани, данный вид забора материала применяется для получения материала для гистологического исследования материала. В ходе его выполнения можно получить точную информацию о строении опухолевой ткани. В отличие от вышеописанного цитологического исследования результаты данного вида исследования отличаются большей точностью, кроме того, больший объем материала позволяет точнее установить диагноз (например, выявить точный подвид опухолевых клеток), и, в случае наличия необходимости, провести дополнительные иммуногистохимические методы обследования (подробнее описано ниже).
Несмотря на указанные преимущества, выполнение биопсии является более травматичной процедурой для организма, чем выполнение пункции. В некоторых случаях проведение данного исследования может быть невозможно вследствие наличия высокого риска травматического повреждения близко расположенных к опухоли сосудов, например, при опухолях расположенных в области поджелудочной железы, в связи с чем пункция может быть единственным доступным методом получения материала для исследования.
Виды биопсии
Биопсия может осуществляться как под контролем зрения врача («на ощупь») так и под контролем специального оборудования, например ультразвукового аппарата или компьютерной томографии. В наиболее сложных случаях, например, при биопсии новообразований, расположенных в головном мозге, используются специальные методы фиксации пациента, препятствующие смещению опухоли при заборе материала (стереотаксическая биопсия). Существуют следующие основные виды биопсии:
В зависимости от расположения опухоли биопсия может быть выполнена как снаружи через кожу, так и изнутри организма. С этой целью в организм могут вводиться эндоскоп, который представляет собой тонкую гибкую трубку, оснащенную видеокамерой и различными манипуляторами. При помощи эндоскопических методов может быть осуществлена биопсия новообразований, расположенных в просвете желудочно-кишечного тракта (гастроскопия и колоноскопия), например, полипов толстой кишки, бронхов (бронхоскопия), мочевыводящих путей (цистоскопия), грудной клетки (торакоскопия) и брюшной полости (лапароскопия).
Выполнение гистологического исследования
Гистологическому исследованию в обязательном порядке подвергается любой удаленный материал, в том числе – после хирургического удаления опухоли в ходе оперативного этапа лечения. Изучение послеоперационного материала позволяет уточнить диагноз, распространенность процесса и его стадию, оценить наличие вовлечения в болезнь лимфатических узлов и т.д.
После получения материала для исследования любым из вышеуказанных способов он отправляется на исследование к специалисту по морфологическому изучению опухолей – патологоанатому (или патоморфологу), который обрабатывает полученную ткань необходимым образом и проводит её исследование. Так как ткань опухоли подвержена естественным процессам разрушения, необработанный материал может стать непригодным для дальнейших исследований. В первую очередь с целью обеспечения сохранности ткани проводится её обработка специальным фиксирующим раствором, например формалином.
После этого ткань запечатывается в парафин (воскоподобный материал) в результате чего образец опухолевой ткани становится пригодным для исследования и хранения в течение длительного времени. Таким образом создаются так называемые «опухолевые блоки». Опухолевый блок – кусочек опухолевой ткани, запечатанный в парафин. Как правило, изготавливается множество блоков, содержащих разные участки опухолевой ткани.
После этого с части или со всех или с части изготовленных блоков делаются тонкие срезы, пригодные для исследования под световым микроскопом («опухолевые стекла»). Эти стекла врач-патоморфолог изучает под микроскопом, в некоторых случаях – после специальной окраски, которая позволяет лучше оценить те или иные детали строения опухоли. В ходе изучения опухолевой ткани врач старается установить наличие или отсутствие признаков злокачественности опухоли, степень её злокачественности, вид клеток, из которых она возникла и т.д.
Иногда, в тех случаях, когда необходимо получение максимально быстрого ответа вместо запечатывания опухолевой ткани в парафин, применяется её быстрая заморозка с последующей «нарезкой» и изучением под микроскопом. Этот процесс занимает около 15-20 минут. Данный метод применяется при необходимости интраоперационного исследования материала, когда непосредственно в процессе выполнения оперативного вмешательства хирургу необходимо получить гистологическую информацию, например, о наличии или отсутствии опухолевых клеток по краю резекции (отреза) для того, чтобы убедиться в радикальности выполненного вмешательства.
Результаты морфологического исследования
По результатам исследования врач-патоморфолог составляет цитологическое или гистологическое заключение, в котором отражаются результаты изучения образца опухолевой ткани под микроскопом, а также результаты гистохимических и молекулярных исследований, если они проводились. Как правило, гистологическое заключение может содержать следующую информацию:
Как правило, проведение гистологического исследования занимает до 10 дней. Обязательно сохраните у себя копию гистологического заключения, а также убедитесь в сохранности стекол и блоков
Дополнительные методы исследования
В ряде случаев для установления точного диагноза может понадобиться определение подвида опухоли, а также наличия в ней экспрессии (выработки) определенных белков, которые могут быть использованы в качестве «мишеней» для противоопухолевой терапии.
С этой целью врач-патоморфолог может дополнительно провести иммуногистохимическое исследование (ИГХ). Суть ИГХ исследования заключается в обработке опухолевой ткани специальными антителами, которые связываются со своими белками-мишенями на поверхности опухолевых клеток. После выполнения определенных процедур это приводит к тому, что эти белки становятся видны при микроскопическом исследовании опухоли, если они ей продуцируются.
Врач-патоморфолог может оценить «набор» белков, которые вырабатываются опухолью, а также степень экспрессии того или иного белка. ИГХ является незаменимым методом в следующих случаях:
ИГХ очень широко применяется при обследовании больных раком молочной железы. Всем пациенткам с этим диагноз проводится определение наличия в опухоли экспрессии рецепторов гормонов, эстрогена и прогестерона, а также скорости деления клеток (индекс Ki-67) и выраженности экспрессии белка HER2-neu. Это необходимо для того, чтобы понять, какие именно механизмы запускают процессы деления опухолевых клеток. Избирательно подавляя эти механизмы можно блокировать процессы роста и деления опухолевых клеток. Например, если установлено, что процессы роста опухолевых клеток стимулируют эстрогены и/или прогестерон, лишив злокачественные клетки «доступа» к ним можно добиться выраженного противоопухолевого эффекта.
Наличие в опухоли повышенной экспрессии белка HER2-neu ассоциировано с высокой её агрессивностью и быстрым ростом. Это требует применения специальных препаратов, избирательно воздействующих на этот сигнальный путь. Наиболее часто с этой целью применяется трастузумаб – моноклональное антитело, связывающее HER2-neu.
В отдельных случаях применяются дополнительные молекулярные методы изучения опухоли. В этом случае проводится дополнительное изучение генома злокачественных клеток. При некоторых заболеваниях это может дать ценную информацию для лечения. К молекулярным методам исследования относится флюоресцентная гибридизация in situ (FISH) и полимеразная цепная реакция (ПЦР). Эти методы исследования являются наиболее точными, но их проведение может потребовать дополнительного времени, кроме того они являются достаточно дорогостоящими.
Получение второго мнения
В некоторых случаях, особенно при лечении редкого заболевания, полезным может оказаться получение второго мнения (консультации другого специалиста) по результатам гистологического исследования. Для этого вам понадобиться получить изготовленные стекла и опухолевые блоки и предоставить их на консультацию в выбранное вами учреждение. Дополнительно следует предоставить актуальную выписку из вашей истории болезни и результаты предыдущих гистологических исследований, так как это может дать врачу ценную информацию.
Обратите внимание: проведение дополнительных исследований с целью получения второго мнения может быть платным.
Внимание! Информация в данном разделе не является заменой квалифицированного мнения врача, представлена исключительно в образовательных целях и не является руководством к действию.
Морфологическая картина что это значит
В последние 30 лет появление молекулярных методов исследования реаранжировки генов иммуноглобулинов и генов Т-клеточных рецепторов, создание поли- и моноклональных антител и иммуно-гистохимической техники сыграли решающую роль в изучении биологических основ и диагностике лимфом. В свою очередь детальная биологическая характеристика заболевания служит основой для создания новых морфологических классификаций, что позволяет на более высоком уровне, с применением иммунологических и молекулярных методов исследования осуществлять диагностику и дифференциальную диагностику лимфом, сходных на светооптическом уровне. В настоящее время «золотым стандартом» диагностики лимфомы стало морфологическое исследование биопсийного материала с последующим иммунофенотированием в целях верификации варианта лимфомы и выявления возможных прогностических маркеров. Иммунофенотипирование можно проводить на свежезамороженных срезах (чаще — с помощью метода непрямой флюоресценции) и на срезах с парафинового блока с помощью иммуногистохимического (иммуноферментного) метода. Возможность использования парафинового материала для верификации диагноза и варианта лимфомы обусловила широкое применение иммуногистохимического метода. Для иммуногистохимического метода в гемопатологии применяются поли-(кроличьи) и моноклональные (мышиные) антитела, входящие в номенклатуру CD (кластеров лейкоцитарной дифференцировки), антитела к активаци-онным антигенам, онкобелкам, различным классам иммуноглобулинов, легким цепям, многие другие антитела. Применение мабтеры — анти-CD20-мо-ноклонального препарата, вызывающего апоптоз CD20-положительных опухолевых клеток, подразумевает обязательную верификацию варианта неходжкинской лимфомы. Так, например, опухолевые клетки при плазмобластной лимфоме — варианте диффузной В-крупноклеточной лимфомы — не экспрессируют CD20, следовательно, мабтера, нацеленная на CD20-позитивные опухолевые клетки, будет неэффективной и не должна применяться при данном варианте лимфомы.
В-клеточные лимфомы
В-клеточные лимфомы составляют до 85% не-ходжкинских лимфом и происходят из В-клетки на различных стадиях дифференцировки.
Маркерами фолликулярной дифференцировки являются CD 10 и транскрипционный фактор BCL-6, что отличает В-клетку фолликула от зрелой наивной В-клетки. Таким образом, CD10 (CALLA — общий антиген острого лимфобластного лейкоза, другое название — неприлизин) экс-прессируется костномозговыми клетками-предшественницами на стадиях про-В-, пре-В-клетки, незрелой В-клетки костного мозга, не выявляется на стадии зрелой наивной В-клетки и вновь экспрессируется В-клетками на уровне фолликулярной дифференцировки. BCL-6 — антиапоптотический белок, являющийся ключевым регулятором формирования и функции зародышевого центра. BCL-6 ингибирует дифференцировку В-клеток зародышевого центра фолликула в плазматические клетки путем связывания с трансдуцерами и активаторами, предотвращающими экспрессию главного регулятора плазмокле-точной дифференцировки Blimp-1. Блокировка экспрессии BCL-6 в условиях нормы необходима для дальнейшей дифференцировки В-клеток. У человека в условиях физиологической нормы высокий уровень белка BCL-6 обнаруживается только в В-клет-ках зародышевого центра — центробластах и центро-цитах — и не выявляется в клетках пре- и постфолликулярных стадий. Необходимо подчеркнуть, что в условиях нормы клетки зародышевых центров вторичных фолликулов не экспрессируют антиапоптотический белок BCL-2, т.е. нечувствительны к сигналам блокировки апоптоза по митохондриальному пути.
Плазмоклеточная дифференцировка начинается в светлой зоне зародышевого центра, ассоциирована с миграцией В-клетки за пределы фолликула и может быть идентифицирована с помощью иммуногистохимического окрашивания с использованием антител к CD38, CD 138 (Syndecan-1), MUM.1/IRF4 (множественная миелома 1/интер-феронрегуляторный фактор-4). MUM.1 экспрес-сируется на поздней стадии фолликулярной и постфолликулярной (плазмоцитарной) диффе-ренцировки В-клеток; позитивны, в основном, плазматические клетки, единичные В-клетки фолликулов, а также небольшая часть Т-клеток. На этом этапе, как правило, снижается экспрессия пан-В-клеточных антигенов CD19, CD20, PAX 5, а также поверхностного иммуноглобулина, что сопровождается возрастанием цитоплазматической секреции иммуноглобулинов.
В результате В-клеточной дифференцировки различают 3 главные зрелые формы В-клеток:
Классификация опухолей лимфоидной ткани
(ВОЗ 2001) [3]
В-клеточные опухоли
Опухоли из предшественников В-клеток Лимфобластный лейкоз/лимфома из предшественников В-клеток
Далее кратко обозначим вопросы морфологической дифференциальной диагностики наиболее часто встречающихся В-клеточных лимфом, сформированных в соответствующие группы. Верификация варианта лимфомы возможна при иммуногисто-химическом исследовании с использованием правильно сформированной панели поли- и моноклональных антител, позволяющей выявить «диагностический» комплекс положительных реакций или «маркерный» антиген.
Дифференциальная диагностика лимфобластной лимфомы и лимфомы Беркитта
Морфологическим субстратом лимфобластной лимфомы (из предшественников) являются бласт-ные клетки средних размеров с округло-овальными и неправильными ядрами, высоким ядерно-цито-плазматическим соотношением, высокой митотической активностью.
Проведение иммуногистохимического исследования необходимо для установления В- или Т-линейной принадлежности лимфобластной лимфомы, так как на светооптическом уровне лимфобластные лимфомы из В- и Т-клеток-предшественниц неразличимы. При наличии морфологической картины бластной лимфомы, представленной мономорфны-ми клетками средних размеров с округло-овальными ядрами с наличием Беркиттоподобных участков, необходима дифференциальная диагностика с лимфо-мой Беркитта, имеющей фолликулярное происхождение.
Дифференциальная диагностика В-мелкоклеточных лимфом
Группа В-мелкоклеточных лимфом включает в себя:
Лимфома из малых лимфоцитов
Морфологическая картина лимфомы из малых лимфоцитов, идентичная субстрату B-клеточного хронического лимфоцитарного лейкоза (В-ХЛЛ), характеризуется диффузным разрастанием опухолевых клеток с морфологией малых лимфоцитов: клеток с округлыми ядрами, комковатым хроматином, неотчетливыми ядрышками. В различном количестве встречаются пролимфоциты — клетки средних размеров с отчетливыми центрально расположенными небольшими ядрышками, и параиммунобласты. Кроме типичной морфологии наличие в опухолевой популяции клеток с неправильными ядрами создает трудности в дифференциальной диагностике с другими мелкоклеточными лимфомами и получило название «атипичного варианта лимфомы из малых лимфоцитов».
В настоящее время выделяют 2 группы больных лимфомой из малых лимфоцитов/В-ХЛЛ. 1-я группа составляет 30—40% от всех случаев, характеризуется отсутствием соматического гена гипермутаций тяжелых цепей вариабельной области иммуноглобулина (IgVH) опухолевых клеток и является прогностически неблагоприятной. Маркерами неблагоприятного течения, тесно коррелирующими с отсутствием вышеуказанных мутаций опухолевого клона, являются активационный антиген CD38 (более 30% положительных опухолевых клеток) и ZAP 70 — белок, ассоциированный с |-цепью Т-клеточного рецептора (>20% положительных опухолевых клеток) [4]. Если В-клетка — предшественница лимфомы из малых лимфоцитов прошла фолликулярную диффе-ренцировку, а значит, имеет мутации IgVH, клиническое течение лимфомы из малых лимфоцитов более благоприятно.
Лимфома из клеток мантии
Опухолевым субстратом являются клетки с неправильными и округло-овальными светлыми ядрами, нередко отчетливо видны признаки перинукле-арной конденсации хроматина. Морфологически выделяют классический и бластоидный варианты. Маркером данного варианта лимфомы является экспрессия белка сyclinD1, образующегося в результате t(11;14)(q13;q32) и выявляемого при иммуногистохимическом исследовании.
Фолликулярная лимфома
Фолликулярная лимфома несет в себе черты предсуществующего вторичного фолликула: ее клеточный состав включает в себя центроциты и цент-робласты, в основе нодулей имеется организованная сеть фолликулярных дендритических клеток (ФДК), присутствует выраженная инфильтрация Т-клетками.
Нодальная лимфома из клеток маргинальной зоны
В лимфатическом узле выделяют 2 морфологических варианта данной лимфомы. Представляется важным подчеркнуть, что при иммуногистохимическом исследовании на парафиновых срезах с использованием высокотемпературной обработки далеко не всегда удается выявить моноклональность опухолевых клеток. Учитывая сходство в лимфатическом узле морфологической и иммунофенотипической картины лимфомы из клеток маргинальной зоны и лимфоплазмоцитарной лимфомы/макроглобулинемии Вальденстрема, в настоящее время широко обсуждается вопрос о том, являются ли эти лимфомы различными клинико-морфологическими вариантами или они едины по своей биологической сущности и клиническому течению. Добавим к этому, что до 60% наблюдений лимфомы из клеток маргинальной зоны характеризуются поражением костного мозга [7].
Лимфома Беркитта и ее дифференциальная диагностика
Лимфома Беркитта имеет фолликулярное центробластное происхождение. Морфологическая картина характеризуется мономорфными бластными клетками средних размеров с насыщенным рисунком хроматина, множественными неотчетливыми ядрышками, узким ободком интенсивно пиронинофильной цитоплазмой, высокой митотической активностью. Морфологические признаки апоптоза ярко выражены, макрофаги фагоцитируют апоптотические тельца, что создает картину «звездного неба». Иммунофенотип опухолевых клеток в полной мере отражает ее фолликулярное происхождение: CD20+, IgM+, CD10+, BCL-6+. Для лимфомы Беркитта характерны коэкспрессия практически всеми опухолевыми клетками CD43 и высокий уровень пролиферативной активности, оцениваемый по уровню экспрессии Ki-67 и достигающий почти 100% в сохранных опухолевых клетках. Особое значение для верификации данного варианта лимфомы имеет генетическое изучение — выявление реаран-жировки онкогена MYC и гиперэкспрессии MYC c участием локуса генов тяжелых цепей иммуноглобулинов при транслокации t(8;14)(q24;q32). Эта транслокация выявляется в 80% случаев. В 20% отмечаются транслокации с участием локусов генов легких цепей иммуноглобулинов t(2;8)(p12;q24) иt(8;22)(q24;q11).
При морфологическом исследовании наибольшие трудности вызывает атипичный вариант лимфомы Беркитта с более крупными и полиморфными ядрами, отдельными клетками с отчетливыми укрупненными ядрышками (в REAL-классификации большинство таких случаев относились к Беркитто-подобной лимфоме) или присутствие Беркиттопо-добных участков в субстрате В-ДККЛ (центробласт-ной). В ряде случаев при В-ДККЛ выражены признаки апоптоза, многочисленные макрофаги с фагоцитозом апоптотических телец создают картину «звездного неба». Вместе с тем известно, что в 10% случаев при В-ДККЛ отмечается идентичная транслокация t(8;14)(q24;q32) с вовлечением протоонкогена MYC, что является признаком агрессивного клинического течения. Таким образом, диагностика лимфомы Беркитта требует корректной оценки каждой составляющей диагноза: морфологической, иммунофенотипической картины, генетического исследования, клинических данных.
В-ДККЛ и особенности иммунофенотипа
В-ДККЛ могут возникать de novo или в результате опухолевой трансформации зрелоклеточных В-клеточных лимфом: В-ХЛЛ/лимфомы из малых лимфоцитов, лимфоплазмоцитарной лимфомы, лимфомы из клеток маргинальной зоны или фолликулярной лимфомы (синдром Рихтера). В настоящее время проводятся исследования по клинико-иммунофенотипическому сопоставлению В-ДККЛ в плане разделения их на группы фолликулярного и постфолликулярного происхождения [8]. Как указывалось выше, маркерами фолликулярного происхождения являются CD10, BCL-6; маркерами постфолликулярного происхождения, которые экспрессируются активированными (антигенинду-цированными) В-клетками, являются CD138, MUM.1. При наличии экспрессии MUM.1 и отсутствии экспрессии BCL-6 и CD138 лимфому относят к поздней фолликулярной/ранней постфолликулярной дифференцировке. Таким образом, выделяют диффузные В-крупноклеточные лимфомы:
Экспрессия маркеров фолликулярной диффе-ренцировки является фактором благоприятного течения заболевания [9, 10]. Экспрессия маркеров постфолликулярного происхождения или сочетание одного из маркеров фолликулярного и постфолликулярного происхождения ассоциировано с худшим прогнозом. Между морфологической картиной и иммунофенотипическими характеристиками опухоли в плане ее фолликулярного или постфолликулярного происхождения не отмечено какой-либо зависимости. Экспрессия BCL-2 не зависит от реаранжиров-ки гена BCL-2 (t(14:18)(q21;q32)) и является плохим прогностическим фактором [11, 12]. В последние годы изучению экспрессии BCL-2 при В-ДККЛ придается особое значение в прогностическом плане.
В-клеточная лимфома Ходжкина
Спустя почти 170 лет после первого описания болезни Ходжкина была установлена моноклональ-ная В-клеточная пролиферация опухолевых клеток фолликулярного происхождения, что позволило ввести в классификацию ВОЗ (2001) термин «лимфома Ходжкина» вместо «болезнь Ходжкина» и «лимфогранулематоз». В классификации ВОЗ (2001) выделено нодулярное лимфоидное преобладание, отличающееся по морфологическим, иммунологическим, генотипическим и клиническим характеристикам от классических вариантов лимфомы Ходжкина: богатого лимфоцитами нодулярного склероза, смешанноклеточного варианта и варианта с лимфоидным истощением, объединенных единой биологией опухолевых клеток и единым иммунофенотипом. Опухолевым субстратом при нодулярном лимфоидном преобладании являются L&H-, CD20-положительные клетки. Применение мабтеры при нодулярном лимфоидном преобладании оказалось чрезвычайно перспективным. Для верификации диагноза нодулярного лимфоид-ного преобладания лимфомы Ходжкина с целью дифференциации его с классическими вариантами лимфомы Ходжкина, в частности, с классическим вариантом, богатым лимфоцитами, и целым рядом крупноклеточных лимфом, сходных на светооптическом уровне, необходимо иммуногистохимическое исследование.
Таким образом, морфологическая диагностика чрезвычайно усложнилась благодаря введению в гемопатологию новых вариантов неходжкинских лимфом и лимфомы Ходжкина. Иммуногистохимиче-ское исследование постепенно становится неотъемлемой составляющей морфологического диагноза, в частности, позволяет верифицировать варианты лимфом, что необходимо для адекватного лечения онкогематологических заболеваний.
Автор: А.М. Ковригина Отдел патологической анатомии опухолей человека ГУ РОНЦим. Н.Н. Блохина РАМН
«Вместе проти рака.Врачам всех специальностей» №2, 2006 г.