Щелочная кислота для чего используется
Кислоты, щелочи и основания с точки зрения химии
Что же представляют собой кислоты, щелочи и основания с химической точки зрения? Читай внимательно и запоминай. Смотри не запутайся!
Что такое кислота?
Кислоты представляют собой молекулы, которые при растворении в воде высвобождают ион водорода. Ионы — это положительно и отрицательно заряженные частички, которые придают кислотам их свойства.
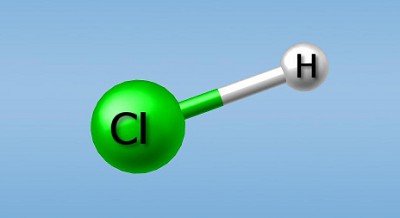
Давай рассмотрим этот процесс на примере соляной кислоты — HCI. Если соляную кислоту соединить с водой, она распадется на ион водорода (Н+) и ион хлора (CI ). Так как в составе молекулы воды также есть водород, то при распаде соляной кислоты общее количество ионов водорода в растворе увеличится.
А что происходит со щелочами при попадании в воду? В воде щелочи высвобождают гидроксид-ионы. Например, гидроксид натрия (NaOH) — щелочь. При соединении с водой он распадается на ионы натрия (Na+) и гидроксид-ионы (ОН ). Когда гидроксид-ионы встречаются с ионами водорода воды, общее количество ионов водорода в растворе сокращается.
Что такое основание?
Основание — это соединение, химически противоположное кислоте. В состав основания входят ионы металлов и связанные с ними гидроксид-ионы. Эти вещества способны присоединять ионы водорода (Н+) из кислоты. Когда основание смешивается с кислотой, оно полностью нейтрализует его свойства, а в результате реакции образуется соль.
Например, с точки зрения химии хорошо знакомая тебе зубная паста — это основание, которое нейтрализует кислоту, оставшуюся во рту после приема пищи.
ЗАПОМНИ! В связи с тем, что ионы существуют только в растворах, свои свойства кислоты проявляют также лишь в растворах.
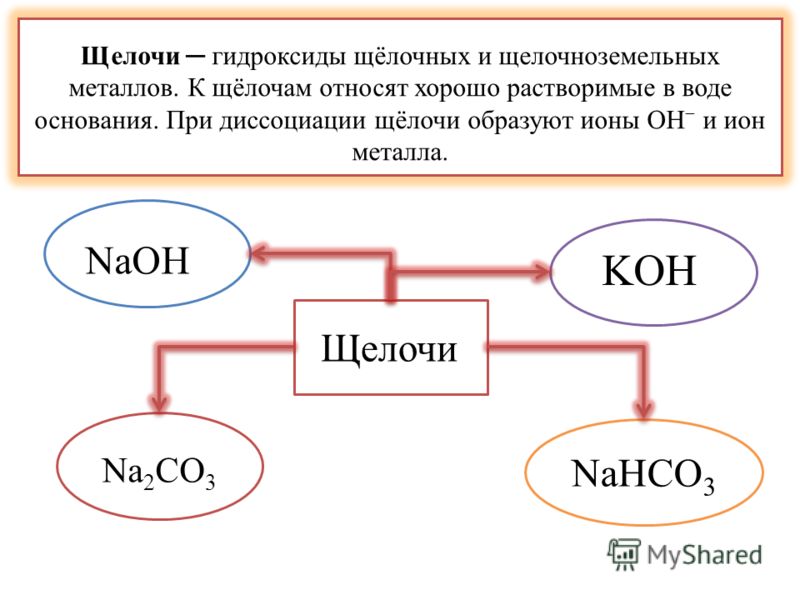
Что такое щелочь?
Щелочи — это соединения, в состав которых входят ион металла и гидроксид-ион (ОН-). К щелочам химики относят гидроксиды щелочных и щелочноземельных металлов. Щелочи представляют собой вещества белого цвета, которые хорошо растворяются в воде. Более того, растворение всегда сопровождается очень активным выделением тепла. Щелочи вступают в реакцию с кислотами, образуя соль и воду.
Щелочи очень активны! Они способны поглощать из воздуха не только водяные пары, но и молекулы углекислого газа, сероводорода и т.д. Поэтому хранят щелочи в очень герметичной таре. Концентрированные щелочи разрушают стекло, а иногда даже фарфор. Если сравнивать щелочи с кислотами, то щелочи могут вызвать более сильные ожоги, так как они очень быстро проникают в ткань, и их практически невозможно смыть водой.
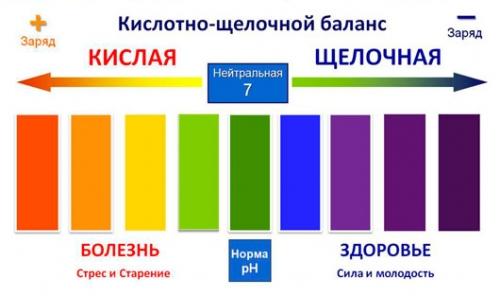
Шкала pH
Почему одни жидкости — кислоты, а другие — щелочи? Оказывается, все дело в типе ионов. Если в жидкости больше концентрация ионов водорода, такая жидкость является кислотой, а если гидроксид-ионов, то щелочью.
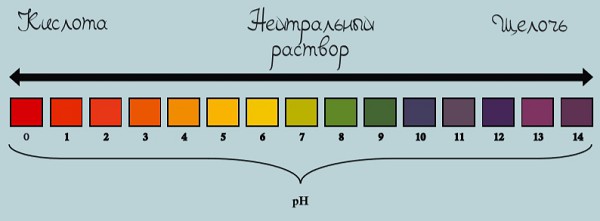
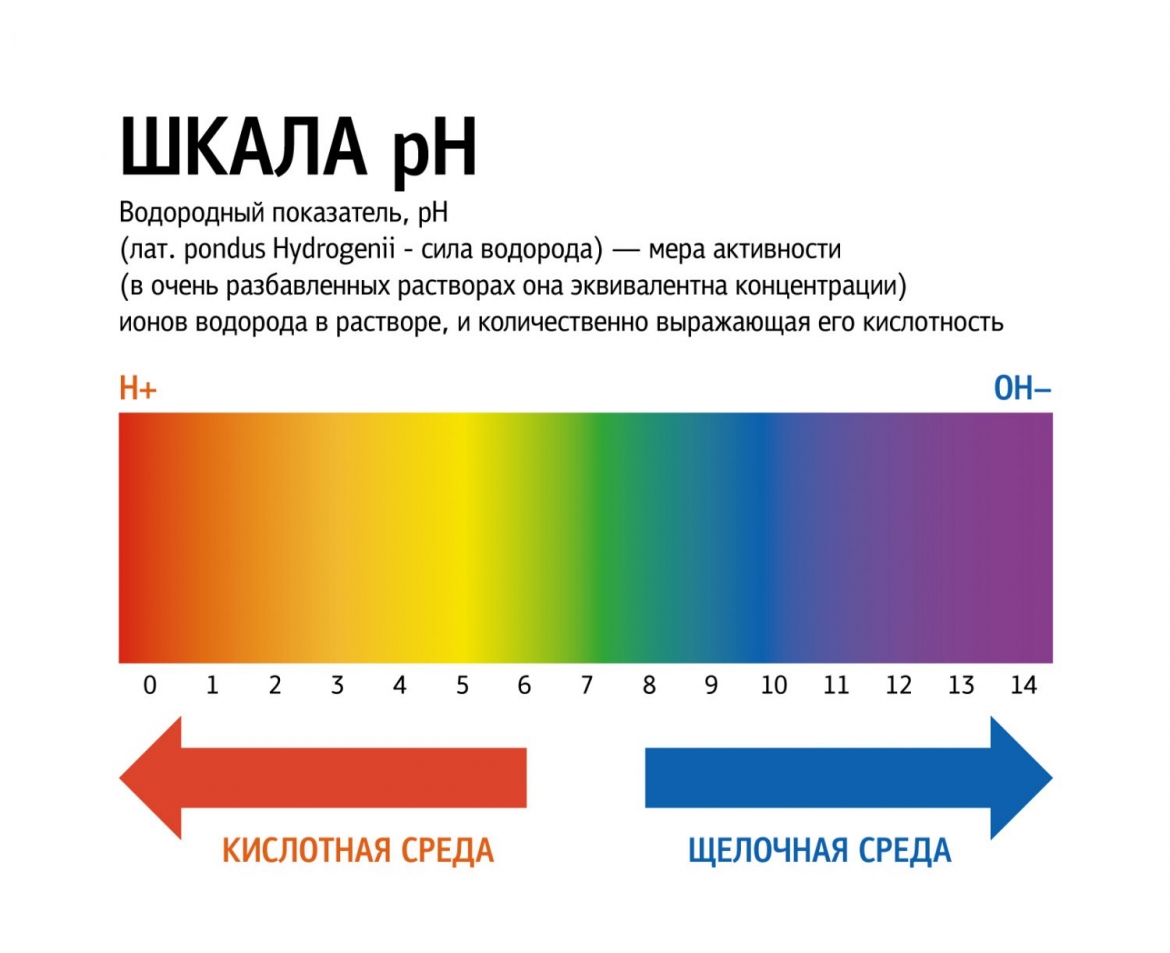
Шкала pH используется для измерения кислотности или щелочности раствора от 0 до 14.
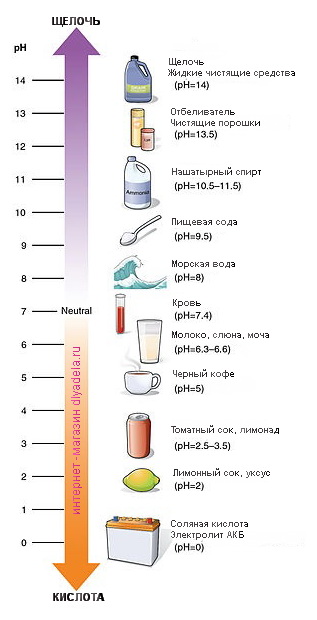
Если pH раствора находится в пределах 0—7, то такой раствор считается кислотным, при этом раствор с pH = 0 — самый кислый. Растворы с pH в пределах 7—14 являются щелочами, при этом раствор с pH = 14 считается самым едким и опасным.
Если pH раствора равен 7, то такой раствор является нейтральным, так как концентрация ионов водорода равна концентрации гидроксид-ионов. Пример нейтрального раствора — чистая вода.
Что такое показатель pH?
В переводе с латинского pH (potentia hydrogeny) означает «сила водорода», т.е. активность ионов водорода в водном растворе.
Как химики определяют наличие воды в веществе?
Они берут бесцветный сульфат меди (CuSO4) и добавляют его в вещество. Если воды нет, то порошок остается бесцветным, однако даже при минимальном количестве воды он становится синим.
Концентрированные кислоты и щелочи
Ядовитые жидкости находятся не только в школьных лабораториях, они и вокруг нас. Это различные средства бытовой химии (стиральные порошки и пятновыводители), цветочные удобрения и ядохимикаты, лаки и краски, клеи и растворители, бензин и дизельное топливо, аккумуляторные, тормозные и прочие технические жидкости, а на кухне — уксус и уксусная кислота.
Совершенно очевидно, что все вышеупомянутые вещества должны использоваться строго по назначению и в соответствии с определенными правилами, указанными на этикетке каждого средства. К сожалению, несоблюдение мер безопасности при работе с ядовитыми средствами может привести к серьезным проблемам со здоровьем: отравлению, различным повреждениям кожи и слизистых оболочек.
ВНИМАНИЕ! Обязательно запомни следующую информацию: кислоты с очень низким показателем pH (менее 2) и щелочи, pH которых выше 13, являются чрезвычайно опасными!
Кислоты и щелочи в природе
ОСТОРОЖНО! Как правило, концентрированные кислоты и щелочи есть во всех школьных каби нетаххимии, и пользоваться ими можно только под руководством учителя.
Применение щелочей
Щелочи широко применяются в различных отраслях промышленности, медицине и быту. Например, каустическая сода используется для растворения жиров и входит в состав многих моющих средств, применяется при производстве целлюлозы, масел, дизельного топлива. Также щелочи используют для изготовления мыла, искусственных волокон, различных красителей и т.д.
Кислоты в почве
Оказывается, кислоты есть и в почвах, а способность почвы проявлять свойства кислот называется кислотностью. Этот показатель зависит от наличия в земле ионов водорода. От кислотности почвы зависят рост и развитие растений. Большинство из них предпочитает нейтральные или близкие к ним почвы. Однако есть ряд растений, которые отлично себя чувствуют именно на кислотных почвах, например рододендроны, гортензии, азалии. Некоторые сорта гортензии могут менять цвет бутонов в зависимости от условий выращивания и кислотности почвы. Ученые выяснили, что на цвет бутонов влияет наличие алюминия!
Большинство садовых почв характеризуется достаточным содержанием этого элемента. В кислой среде соединения алюминия превращаются в растворимые и становятся доступными для растений, поэтому и вырастают бутоны голубого цвета. В нейтральной или щелочной среде алюминий находится в виде нерастворимых соединений, поэтому он и не поступает в растения. В результате на таких почвах растут бутоны розового цвета.
Кислоты и щелочи в нашем организме
Для переваривания пищи организм использует желудочный сок, в состав которого входят соляная кислота и различные ферменты. Иногда, особенно после переедания, мы можем почувствовать боль в желудке. Чаще всего для снятия неприятных ощущений достаточно принять антацидный, или противокислотный, препарат, основное действие которого направлено на нейтрализацию соляной кислоты в желудке. Как правило, все антациды — щелочи, и именно они нейтрализуют повышенную активность кислот.
Чем отличаются кислоты от щелочей
Кислоты и щёлочи отличают по показателям pH (шкала pH). Ниже Вы видите картинку – это специальная шкала, на которой имеются числа от 0 и до 14. Нулём обозначают самые сильные кислоты, а четырнадцатью – самую сильную щёлочь. Но какая же середина между этими числами? Может быть 5, может быть 7, а может быть 10? Серединой принято считать число 7 (нейтральное положение). То есть числа до 7 это все кислоты, а больше 7 это щёлочи.
Именно для этой шкалы разработаны специальные индикаторы — лакмусы. Это обычная полоска, которая реагирует на среду. В кислотной среде она окрашивается в красный цвет, а в щелочной среде – в синий цвет. Она необходима не только в химии, но и в быту.
Например, если у Вас есть аквариум, то немаловажную роль играет кислотность воды. От неё зависит вся жизнь аквариума. К примеру, показатель кислотности воды для аквариумных рыбок колеблется от 5 до 9 рН. Если будет больше или меньше, то рыбка будет чувствовать себя не комфортно, а может и вовсе умереть. Всё тоже самое и с растениями для аквариумов…
Кислоты
Кислоты — это соединения, содержащие водород и образующие ионы водорода (Н+) при растворении в воде. Ионы — это частицы с электрическим зарядом (см. статью «Химические связи»). Именно ионы придают кислотам их свойства, но существовать они могут только в растворе. Следовательно, свойства кислот проявляются исключительно в растворах. Молекула серной кислоты (H2SO4) состоит из атомов водорода, серы и кислорода. В состав соляной кислоты (НСl) входят водород и хлор. Кислота считается сильной, если большинство ее молекул распадаются в растворе, выделяя ионы водорода. Соляная, серная, азотная кислоты относятся к сильным. На контейнерах с сильными кислотами ставятся принятые во всем мире символы, означающие «опасно» и «высокая активность»Сила кислоты измеряется числом рН — водородным показателем. Сильные кислоты очень агрессивны; попав на поверхность предмета или на кожу, они прожигают её. На контейнерах с сильными кислотами ставятся принятые во всем мире символы, означающие «опасно» и «высокая активность».
Такие кислоты, как лимонная или уксусная, т.е. произведенные живыми организмами, называются органическими. Кислоты широко применяются в химической и медицинской промышленности, в производстве продуктов питания и синтетических волокон. Виноградный уксус содержит слабую кислоту, называемую уксусной. В помидорах есть органическая салициловая кислота. В цветных пятнах на коже морских улиток содержится кислота с неприятным вкусом, отпугивающая хищников. Для всех кислот характерно сходное поведение в химических реакциях. Например, при реакциях кислот с основаниями образуется нейтральное соединение — соль и вода. Реакции кислот с большинством металлов дают соль и водород. Реагируя с карбонатами, кислоты дают соль, углекислый газ и воду. Известный кулинарам пекарный порошок содержит гидрокарбонат натрия и винную кислоту. Когда в муку, содержащую пекарный порошок, добавляют воду, кислота и карбонат порошка вступают в реакцию, углекислый газ начинает выделятся в виде пузырьков, и это помогает тесту подниматься.
рН и индикаторы
Сила кислот и оснований определяется числом рН. Это мера концентрации ионов водорода в растворе. Число рН изменяется от 0 до 14. Чем меньше рН, тем выше концентрация водородных ионов. Раствор, рН которого меньше 7, — кислота. Апельсиновый сок имеет рН 4, значит, это кислота. Вещества с рН = 7 нейтральны, а вещества с рН больше 7 — основания или щелочи. рН кислоты или щелочи можно определить с помощью индикатора. Индикатор — это вещество, меняющее цвет при контакте с кислотой или щелочью. Так лакмус краснеет в кислоте и синеет в щелочи. Кислота окрашивает синюю лакмусовую бумажку в красные цвет, а красная лакмусовая бумажка в щелочи становится синей или фиолетовой. Лакмус получают из примитивных растений, называемых лишайниками. Другие растения, например, гортензия и краснокочанная капуста, также являются природными индикаторами.
Так называемый универсальный индикатор – это смесь нескольких красок. Он меняет цвет в зависимости от pH вещества. Он становится красным, оранжевым или желтым в кислотах, зеленым или желтым в нейтральных растворах и синим или фиолетовым в щелочах.
Серная кислота
Серная кислота играет важную роль в промышленности, прежде всего в производстве удобрений на основе суперфосфатов и сульфата аммония. Она также используется в производстве синтетических волокон, красителей, пластмасс, лекарств, взрывчатых веществ, моющих средств, автомобильных аккумуляторов. Когда-то серную кислоту называли минеральной кислотой, так как ее получали из серы — вещества, встречающегося в земной коре в виде минерала. Серная кислота очень активна и агрессивна. При растворении в воде она выделяет много тепла, поэтому ее нужно вливать в воду, но не наоборот — тогда кислота растворится, а вода поглотит тепло. Она — мощный окислитель, т.е. при реакциях окисления она отдает кислород другим веществам. Серная кислота также является осушителем, т.е. забирает воду, связанную с другим веществом. Когда сахар (C12H22O11) растворяется в концентрированной серной кислоте, кислота забирает у сахара воду, и от сахара остается пенящаяся масса черного угля.
Кислоты в почве
Цветы гортензии на кислотной почве синие, а на щелочной — розовыеКислотность почвы зависит от характера образовавших ее пород и от растущих на ней растений. На меловых и известняковых породах почва обычно щелочная, а на лугах, в песчаных и лесистых районах она более кислая. Кислотность также повышают кислотные дожди. Для земледелия лучше всего подходят нейтральные или слабокислые почвы, рН которых от 6,5 до 7. Разлагаясь, мертвые листья образуют органическую гуминовую кислоту и повышают кислотность почвы. Там, где почвы чересчур кислотные, в них добавляют измельченный известняк или гашеную известь (гидроксид кальция), т.е. основания, которые нейтрализуют кислоты почвы. Такие растения, как рододендроны и азалии хорошо растут на кислотных почвах. Цветы гортензии на кислотной почве синие, а на щелочной — розовые. Гортензия – природный индикатор. На кислотных почвах её цветы синие, а на щелочных розовые.
В настоящее время в химии принята теория Брёнстеда — Лоури и Льюиса, которая определяет кислоты и основания. В соответствии с этой теорией, кислоты — это вещества, способные отщеплять протон, а основания — отдавать электронную пару OH−. Можно сказать, что под основаниями понимают соединения, которые при диссоциации в воде образуют только анионы вида OH−. Если совсем просто, то щелочами называют соединения, состоящие из металла и гидроксид-иона OH−.
К щелочам принято относить гидроксиды щелочных и щелочно-земельных металлов. Все щелочи — это основания, но не наоборот, нельзя считать определения «основание» и «щелочь» синонимами.
Правильное химическое название щелочей — гидроксид (гидроокись), например, гидроокись натрия, гидроксид калия. Часто употребляются также названия, которые сложились исторически. Ввиду того, что щелочи разрушают материалы органического происхождения — кожу, ткани, бумагу, древесину, их называют едкими: например, едкий натр, едкий барий. Однако понятием «едкие щелочи» химики определяют гидроксиды щелочных металлов — лития, натрия, калия, рубидия, цезия.
Свойства щелочей
Щелочи — твердые вещества белого цвета; гигроскопичные, водорастворимые. Растворение в воде сопровождается активным выделением тепла. Вступают в реакции с кислотами, образуя соль и воду. Эта реакция нейтрализации является важнейшей из всех свойств щелочей. Кроме этого, гидроксиды реагируют с кислотными оксидами (образующими кислородосодержащие кислоты), с переходными металлами и их оксидами, с растворами солей.
Гидроксиды щелочных металлов растворяются в метиловом и этиловом спиртах, способны выдерживать температуры до +1000 °С (за исключением гидроксида лития).
Гидроксид натрия (едкий натр) используется в чистящих жидкостях, а также (как и гидроксид калия) для производства мыла. Мыло — это соль, образующаяся при реакции щелочей с кислотами растительных жиров. Жало осы выпускает щелочь, которую можно нейтрализовать кислотой, например уксусом.
Щелочи — активные химические реагенты, поглощающие из воздуха не только водяные пары, но и молекулы углекислого и сернистого газа, сероводорода, диоксида азота. Поэтому хранить гидроксиды следует в герметичной таре или, например, доступ воздуха в сосуд со щелочью организовать через хлоркальциевую трубку. В противном случае хим.реактив после хранения на воздухе будет загрязнен карбонатами, сульфатами, сульфидами, нитратами и нитритами.
Если сравнивать щелочи по химической активности, то она увеличивается при движении по столбцу таблицы Менделеева сверху вниз.
Концентрированные щелочи разрушают стекло, а расплавы щелочей — даже фарфор и платину, поэтому растворы щелочей не рекомендуется хранить в сосудах с пришлифованными стеклянными пробками и кранами, так как пробки и краны может заклинить. Хранят щелочи, обычно, в полиэтиленовых емкостях.
Именно щелочи, а не кислоты, вызывают более сильные ожоги, так как их сложнее смыть с кожи и они проникают глубоко в ткань. Смывать щелочь надо неконцентрированным раствором уксусной кислоты. Работать с ними необходимо в средствах защиты. Щелочной ожог требует немедленного обращения к врачу!
Применение щелочей
— В качестве электролитов.
— Для производства удобрений.
— В медицине, химических, косметических производствах.
— В рыбоводстве для стерилизации прудов.
Едкий натр. Самая популярная и востребованная в мире щелочь. Применяется для омыления жиров в производстве косметических и моющих средств, для изготовления масел в процессе нефтепереработки, в качестве катализатора и реактива в химических реакциях; в пищепроме.
Едкое кали. Применяется для производства мыла, калийных удобрений, электролитов для батареек и аккумуляторов, синтетического каучука. Также — в качестве пищевой добавки; для профессиональной очистки изделий из нержавеющей стали.
Гидроксид алюминия. Востребован в медицине как отличный адсорбент, антацид, обволакивающее средство; ингредиент вакцин в фармацевтике. Кроме этого, вещество применяется в очистных сооружениях и в процессах получения чистого алюминия.
Гидроокись кальция. Популярная щелочь с очень широким спектром применения, которую в быту знают под названием «гашеная известь». Используется для дезинфекции, смягчения воды, в производстве удобрений, едкого натра, «хлорки», строительных материалов. Применяется для защиты деревьев и деревянных сооружений от вредителей и огня; в пищепроме как пищевая добавка и реактив при производстве сахара.
Гидроокись лития. Востребованное соединение в химпроме как сырье; в стекольной, керамической, Фиксаналырадиотехнической индустрии; для производства смазочных материалов, электролитов; для поглощения вредных газов.
Гидроокись бария. Применяется в химпроме как катализатор, а также в пищепроме для очистки жиров, сахара.
• Кислоты и щелочи неспособны мирно сосуществовать даже одну секунду, находясь в соприкосновении. Перемешавшись, они мгновенно начинают бурное взаимодействие. Химическая реакция с ними сопровождается шипением и разогревом и длится до тех пор, пока эти ярые антагонисты не уничтожат друг друга.
• Кислотам свойственно образовывать кислую среду, а щелочам – щелочную.
• Химики отличают щелочь от кислоты по ее поведению с лакмусовой бумажкой или фенолфталеином.
Щелочь
Производство широкого спектра потребительских товаров зависит от использования щелочей 
Немного исторических моментов из истории получения щелочи.
Лебланский способ производства доминировал в мировом производстве до конца 19-го века, но после первой мировой войны был полностью вытеснен другим методом конверсии соли, который был усовершенствован в 1860-х годах Эрнестом Солве из Бельгии. В конце XIX века появились электролитические методы производства каустической соды, объемы которых быстро росли.
По методу Солве, аммиачно-содовый процесс производства кальцинированной соды протекал следующим образом: поваренная соль в виде сильного рассола химически обрабатывалась для устранения примесей кальция и магния и затем насыщалась рециркулирующим газом аммиака в башнях. После, аммиачный рассол насыщался газом с использованием газообразного диоксида углерода при умеренном давлении в башне другого типа. Эти два процесса дают бикарбонат аммония и хлорид натрия, двойное разложение которого дает желаемый бикарбонат натрия, а также хлорид аммония. Затем бикарбонат натрия нагревают до разложения его до необходимого карбоната натрия. Аммиак, вовлеченный в процесс, почти полностью восстанавливается путем обработки хлоридом аммония с известью, с получением аммиака и хлорида кальция. Восстановленный аммиак затем повторно используют в описанных выше процессах.
В нескольких местах в мире существуют значительные запасы минеральной формы кальцинированной соды, известной как природная щелочь. На таких месторождениях производят большую часть природной щелочи в мире из обширных месторождений в подземных шахтах.
Природный натрий металлический.
Прочитайте статью Щелочи (источник «Энциклопедический словарь химика»)и получите больше представления о том что такое щелочь, или посмотрите видеоролик об этом химическом реактиве Щелочи.
Использование щелочи в окружающей нас среде
Щелочь снискала широкое применение в нашей жизни. Благодаря щелочи можно в той или иной форме добиться смягчения воды и удалить из нее примеси, такие как марганец, фториды и органические танины. В тяжелых отраслях промышленности используют щелочь в виде извести для поглощения и нейтрализации оксидов серы в выбросах в атмосферу, тем самым уменьшая вероятность выпадения кислотных осадков. Диоксид серы, производимый промышленными предприятиями и выпускаемый в атмосферу, возвращается на землю в виде кислотных дождей или серной кислоты. Такие территории, подвергшихся воздействию кислотных дождей, обрабатываются с помощью авиации препаратами, в состав которых входит щелочь. Это позволяет контролировать и нейтрализовывать критический уровень рН воды и почвы на участках, где произошли такие техногенные выбросы. Внесение щелочи в отходы и сточные воды, поддерживая правильный уровень рН в окислительных процессах при их разложении. Стабилизирует образования осадка в сточных водах и уменьшает запах или образования патогенных бактерий. Обработанный негашеной известью ил из сточных водоемов, соответствует экологическим нормам, что делает его пригодным в дальнейшем в использовании в качестве удобрения на сельскохозяйственных землях.
Промышленное применение щелочи
В промышленных и горных работах применение щелочей в сточных водах помогает нейтрализовать вредные соединения и произвести их очистку. Обработка избыточной щелочью, повышает рН воды до 10,5-11 и может дезинфицировать воду и удалять тяжелые металлы. Щелочи, такие как известь, являются ключевыми в химическом производстве карбида кальция, лимонной кислоты, нефтехимии и магнезии. В бумажной промышленности карбонат кальция является каустифицирующим агентом для отбеливания. Сталелитейная промышленность зависит от извести в качестве компонента для удаления примесей, таких как газообразный монооксид углерода, кремния, марганца и фосфора.
Моющие средства образованные щелочью
Щелочные моющие средства помогают при очистке поверхностей с сильными загрязнениями. Эти экономичные, водорастворимые щелочи с рН от 9 до 12,5 могут нейтрализовать кислоты в различных типах грязи и отложениях.
Щелочь в производстве стекла и керамики
Щелочь является основным сырьем в производстве стекла. Известняк, а также песок, кальцинированная сода, известь и другие химикаты, обжигаются при чрезвычайно высоких температурах и превращаются в расплавленную массу. Стеклодувы и гончары используют щелочи для глазурей и флюсов, которые реагируют с кислотами с образованием силикатов (стекла) при нагревании. Концентрированные щелочи создают более насыщенный цвет в глазури.
Литература о щелочи
«Среди многочисленных веществ, которыми химики с давних времен пользовались в своих лабораториях, почетное место всегда занимали едкие щелочи — едкое кали и едкий натр. Сотни различных химических реакций осуществляются в лабораториях, на заводах и в быту при участии щелочей. С помощью едких кали и натра можно, например, сделать растворимыми большинство нерастворимых веществ, а самые сильные кислоты и удушливые пары можно благодаря щелочам лишить всей их жгучести и ядовитости.
Едкие щелочи — очень своеобразные вещества. На вид это беловатые, довольно твердые камни, ничем как будто не примечательные. Но попробуйте взять едкое кали или натр и зажать его в руке. Вы почувствуете легкое жжение, почти как от прикосновения к крапиве. Долго держать в руке едкие щелочи было бы нестерпимо больно: они могут разъесть кожу и мясо до кости. Вот почему их называют «едкими», в отличие от других, менее «злых» щелочей — всем известных соды и поташа. Из соды и поташа, кстати сказать, почти всегда и по лучались едкие натр и кали.
У едких щелочей сильнейшее влечение к воде. Оставьте кусок совершенно сухого едкого кали или натра на воздухе. Через короткое время на его поверхности неизвестно откуда появится жидкость, потом он весь станет мокрым и рыхлым и под конец расползется бесформенной массой, как кисель. Это из воздуха щелочь притягивает к себе пары воды и образует с влагой густой раствор. Кому впервые приходится погрузить пальцы в раствор едкой щелочи, тот с удивлением заявляет: — Как мыло! И это совершенно правильно. Щелочь — скользкая, как мыло. Больше того: мыло потому и «мыльно» на ощупь, что его изготовляют с помощью щелочей. Раствор едкой щелочи и на вкус напоминает мыло.
Но химик узнаёт едкую щелочь не по вкусу, а по тому, как это вещество ведет себя с краской лакмус и с кислотами. Бумажка, про питанная синей краской лакмус, мгновенно краснеет, когда ее опус кают в кислоту; а если этой покрасневшей бумажкой дотронуться до щелочи, то она тотчас же опять становится синей. Едкая щелочь и кислота не могут мирно существовать рядом ни одной секунды. Они тотчас же вступают в бурную реакцию, шипя и разогреваясь, и уничтожают друг друга до тех пор, пока в растворе не останется ни крупинки щелочи или ни капли кислоты. Только тогда наступает успо коение. Щелочь и кислота «нейтрализовали» друг друга, говорят в таких случаях. От соединения их между собой получается «нейтральная» соль — ни кислая, ни едкая. Так, например, от соединения жгучей соляной кислоты с едким натром получается обыкновеннейшая поваренная соль.»
Отличительные признаки щелочи.
Из выше прочитанного мы уже знаем, что противоположностью щелочи является кислота. Вместо горького вкуса 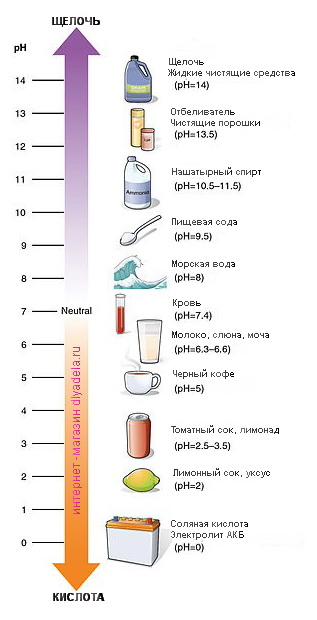
Почему вещество щелочное?
Таким образом, нам уже известно, что рН уровень представляет собой шкалу, значения которой колеблятся от 0-14 и указывают, является ли вещество щелочью или кислотой. Однако мы действительно не знаем, почему. Давайте рассмотрим этот вопрос более детально.
Уровень рH вещества зависит от того, как атомы расположены и объединены в веществе. Чистая вода находится прямо в середине шкалы и имеет pH 7. Это означает, что она содержит равное количество атомов водорода (H +) и гидроксидных атомов (OH-). Когда вещество имеет больше атомов водорода (Н +), это кислота. Когда вещество имеет больше гидроксидных атомов (OH-), оно является щелочным.
Где купить щелочь?
Купить щелочь в Новосибирске со степенью очистки ЧДА (чистая для анализов) в магазине «Для дела» можно на странице заказов: едкий натр NaOH или едкий кали KOH. Для иногородних покупателей товар может быть отправлен Почтой РФ или транспортными компаниями.