Сепарация листков плевры что это
Заболевания плевры: диагностика и лечение
Заболевания плевры часто встречаются в общей практике и могут отражать широкий диапазон лежащих в их основе патологических состояний, затрагивающих легкие, грудную стенку, а также системных болезней. Самое распространенное их проявление
Заболевания плевры часто встречаются в общей практике и могут отражать широкий диапазон лежащих в их основе патологических состояний, затрагивающих легкие, грудную стенку, а также системных болезней. Самое распространенное их проявление заключается в образовании плеврального выпота, и у подавляющего большинства таких больных необходимы рентгенологическое подтверждение и дальнейшее обследование. Последние достижения, касающиеся методов получения изображения органов грудной клетки, терапии и хирургии, позволили усовершенствовать диагностику и лечение больных с патологией плевры.
Плевра дает грудной клетке возможность придавать легким необходимую форму и приводить их в движение с минимальными затратами энергии. Для чего два плевральных листка (париетальный и висцеральный) должны скользить один по другому — этому процессу способствует небольшое количество (0,3 мл/кг) жидкости.
Плевральная жидкость фильтруется из мелких сосудов париетальной плевры в плевральную полость и реабсорбируется лимфатическими сосудами этого же листка. Экспериментальные данные показывают, что объем и состав плевральной жидкости в норме очень стабильны, и выпот возникает только в тех случаях, если скорость фильтрации превышает максимальный отток лимфы либо нарушено обратное всасывание [1].
Плевральный выпот
Плевральные выпоты традиционно подразделяются на транссудаты (общий белок 30 г/л). В промежуточных случаях (а именно, когда содержание протеина составляет 25–35 г/л) разграничить экссудат и транссудат помогает определение содержания в плевральной жидкости лактатдегидрогеназы (ЛДГ) и градиента альбумина между сывороткой и плевральной жидкостью.
Наиболее часто встречающиеся причины и характерные признаки плевральных выпотов приведены в таблицах 1 и 2. Их дифференциация важна потому, что «низкобелковые» выпоты (транссудаты) не требуют дальнейших диагностических мероприятий; необходимо лишь лечение вызвавшей их патологии, в то время как при обнаружении плеврального экссудата, безусловно, нужна дополнительная диагностика.
Выпоты могут быть односторонними или двусторонними. Последние часто выявляются при сердечной недостаточности, но могут также возникать при гипопротеинемических состояниях и при коллагенозах с поражением сосудов. Имеют очень большое значение тщательный сбор анамнеза, включая профессию, данные о путешествиях за границу и о факторах риска тромбоэмболии, а также внимательное полноценное физикальное обследование.
При физикальном обследовании обнаруживается ограничение дыхательных движений грудной клетки, «каменная» тупость при перкуссии, приглушение дыхания при аускультации и часто — зона бронхиального дыхания сверху от уровня жидкости.
Небольшие выпоты следует дифференцировать с утолщением плевры. Помочь в этом может выполнение рентгенограммы в положении лежа (при этом жидкость движется под действием силы тяжести), а также ультразвуковое исследование (УЗИ) или рентгеновская компьютерная томография (КТ).
И УЗИ, и КТ являются ценными методами, которые все чаще используются для дифференциации между плевральной жидкостью, «окутанным» легким (плевральными бляшками, обычно возникающими при воздействии асбеста) и опухолью. Эти методы позволяют также выяснить, является ли плевральная жидкость осумкованной, и наметить оптимальное место для плевральной пункции и биопсии.
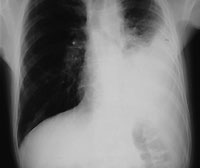 |
| Рисунок 1. Рентгенограмма органов грудной клетки: виден расширенный пищевод с уровнем жидкости и левосторонний плевральный выпот. Эти изменения были расценены как вторичная эмпиема, возникшая на фоне аспирационной пневмонии |
Плевральная пункция с аспирацией и биопсия показаны всем больным с выпотом, при этом удается получить гораздо больше диагностической информации, чем только при аспирации, и избежать проведения повторной инвазивной процедуры (см. рис. 1).
Другие исследования, помогающие в установлении диагноза, включают повторную рентгенографию органов грудной клетки после аспирации для выявления лежащей в основе выпота патологии легких, КТ, изотопное сканирование легких (с определением соотношения вентиляции и перфузии), внутрикожные пробы с туберкулином, серологические исследования на ревматоидные и антиядерные факторы.
Если вышеперечисленные методы не позволяют выявить причину возникновения плевральных выпотов, проводится торакоскопия с помощью видеотехники. Она позволяет не только осмотреть плевру, но также выявить опухолевые узлы и осуществить прицельную биопсию. Эта процедура наиболее ценна для диагностики мезотелиомы. Как бы то ни было, у 20% больных с экссудативными плевральными выпотами посредством обычных исследований не удается диагностировать причину развития данного состояния.
Лечение патологии, провоцирующей развитие плеврального выпота, например сердечной недостаточности или тромбоэмболии легочных артерий, часто приводит к его исчезновению. Некоторые состояния, включая эмпиему и злокачественные опухоли, требуют особых мер, о которых речь пойдет ниже.
Парапневмонические выпоты и эмпиема
Приблизительно у 40% больных с бактериальными пневмониями развивается сопутствующий плевральный выпот [11]; в таких случаях необходимо провести плевральную пункцию, чтобы удостовериться, что нет эмпиемы, и предотвратить либо уменьшить степень последующего утолщения плевры.
Однако у 15% пациентов парапневмонические выпоты вторично инфицируются, развивается эмпиема, то есть образуется гной в плевральной полости (см. рис. 2).
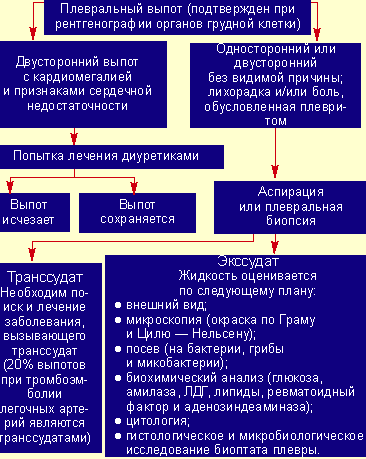 |
| Рисунок 2. Исследования при плевральном выпоте |
Другие причины эмпиемы включают хирургические вмешательства (20%), травмы (5%), перфорации пищевода (5%) и субдиафрагмальные инфекции (1%) [12].
 |
| Таблица 3. Микроорганизмы: возбудители эмпиемы |
При эмпиемах большая часть высеваемых культур представлена аэробными микроорганизмами. Анаэробные же бактерии высеваются в 15% случаев эмпием, обычно являющихся осложнением аспирационных пневмоний; остальные случаи обусловлены разнообразными другими микроорганизмами (см. табл. 3). Если до плевральной пункции назначались антибиотики, посевы часто не дают роста.
Диагноз подтверждается на основании рентгенологических признаков осумкованного плеврита или в случае обнаружения гноя в плевральном пунктате (см. табл. 2).
Кроме того, под контролем УЗИ или КТ следует наладить дренаж из наиболее низкой части эмпиемы и соединить его с подводным клапанным механизмом. В прошлом рекомендовалось использовать дренажи относительно большого диаметра, однако сегодня применение более узких трубок признано эффективным при меньшей травматичности для пациентов.
Рекомендации относительно целесообразности применения фибринолитиков основаны на результатах небольших неконтролированных исследований, согласно которым частота ликвидации спаек составила 60–95% [13, 14], а потребность в хирургических вмешательствах значительно уменьшилась. Тем, что до сих пор не проведено контролированных исследований, объясняется некоторая неопределенность относительно того, когда, как долго и в каких дозах следует применять фибринолитические препараты. В настоящее время под эгидой Совета медицинских исследований (Medical Research Council) проводится работа, результаты которой позволят ответить на эти вопросы.
Если в результате дренирования из межреберного доступа (с фибринолитиками или без них) не удается добиться адекватного отведения жидкости, если эмпиема сохраняется, организуется и сопровождается утолщением плевры и сдавлением легкого, то показано хирургическое вмешательство.
Торакоскопия обычно успешна на ранних стадиях заболевания, но при обширных плевральных спайках может окончиться неудачей. В этих случаях показана торакотомия и декортикация. Хотя такое хирургическое вмешательство высокоэффективно в отношении лечения эмпиемы (>90%), с ним связан существенный операционный риск, особенно у ослабленных больных.
Открытый дренаж, при котором требуется резекция ребра, — довольно малопривлекательная процедура, она проводится только в том случае, когда больной не может перенести более инвазивную операцию.
Без лечения эмпиема может прорваться наружу через грудную стенку («прободающая» эмпиема) или в бронхиальное дерево с образованием бронхоплеврального свища либо вызвать обширный плевральный фиброз, который ограничивает подвижность легких. К редким осложнениям относятся абсцесс головного мозга и амилоидоз, может также возникнуть деформация фаланг типа «барабанных палочек».
Поражение плевры при злокачественных новообразованиях
Рак легких — это наиболее частая причина возникновения злокачественного плеврального выпота, особенно у курильщиков. Лимфома может возникнуть в любом возрасте и составляет 10% от всех злокачественных выпотов. Метастазы в плевру наиболее часто встречаются при раках молочной железы (25%), яичников (5%) или желудочно-кишечного тракта (2%) (см. рис. 3). В 7% случаев первичная опухоль остается неизвестной.
Важно понимать, что при первичном бронхогенном раке наличие плеврального выпота не обязательно исключает операбельность. У 5% таких больных выпот развивается вследствие обструкции бронхов и дистальной инфекции, и заболевание остается потенциально излечимым.
Поэтому, когда встает вопрос о возможности проведения операции, чрезвычайно важно установить причину плеврального выпота.
Выпоты, обусловленные злокачественной инфильтрацией плевры, обычно быстро накапливаются вновь. Для того чтобы избежать необходимости проведения повторных плевральных пункций, выпот необходимо полностью («насухо») удалить при первичном дренировании через межреберную трубку, а плевральная полость должна быть облитерирована путем введения вызывающих воспаление препаратов, например талька, тетрациклина или блеомицина, при этом в конце концов развивается плевродез. В настоящее время наиболее эффективным средством в этом отношении считается тальк: при его применении успех достигается у 90% больных [17].
Однако эффективный плевродез приводит к значительному болевому синдрому в послеоперационном периоде, который часто требует применения сильных анальгетиков; рекомендуется при этом избегать нестероидных противовоспалительных препаратов, поскольку они снижают эффективность операции.
Непосредственная абразия плевры во время операции с плеврэктомией или без нее применяется у молодых пациентов с довольно длительным сроком выживания, у которых не удался химический плевродез.
При обширном, мучительном для больного плевральном выпоте и неэффективности химического плевродеза альтернативным методом является установка плевроперитонеального шунта по Denver. Удивительно то, что при такой операции не наблюдается обсеменения опухоли по брюшине, однако в реальную проблему могут вылиться развитие инфекции и окклюзия шунта.
Патология плевры, связанная с асбестом
В 2002 году в Великобритании смертность от мезотелиомы, согласно прогнозам, достигнет пика в 2020 году и составит 3000 [5].
В большинстве стран среди заболевших преобладают мужчины, что подтверждает ведущую роль профессионального фактора в развитии этого заболевания.
Возраст на момент контакта с асбестом, а также продолжительность и интенсивность этого контакта тоже имеют важное значение. Наибольшему риску подвергаются представители профессий, требующих непосредственного контакта с асбестом, особенно рабочие строительной индустрии, в то время как для людей, проживающих в зданиях, содержащих асбест, риск гораздо ниже.
Заболевание проявляется болями в груди и плевральным выпотом, который имеет кровянистую окраску и вызывает одышку. В Великобритании пациенты с этой болезнью имеют право на компенсацию, как и при других заболеваниях и увечьях, полученных на производстве (см. табл. 4).
Во всех случаях необходимо гистологическое исследование, в ходе которого используются либо материал, получаемый при аспирации плеврального содержимого и биопсии под контролем УЗИ (что позволяет подтвердить диагноз у 39% таких больных), либо ткань, взятая при торакоскопии (диагноз подтверждается у 98% пациентов) [6]. Торакоскопия также позволяет определить степень распространенности опухоли в плевральной полости, поскольку очень ограниченное заболевание на ранней стадии может быть излечено хирургическим путем, в то время как при поражении висцеральной плевры прогноз неблагоприятный.
После таких диагностических вмешательств часто наблюдается обсеменение опухоли по плевре, профилактика этого состояния предполагает облучение области биопсии или дренажа.
Большинство пациентов впервые поступают к врачу уже с неоперабельной опухолью. В такой ситуации ни один из методов не обеспечивает возможности излечения больного, однако сегодня проводятся попытки применения радикальной операции, фотодинамической терапии, внутриплевральной системной химиотерапии и лучевой терапии. И хотя генная терапия пока не приносит успеха, иммунотерапия может признана перспективной. Неблагоприятными диагностическими факторами являются: низкие функциональные резервы сердечно-сосудистой и дыхательной систем, лейкоцитоз, перерождение в саркому (по данным гистологического исследования) и мужской пол. В течение одного года выживают от 12 до 40% больных, в зависимости от перечисленных прогностических факторов.
Спонтанный пневмоторакс
Спонтанный пневмоторакс может быть первичным (без явного предшествующего заболевания легких) или вторичным (когда имеются признаки легочного заболевания, например легочного фиброза). К малораспространенным причинам пневмоторакса относятся: инфаркт легкого, рак легкого, ревматоидные узелки или абсцесс легкого с образованием полости. Субплевральные эмфизематозные буллы, обычно расположенные в области верхушек легкого, или плевральные буллы обнаруживаются у 48–79% больных с якобы спонтанным первичным пневмотораксом [18].
Среди курильщиков частота пневмоторакса гораздо выше. Относительный риск развития пневмоторакса в девять раз выше у женщин-курильщиц и в 22 раза — у курящих мужчин. Более того, выявлена зависимость «доза — эффект» между числом выкуренных за день сигарет и частотой пневмоторакса [19].
В диагностике небольших по объему, преимущественно верхушечных, пневмотораксов могут помочь снимки на выдохе, которые, однако, используются редко. Следует различать большие эмфизематозные буллы и пневмоторакс.
Алгоритм лечения представлен на рисунке 5. Чрескожная аспирация — это простая, хорошо переносимая, альтернативная по отношению к межреберному дренажу по трубке процедура, в большинстве случаев ей следует отдавать предпочтение. Аспирация позволяет достичь удовлетворительного расправления легкого у 70% больных с нормальной легочной функцией и только у 35% пациентов с хроническими заболеваниями легких [20].
Средняя частота рецидивов после единственного первичного спонтанного пневмоторакса, независимо от первичного лечения, составляет 30%, большинство их возникает в первые 6–24 месяцев.
Пациентов следует предупреждать о возможности развития повторных пневмотораксов: в частности, им не рекомендуется летать на самолетах в течение шести недель после полного разрешения пневмоторакса. Операция обычно требуется в тех случаях, когда в течение недели наблюдается упорное накопление воздуха.
Рецидивирующий пневмоторакс, особенно если поражены оба легких, следует лечить либо путем химического плевродеза или, что более предпочтительно, с помощью париетальной плеврэктомии либо плевральной абразии.
Последние из названных операций можно проводить с помощью торакоскопии под контролем видеоизображения, которая позволяет проследить за ходом процедуры с помощью монитора, сократить пребывание в стационаре и ускорить возвращение пациента к нормальному образу жизни. Хирургическое лечение позволяет уменьшить частоту рецидивов до 4% в сравнении с 8% после плевродеза тальком [22].
В представленной статье мы рассказали о нескольких аспектах, связанных с заболеваниями плевры, в том числе о последних достижениях в этой области. Плевральный выпот — это самое частое проявление патологии плевры, требующее тщательного обследования. Если после обычных методов исследования причина заболевания остается неясной, нужно предпринять все необходимые меры для исключения тромбоэмболии легочных артерий, туберкулеза, реакции на введение лекарств и поддиафрагмальных патологических процессов.
Хелен Парфри, бакалавр медицины, бакалавр химии, член Королевской коллегии врачей
Больница Западного Саффолка
Эдвин Р. Чайлверс, бакалавр медицины, бакалавр естественных наук, доктор философии, профессор
Кембриджский университет, Школа клинической медицины, отделение терапии больницы Адденбрука и Папворта
Синдром Дресслера (I24.1)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Этиология и патогенез
Этиологическим фактором СД может быть инфекция, в частности вирусная, поскольку у больных, у которых этот синдром развился после кардиохирургических вмешательств, часто регистрируют повышение титра противовирусных антител
Патологическая анатомия
Даже при тяжелом течении постинфарктный синдром не ведет к летальному исходу. Если же такие больные умирают от других осложнений острого ИМ, патологоанатомы обычно обнаруживают фибринозный, серозный или серозно-геморрагический перикардит. В отличие от эпистенокардического перикардита, воспаление перикарда при СД имеет диффузный характер
Эпидемиология
Признак распространенности: Редко
Клиническая картина
Клинические критерии диагностики
Cимптомы, течение
Классически синдром развивается на 2–4-й неделе ИМ, однако эти сроки могут уменьшаться – «ранний СД» и увеличиваться до нескольких месяцев, «поздний СД». Иногда течение СД принимает агрессивный и затяжной характер, он может длиться месяцы и годы, протекать с ремиссиями и обострениями
Основные клинические проявления синдрома: лихорадка, перикардит, плеврит, пневмонит и поражение суставов. Одновременное поражение перикарда, плевры и легких при постинфарктном синдроме наблюдается не часто. Чаще перикардит сочетается с плевритом или с пневмонитом. В ряде случаев имеет место только перикардит или плеврит, либо пневмонит.
Диагностика
Рентгенография. Обнаруживают скопление жидкости в плевральной полости, междолевой плеврит, расширение границ сердечной тени, очаговые тени в легких.
Лабораторная диагностика
У больных с СД регистрируются нормальные уровни маркеров повреждения миокарда (МВ-фракция креатинфосфокиназы (МВ-КФК), миоглобин, тропонины), хотя иногда отмечается их незначительное повышение, что требует проведения дифференциальной диагностики с рецидивом ИМ
Дифференциальный диагноз
Осложнения
Лечение
Антикоагулянты
Перикардиоцентез используют при тампонаде сердца
Перикардэктомия. Из-за угрозы усугубления или рецидива СД перикардэктомия применяется редко (при констриктивном перикардите)
Синдром Дресслера
Используйте навигацию по текущей странице

Частота развития
Первоначально считалось, что синдром Дресслера возникает примерно у 4% больных, перенесших инфаркт миокарда. C учетом атипичных и малосимптомных форм частота его развития значительно выше – 15–23 %, а по некоторым источникам достигает 30 %. Однако в последние годы частота синдрома Дресслера уменьшилась. Причинами могут быть широкое использование нестероидных противовоспалительных средств (ацетилсалициловой кислоты) и распространение реперфузионных методов лечения ИМ, уменьшающих объем повреждения мышцы сердца. Другой причиной снижения частоты развития синдрома Дресслера может быть включение в комплекс терапии инфаркт миокарда ингибиторов ангиотензинпревращающего фермента, антагонистов альдостерона и статинов, вследствие их иммуномодулирующего и противовоспалительного действия. Постинфарктый синдром развивается в подостром периоде (не ранее 10-го дня от момента заболевания) у 3—4 % пациентов, перенёсших инфаркт миокарда.
Причины развития
При постинфарктном синдроме антитела к тканям сердца обнаруживаются постоянно. При анализе субпопуляций лимфоцитов у пациентов с синдром Дресслера было обнаружено увеличение числа активированных CD8-позитивных клеток. При изучении активации комплемента было отмечено, что у пациентов с СД наблюдали повышенный уровень фракции C3d в сочетании с более низкой концентрацией С3. Кардиальные реактивные антитела, связываясь с циркулирующими кардиальными антигенами с формированием растворимых иммунных комплексов, могут фиксироваться в различных местах, приводя к комплементопосредованному повреждению ткани.
При постинфарктном синдроме наблюдаются изменения и в клеточном иммунитете. Так, имеются данные, что при синдроме Дресслера значительно повышен уровень цитотоксических T-клеток. Этиологическим фактором синдрома Дресслера может быть инфекция, в частности вирусная, поскольку у больных, у которых этот синдром развился после кардиохирургических вмешательств, часто регистрируют повышение титра противовирусных антител.
Симптомы и течение
Развивается на 2–4-й неделе инфаркта миокарда, однако эти сроки могут уменьшаться – «ранний синдром Дресслера» и увеличиваться до нескольких месяцев, «поздний синдром Дресслера». Иногда течение синдрома Дресслера принимает агрессивный и затяжной характер, он может длиться месяцы и годы, протекать с ремиссиями и обострениями. Основные клинические проявления синдрома: лихорадка, перикардит, плеврит, пневмонит и поражение суставов. Лихорадка при синдроме Дресслера не имеет какой-либо строгой закономерности. Как правило, она бывает субфебрильной, хотя в отдельных случаях может быть фебрильной или вообще отсутствовать.
Перикардит является обязательным элементом синдрома Дресслера. Клинически он проявляется болью в перикардиальной зоне, которая может иррадиировать в шею, плечо, спину, брюшную полость. Боль может быть острой приступообразной (плевритическая) или давящей, сжимающей (ишемической). Она может усиливаться при дыхании, кашле, глотании и ослабевать в вертикальном положении или лежа на животе. Она длительная и исчезает или ослабевает после появления в полости перикарда воспалительного экссудата. Главный аускультативный признак перикардита – шум трения перикарда: в первый день болезни при внимательной аускультации он определяется у абсолютного большинства (до 85 %) больных. Шум лучше всего выслушивается у левого края грудины, при задержке дыхания и наклоне туловища пациента вперед. В классическом варианте он состоит из трех компонентов – предсердного (определяется в систолу) и желудочкового (систолического и диастолического). Как и боль, шум трения перикарда уменьшается или исчезает вовсе после появления в полости перикарда выпота, раздвигающего трущиеся листки перикарда. Обычно перикардит протекает нетяжело: уже через несколько дней боли стихают, а экссудат в полости перикарда почти никогда не накапливается в таком количестве, чтобы ухудшить кровообращение, хотя иногда могут появиться признаки тяжелой тампонады сердца. Иногда воспалительный процесс в перикарде при синдроме Дресслера принимает затяжной рецидивирующий характер и заканчивается развитием констриктивного перикардита. При применении антикоагулянтов на фоне синдрома Дресслера возможно также развитие геморрагического перикардита, хотя подобное осложнение может быть и при отсутствии антикоагулянтной терапии.
Плеврит. Проявляется болью в боковых отделах грудной клетки, усиливающейся при дыхании, затруднением дыхания, шумом трения плевры, притуплением перкуторного звука. Он может быть сухим и экссудативным, односторонним и двусторонним. Нередко плеврит носит междолевой характер и не сопровождается типичными физикальными симптомами.
Пневмонит. Пневмонит при синдроме Дресслера выявляется реже, чем перикардит и плеврит. Если очаг воспаления достаточно велик, также отмечается притупление перкуторного звука, ослабленное или жесткое дыхание, появление фокуса мелкопузырчатых хрипов. Возможен кашель и выделение мокроты, иногда с примесью крови, что всегда вызывает определенные диагностические трудности.
Поражение суставов. Для синдрома Дресслера характерно появление так называемого «синдрома плеча»: болезненных ощущений в области плечелопаточных суставов, чаще слева, ограничение подвижности этих суставов. Вовлечение в процесс синовиальных оболочек нередко приводит к возникновению болей и в крупных суставах конечностей.
Другие проявления. Проявлением постинфарктного синдрома может быть сердечная недостаточность вследствие диастолической дисфункции, геморрагический васкулит и острый гломерулонефрит.
Методы исследования
Лабораторные данные. Часто отмечается повышение СОЭ и лейкоцитоз, а также эозинофилия. Весьма характерно резкое повышение уровня С-реактивного белка. У больных с синдромом Дресслера регистрируются нормальные уровни маркеров повреждения миокарда (МВ-фракция креатинфосфокиназы (МВ-КФК), миоглобин, тропонины), хотя иногда отмечается их незначительное повышение, что требует проведения дифференциальной диагностики с рецидивом инфаркта миокарда.
Электрокардиография (ЭКГ). При наличии перикардита на ЭКГ определяются диффузный подъем сегмента ST и, периодически, депрессия сегмента PR, за исключением отведения aVR, в котором наблюдаются депрессия ST и подъем PR. По мере накопления экссудата в полости перикарда может снизиться амплитуда комплекса QRS.
Эхокардиография. При накоплении жидкости в полости перикарда выявляется сепарация его листков и могут появиться признаки тампонады сердца. Для синдрома Дресслера не характерен большой объем жидкости в полости перикарда – как правило, сепарация листков перикарда не достигает 10 мм в диастолу.
Рентгенография. Обнаруживают скопление жидкости в плевральной полости, междолевой плеврит, расширение границ сердечной тени, очаговые тени в легких.
Компьютерная или магнитнорезонансная томография также выявляют жидкость в полости плевры или перикарда и легочную инфильтрацию.
Плевральная и перикардиальная пункция. Извлеченный из полости плевры или перикарда экссудат может быть серозным или серозно-геморрагическим. При лабораторном исследовании в нем определяется эозинофилия, лейкоцитоз и высокий уровень С-реактивного белка.
Лечение
Нестероидные противовоспалительные препараты (НПВС). Препаратом выбора при синдроме Дресслера традиционно считается ибупрофен (400– 800 мг/сут). Реже используют аспирин. Хирургическое лечение применяется при констриктивном перикардите.
Осложнения
Тампонада сердца, геморрагический или констриктивный перикардит, окклюзия (сдавление) коронарного шунта и редко – анемия.
Прогноз
Прогноз при синдроме Дресслера, как правило, благоприятный. Вместе с тем его течение иногда принимает затяжной рецидивирующий характер. Кроме того, имеются данные о том, что выживаемость в течение 5 лет среди перенесших этот синдром, хотя и незначительно, но снижается.