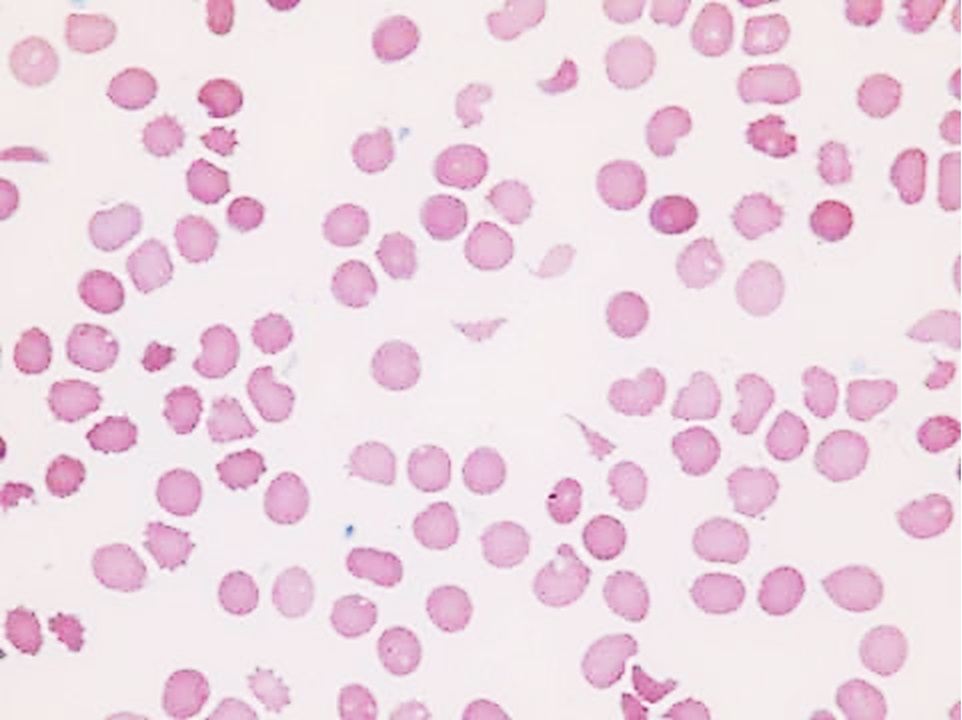
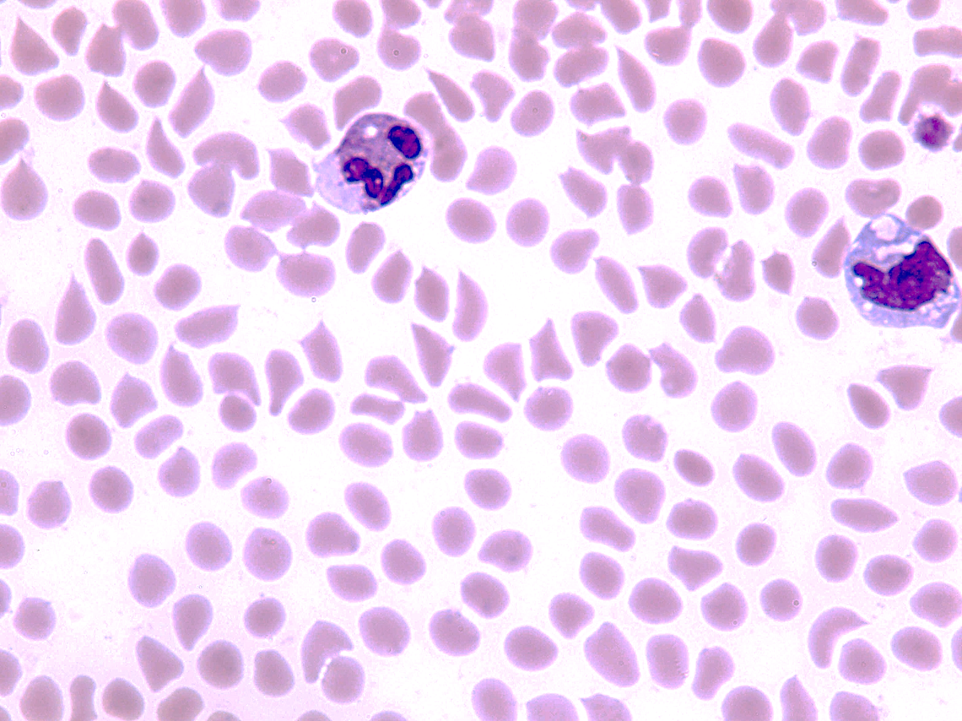
Шизоциты в крови что это значит у женщин
Тромботическая микроангиопатия в акушерстве
Введение
Преэклампсия и HELLP-синдром являются грозным осложнением беременности. В настоящее время они рассматриваются как варианты тромботической микроангиопатии (ТМА). Наиболее грозным представителем ТМА является атипичный гемолитико-уремический синдром (аГУС), к развитию которого предрасполагают генетические аномалии в системе иммунитета. Установлено, что беременность сама по себе может активировать патологический иммунный ответ, причем выраженность активации возрастает при наличии акушерских осложнений, достигая максимума у пациенток с преэклампсией. Генетический дефект в сочетании с преэклампсией приводит к неконтролируемой активации иммунного ответа, являющегося при акушерском аГУС основой развития полиорганной недостаточности, которая не может быть устранена без специфического лечения.
Критерии диагноза ТМА
ТМА представляет собой синдром, в основе которого лежит повреждение эндотелия сосудов микроциркуляторного русла (МЦР) различными способами, но имеющий сходные проявления и диагностические признаки. Результатом эндотелиального повреждения служит тромботическая микроангиопатия — особый тип поражения мелких сосудов, представленный их тромбозом и воспалением сосудистой стенки.
Морфологическая картина ТМА: отек эндотелиальных клеток, их отслойка от базальной мембраны (эндотелиоз), некроз, деструкция, расширение субэндотелиального пространства, тромбы в просвете капилляров и артериол, содержащие тромбоциты и фибрин, нередко с полной окклюзией просвета сосудов.
Клинико-лабораторные признаки ТМА:
Тромботические микроангиопатии классифицируют на первичные и вторичные.
Вторичные ТМА вследствие следующих состояний:
Критерии диагноза аГУС в акушерстве
Диагноз аГУС в акушерстве — это диагноз исключения. Дифференциальная диагностика с другими формами ТМА приведена в табл. 1.
Положительный результат при бактериологическом исследовании кала: посев на среду для выявления STEC (Mac Conkey для 0157:Н7), определение в образцах фекалий ДНК энтеро-геморрагических E.coli методом ПЦР; выявление в сыворотке антител к липополисахаридам наиболее распространенных в данном регионе серотипов E.coli.
Наследственная или приобретенная ТТП
Дефицит ADAMTS-13 — активность менее 10%, антитела к ADAMTS-13
Беременность. Исключить преэклампсию и HELLP-синдром
Ферменты печени, срок гестации, критерии преэклампсии и тяжелой преэклампсии, положительная динамика непосредственно после родоразрешения
Аутоиммунные заболевания (системная красная волчанка, антифосфолипидный синдром)
Анти-ДНК-антитела, антинуклеарные антитела, антитела к кардиолипину IgG и/или IgM изотипов, антитела к (32 GP 1 IgG и/или IgM изотипов с помощью стандартизованного иммуноферментного метода, волчаночный антикоагулянт стандартизованным коагулологическим методом
Положительные результаты иммунного блоттинга на ВИЧ- инфекцию
Наличие очага инфекции и полиорганной недостаточности (острое изменение по шкале SOFA >2 баллов)|
Генетическое исследование и биопсия почки не являются необходимыми для установления диагноза аГУС и не играют роли для решения вопроса о тактике лечения больного.
Преэклампсия и HELLP-синдром являются специфическими ассоциированными с беременностью формами ТМА. Всем пациенткам, госпитализированным с диагнозом тяжелая преэклампсия и/или HELLP-синдром, необходимо до родоразрешения исследовать ЛДГ, гаптоглобин в сыворотке крови и шизоциты в мазке периферической крови, а также определить количество тромбоцитов и уровень креатинина.
Истинные тяжелая преэклампсия и HELLP-синдром требуют родоразрешения с целью элиминации секретирующегося анти-ангиогенного фактора sFlt-1 плаценты.
Поскольку термин «HELLP-синдром» — собирательное понятие и его причины до конца не выяснены, тактика родоразрешения и интенсивной терапии строится в соответствии с тактикой при тяжелой преэклампсии (родоразрешение). В этом случае диагноз формулируется в соответствии с МКБ Х — «Тромботическая микроангиопатия (HELLP-синдром)».
Принципы и схемы терапии
При развитии клиники HELLP-синдрома в послеродовом периоде необходимо строить тактику интенсивной терапии в зависимости от следующих клинических вариантов:
Вариант 1. У пациентки сохранены: сознание, диурез более 0,5 мл/кг/ч (вне зависимости от цвета мочи), стабильная гемодинамика (или с тенденцией к артериальной гипертензии), отсутствует геморрагический синдром любой локализации. При лабораторном исследовании выявлены тромбоцитопения, повышены уровни АСТ, АЛТ, ЛДГ, массивного внутрисосудистого гемолиза нет. Плазменные факторы свертывания в норме. В данном случае, в течение суток оценивается динамика клинико-лабораторных
проявлений HELLP-синдрома и при отсутствии отрицательных проявлений интенсивная терапия ограничивается базовой терапией преэклампсии и инфузией кристаллоидов Пациентка получает нутритивную поддержку и активизируется. Проводится тромбопрофилактика НМГ при количестве тромбоцитов более 70000 в мкл.
Вариант 2. Уже с первых часов после родоразрешения развивается клиника острой печеночной недостаточности (тромбоцитопения, рост АСТ, АЛТ, коагулопатия, кровотечение, шок, ОПН, ОРДС и т.д.), в основе, которой лежит некроз печени (подкапсульная гематома). Требует проведения комплексной посиндромной интенсивной терапии острой печеночной недостаточности в условиях многопрофильного ЛПУ с возможностью хирургического лечения.
Вариант 3. Развитие массивного внутрисосудистого гемолиза (свободный гемоглобин в крови и моче, анемия) уже в первые часы осложняется развитием ОПН (по шкалам RIFLE, AKIN, KDIGO) и требует проведения заместительной почечной терапии. Противопоказано применение магния сульфата и инфузионной терапии. Требует проведения комплексной посиндромной интенсивной терапии ОПН в условиях многопрофильного ЛПУ. При сохранении или прогрессировании симптомов ТМА (тромбоцитопения и МАГА) в течение 48 часов следует, как один из вероятных диагнозов рассматривать аГУС и проводить соответствующую терапию.
Вариант 4. В исключительных случаях верификации диагноза ТТП в послеродовом периоде на основании сочетания признаков HELLP-синдрома, нарастающей тромбоцитопении, симптомов поражения почек и/или ЦНС со снижением активности ADAMTS-13 менее 10% показана инфузия свежезамороженной плазмы и проведение плазмообмена«.
Вариант 5. Женщинам, перенесшим акушерскую ТМА (преэклампсия, HELLP-синдром), следует устанавливать диагноз аГУС, если после родоразрешения их состояние не улучшается или ухудшается, в короткие сроки приводя к формированию
полиорганной недостаточности, что свидетельствует о персистировании ТМА с генерализацией микроангиопатического процесса.
В первую очередь о возможном аГУС следует думать при развитии тяжелого HELLP-синдрома с признаками внепеченочного поражения, особенно если родоразрешение не сопровождается положительной динамикой состояния пациентки, несмотря на лечение в соответствии с клиническими рекомендациями (протоколом лечения) МЗ РФ «Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия» 2016 г. Быстрое нарастание анемии при отсутствии выраженной кровопотери свидетельствует об усилении микроангиопатического гемолиза, что, как правило, сопровождается усугублением тромбоцитопении и стремительным ухудшением функции почек, приводящим к развитию олигурической.
Родильницам с установленным диагнозом аГУС следует назначать патогенетическую терапию, направленную на блокирование С5-компонента системы комплемента, играющего ключевую роль в развитии данного осложнения. Антикомплементарная терапия проводится согласно рекомендациям по лечению аГУС взрослых.
Экулизумаб — рекомбинантное гуманизированное моноклональное антитело класса Ig G к С5 компоненту комплемента. Препарат блокирует расщепление С5, препятствуя образованию мембрано-атакующего комплекса и предотвращая тем самым повреждение эндотелия и, следовательно, прекращая процессы микроциркуляторного тромбообразования. Применение Экулизумаба приводит к обратному развитию ТМА и/или предупреждает прогрессирование поражения почек. Критериями эффективности терапии Экулизумабом являются прекращение микроангиопатического гемолиза (снижение уровня ЛДГ до нормальных значений) и нормализация числа тромбоцитов, а также улучшение функции почек.
Начальный курс терапии Экулизумабом рассчитан на 5 недель, далее подразумевается переход на цикл поддерживающего лечения.
Индукционный курс: 1 раз в неделю вводят по 900 мг Экулизумаба на протяжении недель. На пятой неделе дозу увеличивают до 1200 мг.
Поддерживающий этап: каждые 14 (плюс/минус 2 дня) дней вводят по 1200 мг.
В ожидании Экулизумаба родильницы с установленным диагнозом аГУС должны получать в случае необходимости почечную заместительную терапию при наличии ОПН. Свежезамороженная плазма в больших объемах у пациенток с тяжелой преэклампсией может вызвать перегрузку объемом (TACO-синдром) или развитие иммунного TRALI-синдрома и в отсутствие клинических проявлений коаулопатии и кровотечения противопоказана! Свежезамороженная плазма применяется только при верификации диагноза ТТП.
Состояние здоровья человека напрямую зависит от количества данных форменных элементов. Для того чтобы определить их количество, назначают общий анализ крови. С помощью полученных результатов можно наблюдать течение болезни и характер воспалительных процессов, которые могут протекать в организме. Также общий анализ крови назначают при появлении таких симптомов, как усталость, постоянные головные и мышечные боли, утомляемость.
Для чего назначают общий анализ крови?
Кровь в организме человека выполняет ряд важных функций, поэтому ее состав очень информативен при диагностике возможных заболеваний. Чаще всего во время планового обследования назначается общий анализ крови. При подозрительных результатах назначается развернутый биохимический анализ.
Процедура сдачи общего анализа крови
Перед визитом в клинику не рекомендовано принимать пищу. Также в течение нескольких дней следует прекратить прием медикаментов (только по рекомендации врача). Процедура проводится утром. Забор крови делают из пальца или вены.
Таблица – Нормы общего анализа крови для взрослых
Из таблицы выше следует что, нормы анализа крови у мужчин и женщин отличаются. Во время беременности также изменяются показатели анализа крови.
Гемоглобин
Гемоглобин – это белок, в составе которого имеются ионы железа. Он отвечает за дыхательную функцию крови и производит газообмен между клетками организма.
Если у человека обезвоживание организма, сердечная недостаточность; имеются проблемы с пищеварением, вследствие чего была рвота и диарея – то анализ покажет пониженный уровень гемоглобина.
При повышенном уровне речь идет о закупорке сосудов за счет того, что кровь становится гуще. Из-за этого образуются тромбы, что повышает риск развития сердечно-сосудистых заболеваний.
После рассмотрения результатов анализов должно быть подобрано соответствующее лечение для улучшения показателей. Самолечение в данном случае недопустимо.
Эритроциты
Если человек испытывает стресс, сидит на изнуряющих диетах, которые сочетаются с высокими физическими нагрузками, то уровень эритроцитов будет понижен.
Для коррекции происходящих в организме нарушений назначаются лекарства. Препарат должен быть подобран врачом с учетом результатов проведенных исследований и особенностей организма пациента.
Если при расшифровке биохимического анализа крови СОЭ выше нормы, то это говорит о том, что в организме идут инфекционные и воспалительные процессы, также возможны онкологические заболевания.
Снижение уровня СОЭ свидетельствует о болезнях, сопровождающиеся изменениями формы эритроцитов, например серповидно-клеточная анемия.
Лейкоциты
В норме общее количество лейкоцитов в крови находится в диапазоне 4х109/л до 1,1х1010 /л. Лейкоциты – это форменные элементы крови. Если количество выше нормы, то это указывает на то, что в организме происходит воспалительный процесс. Причины повышения лейкоцитов могут быть следующие: острые инфекции, онкологические заболевания, острое и хроническое воспаление.
Чтобы осуществить подсчет процентного соотношения лейкоцитов разных видов в лабораторной диагностике используют лейкоцитарную формулу. Если из результатов биохимического анализа крови видно, что идет сдвиг лейкоцитарной формулы влево, это значит, что в крови находятся незрелые нейтрофилы. Хотя в норме они должны быть только в костном мозге.
Тромбоциты
Образование тромбоцитов идет в красном костном мозге. Норма у женщин составляет 170,0-320,0х109/л и у мужчин 180,0-320,0х109/л.Туберкулез, рак печени и почек, острые инфекции, отравления, стресс провоцируют повышенное содержание тромбоцитов при расшифровке общего анализа крови.
Пониженное содержание тромбоцитов при расшифровке анализа наблюдается при частом приеме лекарственных препаратов. Низкий уровень тромбоцитов наблюдается также у людей, страдающих алкоголизмом. Если при расшифровке показателей анализа у женщин наблюдается низкий уровень тромбоцитов, то это может говорить о затяжных менструациях.
Гематокрит
При расшифровке биохимического анализа крови особое место выделяют такому показателю, как гематокрит. Он указывает на отношение объема клеток крови к общему объему крови и выражается в процентах.
У женщин низкий уровень гематокрита может говорить о наступлении беременности. Биохимические исследования крови являются важным показателем при установке диагноза пациента и назначении лечения. Сдавать общий анализ крови рекомендовано не только при возникновении недомоганий, но и в целях диагностики организма на отсутствие болезней.
Интерпретация полученных результатов проводится на приеме у врача, который назначил анализ. Специалист учитывает половую принадлежность и возраст пациента. На основании полученных данных врач разрабатывает индивидуальную схему лечения.
Самостоятельная расшифровка полученных результатов может привести к получению ложного представления о диагнозе. Без определенных знаний невозможно определить состояние здоровья даже при наличии результатов анализа крови. Доверяйте расшифровку результатов лабораторных исследований опытным специалистам.
Шизоциты и шизоцитоз
Данное сообщение является кратким изложением статьи «ГЕМОЛИТИЧЕСКАЯ АНЕМИЯ, ВЫЗВАННАЯ ФРАГМЕНТАЦИЕЙ ЭРИТРОЦИТОВ. Филатов Л. Б., Томилов А. Ф., Алексеева Т. А.
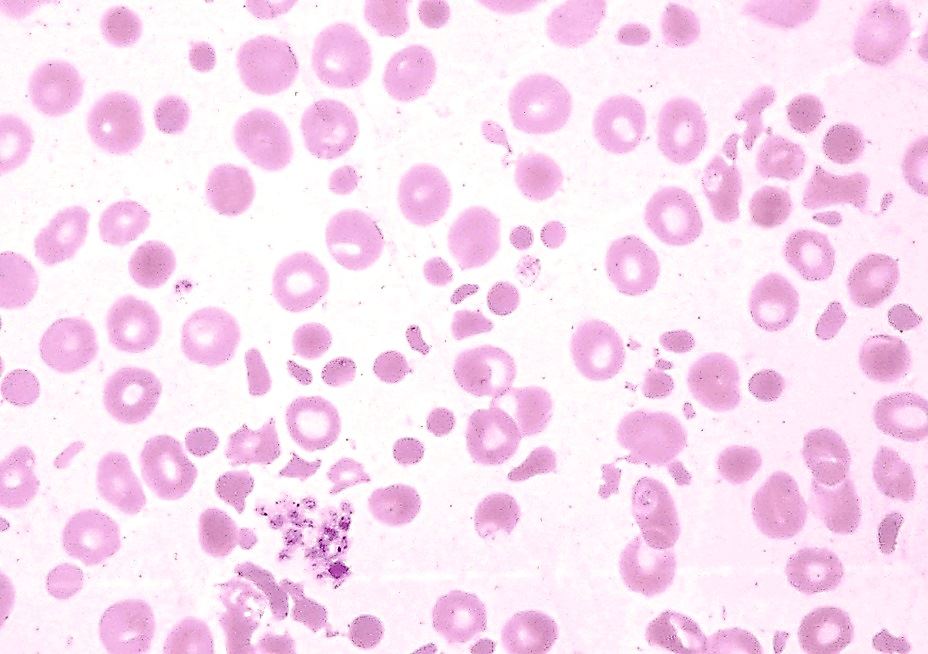
Диагностическим критерием гемолитической анемии, вызванной фрагментацией эритроцитов, служит шистоцитоз в мазке крови. Распознавание шистоцитов в мазке крови сопряжено с серьезными трудностями. В качестве признаков шистоцита рассматривается наличие не менее двух углов и линия, указывающая на разлом. Наиболее типичные формы шистоцита: шлем, полумесяц, треугольник. Не следует считать шистоцитами фрагменты в виде запятой, палочки, а также «надкусанные» эритроциты. Эритроциты могут фрагментироваться нитями фибрина, на тромбоцитарных агрегатах в микрососудах, протезами клапана сердца и т. д. В зависимости от места фрагментации эритроцитов гемолитические анемии делятся на микроангиопатические и макроангиопатические. Шистоциты могут обнаруживаться при различных заболеваниях, но лишь некоторые из них представляются угрожающими жизни и нуждаются в срочной диагностике — это тромботические микроангиопатии (тромботическая тромбоцитопеническая пурпура, гемолитико-уремический синдром, HELLP-синдром), требующие незамедлительной терапии. Игнорирование шистоцитов в мазке крови препятствует диагностике этих заболеваний, приводя к тяжелым последствиям для больных. Выявленный шистоцитоз, будучи краеугольным камнем в диагностике ряда тяжелых заболеваний, требует от врача-лаборанта и врачаклинициста быстрых действий по установлению диагноза.
Что такое шизоцит? Schistocyte, или schizocyte (от греч. Schistos – разделить и kytos – клетка) – фрагмент эритроцита в мазках крови.
В мазках крови могут встречаться фрагменты эритроцитов различной формы. Чтобы назвать фрагмент эритроцита шизоцитом, необходимо наличие нескольких морфологических признаков (рис.1,2).
Первое – это линия разлома, которая может быть прямой, дугообразной или неправильной;
второе – наличие у фрагмента не менее двух углов, которые могут быть закруглёнными; более того, при хорошей пластичности и репарации мембраны, фрагмент может превратиться в микросфероцит (см.рис.2). Важно отличать микросфероцит, объём которого существенно меньше объёма нормоцита, от сфероцита, типичного для наследственной сфероцитарной и некоторых аутоиммунных гемолитических анемий, когда диаметр эритроцита уменьшен, но объём его нормальный.
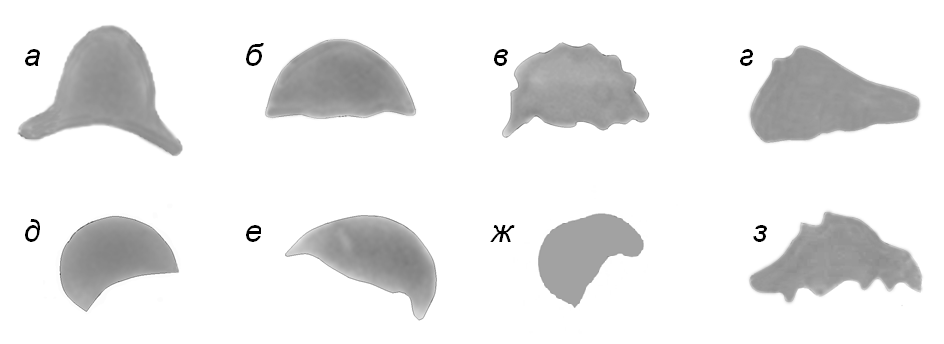
Рис. 1. Различные формы шизоцитов: а – шляпа Наполеона, б,в – каска, г,з – треугольник, д,е,ж – полумесяц, в,з – каска и треугольник с зазубренным контуром (дефект фиксации и окраски).
Есть ли норма для количества шизоцитов?
Единичные шизоциты встречаются в мазках крови многих пациентов, и их не следует принимать во внимание. Нижней границы нормы можно считать 0,2% (некоторые считают 0,27%). Lesesve, Salignac и Lecompte (2007) нашли максимальный уровень 0.19% у 119 в группе здоровых людей.
Burns, Lou and Pathak (2004) нашли верхний предел 0.2% у здоровых людей, 0.6% ‒ у пациентов с почечной недостаточностью, 0.45% ‒ у женщин в преэклампсии, 0.48% ‒ у пациентов с нормально функционирующими протезными клапанами сердца; они также нашли шизоциты у всех шести пациентов с тромботичесской тромбоцитопенической пурпурой (ТТП, болезнь Мошковица) с диапазоном 1.1-9.4%.
Фрагменты эритроцитов часто встречаются у родившихся в срок новорождённых (1,4–1,9%) и ещё чаще у недоношенных (4.9–5.5%).
Шизоцитоз
Шизоцитозом называют увеличенное количества шизоцитов при условии, что это не входит в комплексное изменение размера и формы эритроцитов, т.е. отсутствует (или почти отсутствует) смешанный анизопойкилоцитоз. Факт обнаружения шизоцитоза лаборант не только вписывает в бланк анализа, но и немедленно сообщает об этом лечащему врачу, т.к. в ряде случаев пациенту бывает нужна неотложная помощь.
Причины шизоцитоза и механизм образования шизоцитов
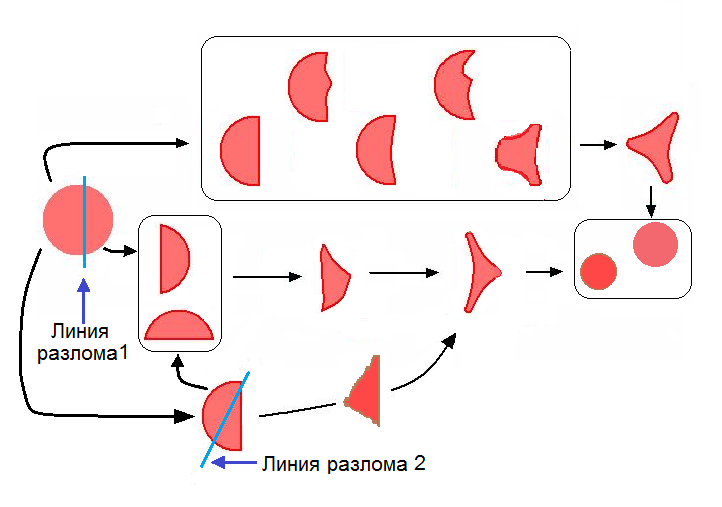
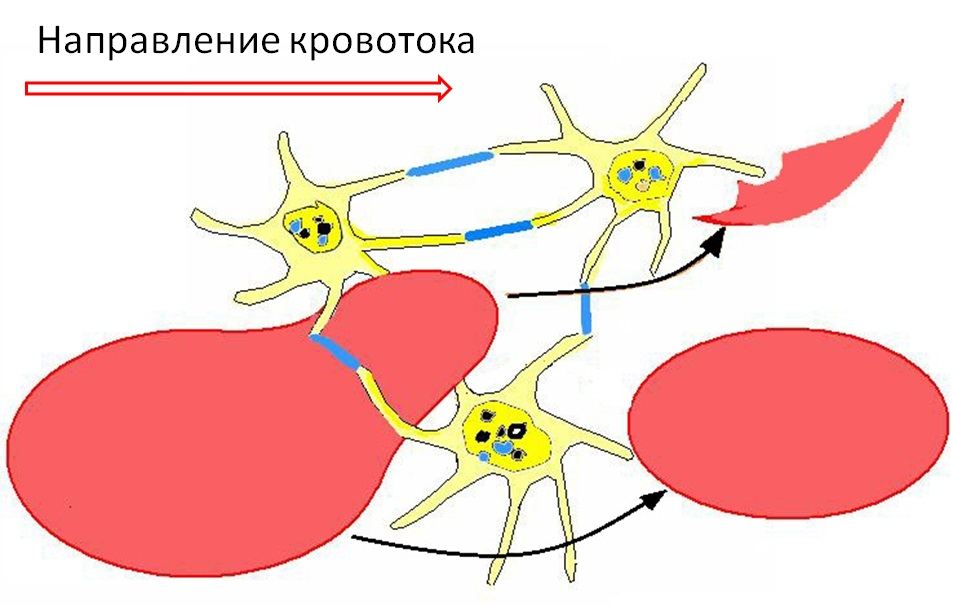
Появление шизоцитоза может указывать на внутреннюю ненормальность эритроцитов, что вызывает их фрагментацию. Но шизоцитоз чаще возникает в результате нахождения крови в ненормальных условиях, таких как термическая или механическая травма, а также от разрезания эритроцитов нитями фибрина (рис.2,3) или от соприкосновения эритроцитов с поврежденным эндотелием или протезом (стент, клапан) при большой скорости кровотока.
Рис. 2. Схема образования шизоцитов и микросфероцитов
Рис. 3. Схема образования шизоцитов при агрегации тромбоцитов в сосудистом русле. Псевдоподиеподобные выпячивания активированных тромбоцитов соединяются молекулами фибрина (обозначены синим цветом), образуя сеть (рыхлый тромбоцитарный тромб), проходя через которую эритроциты фрагментируются.
При фрагментации эритроцитов в микроциркуляторном русле с развитием анемии, используется термин микроангиопатическая гемолитическая анемия (МАГА).
Основные причины шизоцитоза
Травматическая гемолитическая анемия. Она может развиться у пациентов с патологией сердца и крупных сосудов:
Микроангиопатическиая гемолитическая анемия. Она возможна при следующей патологии:
‒ тромботическая тромбоцитопеническая пурпура;
‒ гемолитико-уремический синдром (ГУС и атипияный ГУС);
Есть ли шизоцитоз в исследуемом мазке крови?
Для ответа на этот вопрос, надо просматривать мазок при среднем увеличении (от 200х до 400х), обращая внимание на наличие типичных форм: шляпы Наполеона (рис.1а), клеток в форме каски или полумесяца (см. рис.1 б,в,д,е,ж) и треугольных клеток (рис.1 г,з). Если такие формы эритроцитов легко обнаруживаются, а смешанный анизопойкилоцитоз отсутствует, наличие микросфероцитов также учитывается как проявление шизоцитоза.
Количественный анализ на шизоцитоз проводится по запросу лечащего врача. Поиск шизоцитов должен проводиться на правильно сделанном мазке в области однородного распределения без перекрывания клеток. Эта область очень ограничена, но абсолютно необходимо придерживаться её. Не надо проводить исследование в самом начале (пятке) мазка, по его краям, а также в «усиках» и близко к ним.
Количественный ответ выражают в процентах, просматривая минимум 1000 (до 5000) эритроцитов. Точность повышается при увеличении количества подсчитанных эритроцитов. Если количественные данные требуются в динамике ведения больных с выявленной МАГА, с целью минимизации ошибки рекомендуется пересчет тем же лаборантом или подсчет двумя лаборантами.
Рис. 4. Пиропойкилоцитоз
Рис. 5. Шизоцитоз при параклапанной фистуле после
Рис. 6. Ложный шизоцитоз. По форме многие эритроциты выглядят как каски, полулуния и треугольники, однако их контуры конгруэнтны контурам рядом лежащих эритроцитов – налицо простая деформация.
Обнаружение большого количества шизоцитов в качестве изолированного проявления пойкилоцитоза необходимо подтвердить наличием внутрисосудистого гемолиза (повышение ЛДГ, свободного гемоглобина плазмы крови, наличие гемосидерина в моче, снижение гаптоглобина плазмы) и признаков активации эритропоээза (ретикулоцитоз, иногда нормобластоз в крови), а также исключить его аутоиммуную природу. Повышения количества непрямого билирубина часто не бывает.
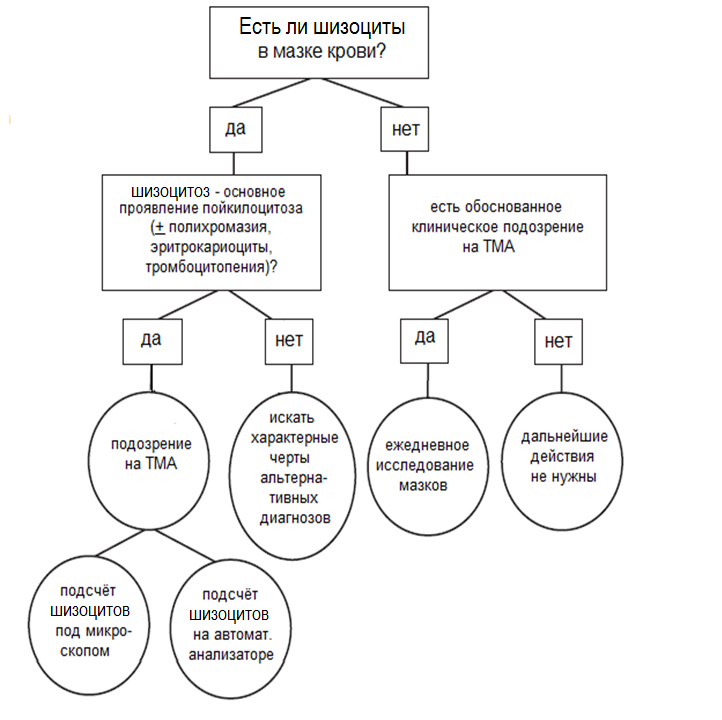
Рис. 7. Схема действий врача при подозрении на болезни или синдромы, протекающие с шизоцитозом.
Диагностика и лечение хронической аутоиммунной гемолитической анемии
Больная Ш., 80 лет, пенсионерка. Из анамнеза известно, что в течение последних двух лет неоднократно проходила амбулаторное и стационарное лечение по поводу хронической B12–фолиеводефицитной анемии, диагностированной на основании анемического синдрома в сочетании с гиперхромией и макроцитозом эритроцитов. Стернальная пункция, определение уровня витамина B12 и фолиевой кислоты не проводились. Отмечался временный незначительный положительный эффект лечения витамином B12. С конца 2011 года, несмотря на ежемесячное введение витамина B12 в дозе 500γ в сочетании с фолиевой кислотой, стала нарастать анемия (14.02.2012 г. гемоглобин – 54 г/л). Для обследования и лечения госпитализирована в больницу № 40 с диагнозом: B12–фолиеводефицитная анемия тяжелой степени. ИБС. Стенокардия напряжения II ф. к. Гипертоническая болезнь II ст. Желчнокаменная болезнь. Хронический калькулезный холецистит. Мочекаменная болезнь. Конкремент правой почки, простые кисты обеих почек. Полипы желудка.
При поступлении жалобы на выраженную общую слабость, головокружения, головную боль, учащенное сердцебиение, перебои в работе сердца.
При объективном осмотре отмечены субиктеричность кожи и слизистых оболочек, умеренная гепатомегалия (+2 см) и спленомегалия (+ 2 см).
Результаты клинического анализа в динамике представлены в таблице 1.
Таблица 1. Клинические анализы крови пациентки Ш. в динамике
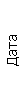 | 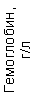 | 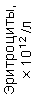 | 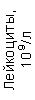 | 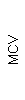 | 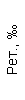 |  | 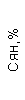 | 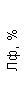 | 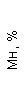 | 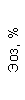 | 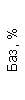 | 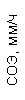 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 15.02.12 | 54 | 1.39 | 10.5 | 133 | 80 | 2 | 66 | 21 | 9 | 2 | — | 75 |
| 11.03.12 | 50 | 1.41 | 11.8 | 114 | 98 | 4 | 75 | 11 | 4 | 3 | 1 | 78 |
| 15.03.12 | 49 | 1.31 | 17.8 | 121 | 288 | 4* | 60 | 23 | 5 | 1 | — | 78 |
| 20.03.12 | 72 | 1.93 | 11.4 | 116 | 297 | 2 | 73 | 14 | 7 | 2 | 0 | 46 |
| 27.03.12 | 66 | 1.9 | 11 | 108 | 202 | 2 | 60 | 26 | 7 | 3 | 0 | 40 |
| 12.04.12 | 70 | 1.75 | 1.9 | 112 | 104 | 3 | 62 | 24 | 11 | 0 | 0 | 27 |
| 26.04.12 | 93 | 2.56 | 5.7 | 109 | 148 | 3 | 74 | 13 | 9 | 0 | 0 | 11 |
| 24.06.12 | 111 | 3.42 | 4.7 | 97 | 7 | 2 | 69 | 21 | 10 | 0 | 1 | 15 |
| 16.08.12 | 120 | 3.97 | 5.8 | 93 | 12 | — | 71 | 19 | 9 | 1 | 0 | 40 |
Примечание: * в лейкоцитарной формуле 15.03.12 выявлялись также миелоциты (2%) и метамиелоциты (5%).
В биохимическом анализе крови – повышение уровня креатинина (189 ммоль/л), билирубина (58 ммоль/л) за счет непрямого билирубина.
УЗИ органов брюшной полости: гепатоспленомегалия; камни желчного пузыря; диффузные изменения поджелудочной железы; простые кисты обеих почек, конкремент правой почки.
ФГДС: два полипа желудка размером до 0,5 см.
Учитывая высокий риск сердечно-сосудистых осложнений у пожилой пациентки с анемией тяжелой степени, проведены трансфузии эритроцитарной взвеси. На основании клинико-лабораторных данных (спленомегалия, гипербилирубинемия, гиперхромная анемия с ретикулоцитозом) и неэффективности лечения витамином B12 и фолиевой кислотой заподозрена гемолитическая анемия.
При исследовании крови на антиэритроцитарные антитела выявлены аутоантитела класса IgG ++++.
Результаты стернальной пункции представлены в таблице 2.
Таблица 2.Миелограмма пациентки Ш. от 17.02.12 г.
Заключение
Клеточный костномозговой пунктат. Эритропоэз – нормобластический. Гиперплазия эритроидного ростка – 74,8%. Со стороны эритрокариоцитов отмечаются клетки с цитоплазматическими мостиками, скопления в виде «эритроидных островков».
Мегакариоциты различной степени зрелости с умеренным тромбоцитообразованием.
На основании данных миелограммы (гиперплазия эритроидного ростка при нормобластическом типе кроветворения) и выявления антиэритроцитарных антител диагностирована аутоимунная гемолитическая анемия с тепловыми антителами. При дополнительном обследовании признаков вторичного характера анемии не выявлено.
С 11.03.12 г. начата пульс-терапия метипреднизолоном в дозе 500 мг 1 раз в день внутривенно в сочетании с пероральным приемом преднизолона в дозе 45 мг в сутки под прикрытием гастропротекторов. После 5 дней лечения анемический синдром продолжал нарастать, появился выраженный сдвиг лейкоцитарной формулы влево, увеличение количества ретикулоцитов (табл.1). Доза преднизолона перорально увеличена до 75 мг в сутки, к лечению добавлен азатиоприн по 100 мг/сутки per os, проведена трансфузия1 дозы эритроцитарной взвеси.
С 20.03.12 г. с учетом сохраняющегося гемолиза (ретикулоциты 297‰) проведен второй курс пульс-терапии метилпреднизолоном в дозе 500 мг в сутки № 4, однократно введен внутривенно циклофосфан в дозе 600 мг.
Лечение больная переносила хорошо. С 27.03.12 г. отмечена тенденция к увеличению уровня гемоглобина без поддерживающих гемотрансфузий. Решено продолжить введение циклофосфана по 200 мг в сутки, отменить азатиоприн. Анемический синдром продолжал уменьшаться: к 12.04.12 г. уровень гемоглобина достиг 70 г/л, снизился гемолиз (ретикулоцитов 104‰), однако развилась лейкопения (1,9×10 9 /л), в связи с чем циклофосфан был временно отменен. После восстановления количества лейкоцитов лечение циклофосфаном по 200 мг дважды в неделю было возобновлено на фоне постепенного снижения дозы преднизолона.
Больная в удовлетворительном состоянии 28.04.12 г. выписана из стационара. На амбулаторном этапе продолжено введение циклофосфана по 200 мг в сутки 2 раза в неделю, преднизолон в течение месяца полностью отменен.
В течение нескольких месяцев получала поддерживающую терапию циклофосфаном по 200 мг в сутки 2 раза в неделю (суммарная доза составила 7200 мг). На этом фоне уровень гемоглобина стабилен в пределах 100–120 г/л, количество ретикулоцитов не превышает 20%.
Комментарий к клиническому случаю
Аутоиммунная гемолитическая анемия (АИГА) – гетерогенная группа заболеваний и синдромов, обусловленных повышенным разрушением эритроцитов вследствие образования аутоантител. Частота АИГА во всех возрастных группах составляет 1:40000 – 1:80000, причем женщины болеют в 2 раза чаще мужчин. Выделяют первичные (идиопатические) и вторичные АИГА, которые чаще всего развиваются при лимфомах, солидных опухолях и заболеваниях соединительной ткани. По серологическим свойствам различают АИГА с тепловыми (85%) и холодовыми (15%) антителами; по месту разрушения эритроцитов выделяют АИГА с внутриклеточным (наиболее частым), внутрисосудистым и смешанным гемолизом.
Клинические проявления АИГА:
При внутрисосудистом гемолизе моча приобретает темно-бурую или черную окраску.
Лабораторные критерии:
Стандарт первой линии терапии АИГА – пероральные глюкокортикостероиды в начальной дозе 1 мг/кг в сутки, возможно проведение пульс-терапии метилпреднизолоном в дозе 0,5–1,0 г/сутки внутривенно в течение 3-5 дней. Второй линией терапии является спленэктомия, которая используется при отсутствии эффекта глюкокортикостероидов в течение 4–6 месяцев. У пожилых пациентов показано назначение иммунодепрессивных и цитостатических препаратов (азатипоприн, циклофосфон, циклоспорин). Значительно реже используют моноклональные антитела (ритуксимаб) и иммуноглобулин. Выживаемость больных АИГА в течение 5 лет составляет 75%.
При анализе данного случая обращает внимание длительное латентное течение заболевания у больной преклонного возраста с гиперхромной анемией, что послужило причиной ошибочного диагноза B12–дефицитной анемии (для АИГА характерен нормохромный характер анемии). С учетом возраста пациентки и наличия сопутствующих заболеваний было принято решение о подключении к лечению цитостатической терапии, позволившее получить ремиссию заболевания, отменить глюкокортикостероиды и отказаться от проведения спленэктомии.