Симбикорт турбухалер или пульмикорт турбухалер что
Препарат, применяемый для лечения бронхиальной астмы, эффективен при новой коронавирусной инфекции
Бронхиальная астма повышает риск тяжелого течения COVID-19. Однако, согласно последним исследованиям, используемые для лечения астмы ингаляционные глюкокортикостероиды, в частности будесонид, могут оказывать протективный эффект и снижать риск осложнений.
Центры по контролю и профилактике заболеваний США (CDC) указывают, что пациенты с бронхиальной астмой имеют повышенный риск тяжелого течения коронавирусной инфекции [1]. Однако терапия глюкокортикостероидами ассоциируется с меньшим количеством осложнений COVID-19 не только для астматиков, но и для всех остальных пациентов.
В США было выполнено многоцентровое исследование, в котором сравнили данные 562 пациентов с COVID-19, с диагнозом бронхиальная астма, и 2686 сопоставимых по возрасту, полу и дате постановки диагноза COVID-19 пациентов без астмы. В результате было показано, что обе исследуемые группы нуждались в госпитализации с одинаковой частотой (21% пациентов с астмой и 18% – без астмы), а потребность в искусственной вентиляции легких составила 3% и 4%, соответственно. Умерло 7 (1%) пациентов с астмой и 69 (3%) без астмы. Ни у одного из 44 госпитализированных пациентов с тяжелой формой астмы не было летального исхода в связи с COVID-19 [2].
Другой недавний анализ 15 исследований из разных стран не выявил повышенного риска тяжелого течения и смертности среди пациентов с бронхиальной астмой и коронавирусной инфекцией [3]. Исследователи предположили, что ингаляционные глюкокортикостероиды, применяемые для лечения бронхиальной астмы, могут оказывать в данном случае протективный эффект.
Эта гипотеза легла в основу исследования STOIC, которое было выполнено на базе Оксфордского Университета [4]. В исследовании было рандомизировано 146 амбулаторных пациентов с подтвержденным COVID-19, 139 пациентам была проведена статистическая оценка результатов. 70 пациентов принимали дважды в день 800 мкг ингаляционного глюкокортикостероида будесонида (Пульмикорт® Турбухалер®, АстраЗенека). Контрольная группа (69 пациентов) получала стандартное лечение. Терапию начинали в первые 7 суток от начала заболевания и продолжали по необходимости до 28 дней.
В результате исследования было показано, что раннее применение будесонида на 90% снижало потребность в неотложной помощи и госпитализации у пациентов с COVID-19. Применение будесонида также ассоциировалось с сокращением времени до выздоровления. Среднее время до выздоровления составило 8 суток в группе будесонида и 11 суток в группе стандартной терапии. Симптомы на 14 и 28 день терапии сохранялись у меньшего числа пациентов, получавших будесонид. Длительность гипоксии в течение первых 14 дней наблюдения (количество дней с сатурацией кислорода в крови ≤94%) составила 19% и 22% в группах будесонида и стандартного лечения, соответственно.
Авторы исследования сочли эти результаты очень многообещающими и намерены проверить их в более крупных исследованиях.
«Во всем мире стартовали программы массовой вакцинации, но мы не знаем, сколько потребуется времени для их реализации. Меня очень воодушевляет, что относительно безопасное, доступное и хорошо изученное лекарство может снизить риск осложнений и помочь миллиардам людей, не имеющим доступа к медицинской помощи в стационаре», — сообщила главный автор исследования, профессор Мона Бафадхель (Mona Bafadhel) [5].
Новые возможности выбора ингаляционного устройства для пациентов с бронхиальной астмой и хронической обструктивной болезнью легких
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Ключевые слова: хроническая обструктивная болезнь легких, бронхиальная астма, симбикорт, турбухалер, рапихалер, порошковый ингалятор, дозированный аэрозольный ингалятор.
Для цитирования: Архипов В.В. Новые возможности выбора ингаляционного устройства для пациентов с бронхиальной астмой и хронической обструктивной болезнью легких. РМЖ. 2020;9:46-50.
New options for choosing an inhalation device for patients with asthma and chronic obstructive pulmonary disease
Russian Medical Academy of Continuous Professional Education, Moscow
Keywords: chronic obstructive pulmonary disease, bronchial asthma, Symbicort, Turbuhaler, Rapihaler, dry-powder inhaler, pressurized metered dose inhaler.
For citation: Arkhipov V.V. New options for choosing an inhalation device for patients with asthma and chronic obstructive pulmonary disease. RMJ. 2020;9:46–50.
Введение
В последние годы среди врачей отмечался повышенный интерес к порошковым ингаляторам (ПИ), т. к. этот класс ингаляторов не требует от больного координации в процессе выполнения вдоха и очень часто обеспечивает лучший уровень депозиции препарата в легких по сравнению с другими типами ингаляторов [1]. В данном обзоре рассмотрены различные типы ингаляторов, обсуждаются особенности их применения в клинической практике.
Применение ПИ не требует координации с вдохом, поскольку они являются пассивными устройствами: препарат покидает ингалятор и перемещается в дыхательные пути больного за счет потока воздуха на вдохе. Таким образом, ПИ являются хорошей альтернативой для примерно четверти больных астмой, у которых не получается точно синхронизировать активацию дозирующего аэрозольного ингалятора (ДАИ) с вдохом через ингалятор [2]. С другой стороны, большинство ПИ требуют от больного относительно высокой объемной скорости потока на вдохе, обычно не менее 60 л/мин (т. е. 1 л/с), а в некоторых случаях и выше (табл. 1) [3, 4].
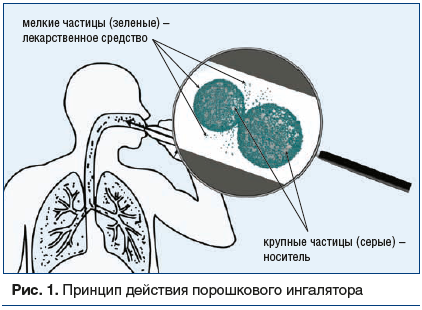
Размер частиц в современных ПИ составляет 2–3 мкм (что в 20–30 раз меньше толщины волоса и примерно соответствует размерам пневмококка). Требуется надежно защитить препарат от влаги, и, кроме того, ингалятор должен очень точно отмерять дозу препарата, поэтому из мелких частиц лекарственного средства и крупных частиц инертного носителя формируются агломераты, которые проще отмерить и сохранить, однако при этом поток воздуха на вдохе должен обеспечить энергию для распада агрегатов за счет соударения друг с другом. Установлено, что поток воздуха на вдохе должен обеспечить перепад давления между ингалятором и атмосферным воздухом на уровне 4 кПа. Благодаря этому перепаду большинство частиц препарата покидает ингалятор. Кроме того, при быстром потоке воздуха движение частиц становится турбулентным, благодаря чему крупные порошковые агрегаты распадаются на отдельные частицы за счет соударения друг с другом (рис. 1) [5].
Если у пациента не получается обеспечить оптимальный поток воздуха на вдохе, ингалятор продуцирует относительно более крупные частицы. Важно отметить, что такие частицы (>5 мкм в диаметре) не способны поступать в дыхательные пути с потоком воздуха, они оседают в полости рта и потенциально способны вызывать нежелательные эффекты [6].
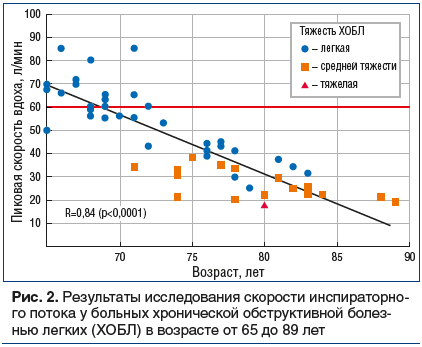
Достижение высокой скорости потока на вдохе может быть трудным для некоторых категорий больных. Например, у детей [7], пожилых пациентов [8], больных тяжелой хронической обструктивной болезнью легких (ХОБЛ) [9] скорость потока на вдохе нередко оказывается ниже 60 л/мин. Причем чем тяжелее заболевание и хуже функциональные показатели больного, тем меньше у него шансов обеспечить необходимое усилие в процессе ингаляции [8]. Например, среди больных, госпитализированных с обострением ХОБЛ, от 32% до 52% пациентов были не в состоянии на момент выписки вдохнуть через ПИ со скоростью ≥60 л/мин [10, 11]. Субоптимальная (менее 60 л/мин) пиковая скорость потока на вдохе чаще отмечается у больных с тяжелым течением ХОБЛ и лиц старше 70 лет (рис. 2) [12].
Типы порошковых ингаляторов и особенности их применения
ПИ различаются дизайном и требованиями к технике ингаляции. Так, у капсульных ингаляторов препарат находится в капсуле, которую надо поместить в ингалятор перед использованием. Резервуарные ПИ (Турбухалер ® ) содержат внутри резервуар, вмещающий от 30 до 120 доз. Применение капсульных ингаляторов по сравнению с резервуарными требует от больного выполнения вдоха большего объема и продолжительности [13], а также визуального контроля капсулы после ингаляции: если в капсуле остался порошок, больной должен повторить ингаляцию [14]. Напротив, резервуарные ингаляторы не требуют от больных столь значимых усилий при вдохе [15].
ПИ значительно отличаются друг от друга и по такому параметру, как поток воздуха на вдохе, который требуется для адекватной ингаляции. Чем ниже сопротивление ингалятора, тем больший поток воздуха требуется от больного во время выполнения ингаляции ( табл. 1). Для большинства ПИ пиковый поток на вдохе должен превышать 60 л/мин (или 1 л/с). Исключения составляют ингаляторы с высоким уровнем собственного сопротивления.
Проблема субоптимального воздушного потока при ингаляции через порошковые ингаляторы
Таким образом, часть тяжелых пациентов с ХОБЛ и БА не способны выполнить вдох через ПИ с оптимальной скоростью. При этом, к сожалению, поток на вдохе невозможно измерить при помощи обычного спирографа, чтобы определить, подходит ли пациенту ПИ, поскольку спирограф не учитывает уровень сопротивления, которое отличается у различных моделей ПИ. С другой стороны, в клинических исследованиях было показано, что у больных ХОБЛ с субоптимальным потоком на вдохе снижается эффективность терапии и увеличивается риск обострений и госпитализаций [10].
В клинической практике мы не можем измерить инспираторный поток у каждого больного, но можно выделить типы больных, у которых чаще всего встречается недостаточный поток на вдохе и, как следствие, снижается эффективность ПИ: лица пожилого и старческого возраста, женщины, люди с низким ростом. К снижению потока на вдохе приводят снижение форсированной жизненной емкости легких и емкости вдоха в % от должного, слабость дыхательной мускулатуры, тяжелая степень ХОБЛ.
Таким образом, различные ПИ отличаются по своим характеристикам и требуют разного потока на вдохе
(см. табл. 1).
Но, кроме того, существует определенная часть пациентов, у которых назначение ПИ может оказаться нерациональным из-за неспособности правильно выполнить инспираторный маневр. Эффективной альтернативой для таких больных являются ингаляционные устройства, способные активно выделять препарат: ДАИ, небулайзеры и Респимат.
Существует несколько примеров, когда ПИ разрабатывались в дополнение к существующим ДАИ. Так, например, появились салметерол / флутиказона пропионат Мультидиск и беклометазона дипропионат / формотерол Некстхалер. Это позволило создать устройства, не требующие от больного координации вдоха. Однако практика показала возможность движения в обратную сторону: создание новых ДАИ, которые не требуют от пациентов усилия на вдохе, в дополнение к уже имеющимся ПИ. Так, был разработан и зарегистрирован в России Симбикорт ® Рапихалер (рис. 3) — ДАИ, содержащий те же активные компоненты, что и давно известный в нашей стране Симбикорт ® Турбухалер ® [19–21].
Возможности применения дозированных аэрозольных ингаляторов в терапии бронхиальной астмы и хронической обструктивной болезни легких
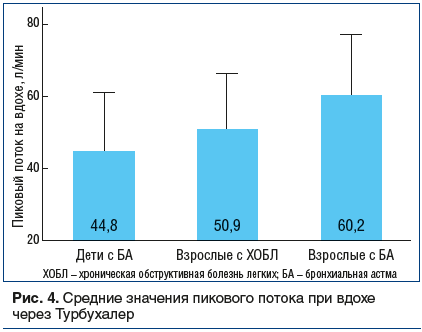
На рисунке 4 показаны результаты оценки средних значений пиковой скорости потока при вдохе через Турбухалер ® у взрослых и детей, больных БА, и пациентов с ХОБЛ [7].
С другой стороны, среди больных БА можно выделить категории, для которых назначение препарата Симбикорт ® более целесообразно в форме ингалятора Рапихалер:
Дети 6–11 лет. Исследования показали, что у детей, больных БА, инспираторный поток при вдохе через Турбухалер® существенно ниже 60 л/мин (см. рис. 4). В этом случае лучший лечебный результат может быть достигнут при назначении препарата Симбикорт® Рапихалер, 80/4,5 мкг/доза, — ингалятора, который не требует усилия на вдохе.
Пожилые пациенты, больные с сочетанием БА и ХОБЛ и другими состояниями [8].
Пациенты, которые предпочитают использовать ДАИ в силу наличия интуитивной обратной связи (звук, ощущение ингаляции). Ингаляция через ДАИ сопровождается специфическими ощущениями в груди, связанными с тем, что быстрое испарение пропеллента вызывает эффект охлаждения. Ряд больных интуитивно воспринимают это ощущение как свидетельство того, что препарат попал в дыхательные пути. Такие пациенты могут быть не удовлетворены вдохом через ПИ, который не сопровождается специфическими ощущениями в груди.
С другой стороны, назначая Симбикорт ® Рапихалер, врач должен проверить способность больного точно синхронизировать начало вдоха с моментом нажатия на баллончик, при котором происходит активация ингалятора. Если больной из-за нарушений мелкой моторики не способен правильно синхронизировать ДАИ, то существует возможность применения препарата Симбикорт ® Рапихалер через спейсер большого объема (≥750 мл). Ингаляции через спейсер позволяют значительно увеличить легочную депозицию будесонида и формотерола [31] и повысить контроль над БА [32].
Заключение
Редакция благодарит ООО «АстраЗенека Фармасьютикалз» за оказанную помощь в технической редактуре настоящей публикации.
Только для зарегистрированных пользователей
Ингаляции суспензии будесонида (Пульмикорта®) и комбинации будесонида/формотерола (Симбикорта®) в лечении обострений ХОБЛ
Лечение пациентов со стабильной хронической обструктивной болезнью легких (ХОБЛ) существенно отличается от лечения, необходимого в случаях развития обострений болезни. Помимо применения бронхорасширяющих средств, составляющих основу лечения, как при стабильном течении, так и при обострениях ХОБЛ, в последних случаях возникает потребность в назначении системных глюкокортикостероидов (ГКС), антибиотиков и проведении неинвазивной вентиляции легких [1].
Глюкокортикостероиды при обострениях ХОБЛ
Системные ГКС с успехом применяются для лечения обострений ХОБЛ. Они сокращают время наступления ремиссии, улучшают функцию легких и корректируют гипоксемию, а также могут уменьшить риск раннего рецидива и неудачи лечения, снизить длительность пребывания в больнице. Возможность их применения в дополнение к бронхолитикам должна рассматриваться при ОФВ1 менее 50% от должного. Рекомендуется преднизолон по 30–40 мг в сутки в течение 7–10 дней [1].
Поскольку большинство пациентов с ХОБЛ – люди преклонного возраста, обремененные многими сопутствующими заболеваниями, назначение системных ГКС приводит у них к многочисленным нежелательным эффектам, которые не позволяют провести лечение в адекватном объеме либо сводят на нет его непосредственную пользу [2].
Альтернативой системным ГКС при обострении ХОБЛ могут быть топические глюкокортикоиды, но польза от их применения оспаривается и при стабильной ХОБЛ, а усугубление нарушения проходимости бронхов в случае обострения становится серьезным препятствием для эффективного применения дозированных аэрозольных и порошковых ингаляторов. Увеличение дозы ингаляционных ГКС может в большей степени повышать системную биодоступность, чем терапевтический эффект.
Единственным доступным в настоящее время ГКС для ингаляций через компрессорный ингалятор (небулайзер) является суспензия будесонида (Пульмикорт®). В руководстве GOLD сказано, что будесонид в ингаляционной форме через небулайзер может быть альтернативой (хотя и более дорогостоящей) таблетированным ГКС при лечении обострения, не сопровождающегося ацидозом, и связывается со значительным снижением частоты таких осложнений, как гипергликемия [1].
Преимущества небулайзерной терапии
Использование небулайзеров для ингаляционной терапии дает следующие преимущества по сравнению как с дозированными аэрозольными ингаляторами (ДАИ), так и с системным применением лекарств:
• отсутствие необходимости координировать вдох с поступлением аэрозоля;
• возможность локального создания высоких концентраций препаратов для быстрого достижения лечебного эффекта;
• непрерывная подача лекарственного аэрозоля с мелкодисперсными частицами;
• простая техника ингаляций;
• простота точного дозирования препарата;
• значительное сокращение нежелательных эффектов, обусловленных системным действием препарата.
Эффективность ингаляций зависит от дозы аэрозоля и других факторов:
• количества продуцируемого аэрозоля;
• размеров частиц аэрозоля;
• соотношения вдоха и выдоха;
• анатомических особенностей дыхательных путей.
Оптимальный размер частиц аэрозоля составляет 2–5 мкм. Крупные частицы (диаметром более 10 мкм) оседают в ротоглотке. Частицы диаметром менее 1 мкм либо быстро выдыхаются, не задерживаясь в дыхательных путях, либо попадают в альвеолы, где всасываются и создают нежелательный адгезивный эффект. Если аэрозоль содержит большую долю слишком мелких частиц, оседающих в альвеолах, или избыток достаточно крупных частиц, оседающих в центральных бронхах, эта часть дозы не попадает в мелкие дыхательные пути и не оказывает лечебного действия, а только всасывается в системный кровоток. Таким образом, следует стремиться не просто к увеличению легочной депозиции ГКС, но к оптимальному по размеру частиц составу аэрозоля [3].
Будесонид успешно применяется для ингаляционной терапии у больных бронхиальной астмой более 25 лет. Ингаляции суспензии препарата с помощью компрессорного небулайзера показаны:
– для лечения обострений (вместо системных ГКС или как дополнение для уменьшения их дозы);
– для базисной терапии детей раннего возраста, которые не могут пользоваться другими ингаляционными устройствами;
– для базисной терапии взрослых пациентов с тяжелой стероидозависимой формой заболевания [3].
В последние годы суспензия будесонида находит все более широкое применение для лечения пациентов с обострениями ХОБЛ [4].
Суспензия будесонида (Пульмикорт®) для небулайзера представляет собой готовый препарат для ингаляций, выпускаемый в пластиковых контейнерах по 2 мл в дозировках 0,125 мг/мл, 0,25 мг/мл, 0,5 мг/мл. Препарат применяют с помощью компрессорных небулайзеров. Дозы объемом менее 2 мл разводят физиологическим раствором до суммарного объема 2 мл. После ингаляции необходимо прополоскать рот водой, если использовалась маска – умыть лицо. Открытый контейнер хранят в защищенном от света месте не более 12 часов. Перед тем как использовать остаток суспензии, контейнер осторожно встряхивают вращательным движением. Камеру небулайзера следует промывать после каждого применения будесонида.
Эффективность небулайзерных ингаляций будесонида
Опубликовано небольшое число работ, посвященных изучению эффективности и безопасности ингаляций будесонида при обострениях хронической обструктивной болезни легких (ХОБЛ).
Несколько лет назад в России было проведено сравнительное исследование, участниками которого стали 47 больных с обострениями ХОБЛ. Пациенты были разделены на 2 группы. Помимо терапии ингаляционными симпатомиметиками, антихолинергиками, препаратами теофиллина, антибиотиками, кислородом, пациенты одной из групп в течение 10 дней получали ингаляции суспензии будесонида через небулайзер по 2 мг 2 раза/сут.; а пациенты другой группы – плацебо (ингаляции физиологического раствора хлорида натрия через небулайзер 2 раза/сут.).
Результаты исследования показали, что терапия высокими дозами небулизированного будесонида у больных с обострением ХОБЛ в течение 10 дней по сравнению с плацебо достоверно ускоряла разрешение обострения ХОБЛ, приводила к уменьшению одышки, улучшению показателей ФВД, оксигенации крови, снижала число рецидивов обострений [5].
Сообщение о другом многоцентровом двойном слепом рандомизированном плацебо–контролируемом исследовании были опубликованы канадскими коллегами [6]. 199 пациентам с обострениями ХОБЛ проводили стандартную терапию: небулайзерные ингаляции β2–агонистов, ипратропия бромида, антибиотики и кислород. Пациенты были рандомизированно распределены в 3 группы. Помимо указанного выше лечения, 71 человек из группы 1 каждые 6 часов получал небулайзерные ингаляции 2 мг будесонида, 62 человека из группы 2 каждые 12 часов принимали внутрь по 30 мг преднизолона, а 66 человек из группы 3 – плацебо. Наблюдение продолжалось 72 часа.
Прирост среднего показателя ОФВ1 после ингаляции бронходилататора к концу наблюдения в группах 1 и 2 достоверно увеличился относительно плацебо и составил 0,1 л в группе 1, а в группе 2 – 0,16 л. Различие прироста среднего показателя ОФВ1 в группах 1 и 2 не было достоверным. На основании полученных результатов исследователи сделали вывод о том, что ингаляции будесонида через небулайзер могут быть альтернативой таблетированным ГКС при лечении обострений ХОБЛ, не сопровождающихся ацидозом, что нашло отражение в последней редакции руководства GOLD.
Ингаляции будесонида/формотерола в амбулаторном лечении обострений ХОБЛ
За последние 2 года появились 2 сообщения об успешном применении комбинации будесонида/формотерола в больших дозах в виде дозированного порошкового ингалятора (ДПИ) при обострениях ХОБЛ, не требующих госпитализации. В одном из исследований была поставлена цель определить возможность использования ДПИ будесонида/формотерола в качестве альтернативы системным ГКС при обострении ХОБЛ средней тяжести [7]. Это было двойное слепое рандомизированное многоцентровое параллельно–групповое сравнительное исследование, в которое были включены 109 пациентов с обострениями ХОБЛ. Средний возраст обследованных составил 67 лет, среднее значение ОФВ1 – 45% от должного. Во всех случаях пациенты отмечали прогрессирование одышки в течение недели и более, но их состояние на момент включения в исследование не требовало госпитализации. На протяжении первых двух недель пациенты одной из сформированных групп получали ингаляции будесонида/формотерола по 320/9 мкг 4 раза/сут., в другой – 30 мг преднизолона внутрь 1 раз/сут. и ингаляции формотерола по 9 мкг дважды в сутки. Последующие 12 недель все пациенты продолжали ингаляционную терапию комбинацией будесонида/формотерола по 320/9 мкг 2 раза/сут. Оценка результатов исследования выявила отсутствие различий между группами пациентов по показателям прироста ОФВ1, динамики симптомов, оценки качества жизни, частоты неудач лечения, потребности в дополнительных ингаляциях бронхолитиков и частоты развития обострений в период последующего наблюдения. Авторы сделали вывод об одинаковой эффективности ингаляций высоких доз будесонида/формотерола и перорального преднизолона в сочетании с ингаляциями формотерола при обостениях ХОБЛ, не требующих госпитализации пациентов, и рекомендовали повышение дозы будесонида/формотерола при появлении первых признаков обострения ХОБЛ как первый шаг, до назначения системных ГКС.
В другом двойном слепом рандомизированном параллельно–групповом исследовании у 45 пациентов с обострениями ХОБЛ, не использовавших ранее ГКС (средний возраст 65 лет, среднее значение ОФВ1 – 61% от должного), сравнивали противовоспалительный эффект ингаляций будесонида/формотерола по 320/9 мкг 4 раза/сут. и таблетированного преднизолона по 30 мг/сут. относительно плацебо. После 14 дней терапии в амбулаторных условиях снижение содержания эозинофилов в мокроте, как показатель уменьшения воспаления, под влиянием ингаляций будесонида/формотерола составило 57% и было достоверно большим, чем под влиянием плацебо. Будесонид/формотерол по сравнению с плацебо также достоверно уменьшал выраженность симптомов обострения ХОБЛ, но не редукцию показателя ОФВ1 [8].
Результаты двух приведенных выше исследований могут принципиально изменить существующие представления о подходах к лечению обострений ХОБЛ, но требуют дополнительного подтверждения.
Будесонид обладает рядом особенностей, выделяющих его в ряду других ИГКС по соотношению эффективности и безопасности. Среди этих особенностей – низкие липофильность и объем распределения, высокая степень первичной инактивации в печени и короткий период полувыведения. Данные свойства обусловливают высокую безопасность лечения будесонидом, что подтверждено результатами множества клинических исследований [3].
25–летний опыт применения ингаляций будесонида в различных дозах и у различных категорий пациентов показал, что препарат крайне редко вызывал нежелательные эффекты (подавление функции коры надпочечников, нарушение роста, увеличение вероятности переломов костей и осложнения в период беременности) [4].
Небулайзерные ингаляции высоких доз будесонида у больных с обострением ХОБЛ оказались безопасными, вызывали нежелательные эффекты не чаще, чем плацебо, и значительно реже, чем системные ГКС [5,6].
Ингаляции высоких доз будесонида/формотерола через ДПИ у пациентов с обострениями ХОБЛ средней тяжести на протяжении 14 дней не вызывали нежелательных явлений и не снижали утреннего уровня кортизола в крови по сравнению с плацебо [7,8].
Особенности механизмов воспаления делают нецелесообразным применение системных ГКС для лечения стабильной ХОБЛ. Тем не менее получены доказательства эффективности коротких курсов ГКС терапии в случаях обострений болезни. Эффект ГКС при обострениях ХОБЛ достигается за счет подавления воспалительных цитокинов, С–реактивного белка, взаимодействия клеток воспаления. Назначение системных ГКС позволяет ускорить темпы достижения ремиссии, уменьшить длительность госпитализации, улучшить функцию дыхания. Опыт применения ингаляционных ГКС, как с помощью небулайзеров, так и в дозированных аэрозолях, весьма скромен, но результаты всех сообщений, опубликованных по этому вопросу, обнадеживают своей однонаправленностью. Если дискуссия о целесообразности применения ингаляционных ГКС при стабильной ХОБЛ многие годы поддерживается получением противоположных результатов разными исследовательскими группами, то применение ингаляционных ГКС при обострении ХОБЛ во всех проведенных исследованиях оказалось успешным и, что важно, хорошо переносилось пациентами. Необходимо отметить, что будесонид был единственным препаратом, действие которого изучалось у пациентов с обострениями ХОБЛ.
Успешные результаты первых попыток использования ингаляционных ГКС при обострении ХОБЛ весьма обнадеживают. Вместе с тем сами авторы считают необходимыми дальнейшие исследования, которые дали бы дополнительную информацию о новом подходе к лечению обострений ХОБЛ до того, как рекомендовать его для широкого применения [2,9].
Исследования эффективности и безопасности применения высоких доз ингаляционного глюкокортикостероида будесонида с помощью небулайзера или дозирующего ингалятора на протяжении от 3 до 14 суток у больных с обострениями ХОБЛ показали, что такое дополнение к терапии ускоряло разрешение обострения ХОБЛ, приводило к уменьшению одышки, улучшению показателей ФВД, оксигенации крови, снижало число рецидивов обострений достоверно больше, чем плацебо, и в степени, сравнимой с приемом таблетированного преднизолона. Безопасность указанного лечения подтверждена отсутствием нежелательных эффектов.
1. Глобальная инициатива по хронической обструктивной болезни легких. Глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни легких. Пересмотр 2007 г. Москва, Атмосфера, 2008.
2. Gunen H., Mirici A., Meral M., Akgun M. Steroids in acute exacerbations of chronic obstructive pulmonary disease: are nebulized and systemic forms comparable? Curr. Opin. Pulm. Med. 2009; V.15: P.133–137.
3. Вознесенский Н.А. Влияние фармакокинетических характеристик ингаляционных глюкокортикостероидов на их безопасность и эффективность. РМЖ. 2008, 16, № 2; С. 65–68.
4. Christensson C., Thoren A., Lindberg B. Safety of inhaled budesonide: clinical manifestations of systemic corticosteroid–related adverse effects. Drug Saf. 2008; V.31: P.965–988.
5. Авдеев С.Н., Суточникова О.А., Белевский А.С., Чучалин А.Г. Небулизированный будесонид (суспензия Пульмикорта) при тяжелом обострении ХОБЛ. Пульмонология. 2003; № 5: С. 81–88.
6. Maltais F., Ostinelli J., Bourbeau J. et al. Comparison of nebulized budesonide and oral prednisolone with placebo in the treatment of acute exacerbations of chronic obstructive pulmonary disease: a randomized controlled trial. Am. J. Respir. Crit. Care Med. 2002; V.165: P.698–703.
7. Stallberg B., Selroos O., Vogelmeier C. et al. Budesonide/formoterol as effective as prednisolone plus formoterol in acute exacerbations of COPD. A double–blind, randomised, non–inferiority, parallel–group, multicentre study. Respir. Res. 2009; V.10: P.11.