что сильнее азитромицин или левофлоксацин при пневмонии
Возможности клинического применения левофлоксацина
Антибактериальные препараты из группы фторхинолонов занимают одно из ведущих мест в лечении различных бактериальных инфекций, в том числе в амбулаторных условиях. Однако столь популярные в настоящее время ципрофлоксацин, офлоксацин, ломефлоксацин
Антибактериальные препараты из группы фторхинолонов занимают одно из ведущих мест в лечении различных бактериальных инфекций, в том числе в амбулаторных условиях. Однако столь популярные в настоящее время ципрофлоксацин, офлоксацин, ломефлоксацин, пефлоксацин обладают высокой активностью в отношении грамотрицательных возбудителей, умеренной активностью против атипичных возбудителей и малоактивны в отношении пневмококков и стрептококков, что значительно ограничивает их применение, особенно при респираторных инфекциях.
В последнее десятилетие в клиническую практику стали входить новые препараты из этой группы — т. наз. новые фторхинолоны, которые сохраняют высокую активность против грамотрицательных возбудителей, свойственную их предшественникам, и при этом значительно более активны против грамположительных и атипичных микроорганизмов. Одним из таких препаратов является левофлоксацин (таваник). По химической структуре он представляет собой левовращающий изомер офлоксацина. Широкий спектр антибактериальной активности, высокая безопасность, удобные фармакокинетические свойства обусловливают возможность его широкого применения при различных инфекциях.
Механизм действия
Левофлоксацин обладает быстрым бактерицидным действием, поскольку проникает внутрь микробной клетки и подавляет, так же как и фторхинолоны первого поколения, ДНК-гиразу (топоизомеразу II) бактерий, что нарушает процесс образования бактериальной ДНК. Ферменты клеток человека не чувствительны к фторхинолонам, и последние не оказывают токсического действия на клетки макроорганизма. В отличие от препаратов прежнего поколения новые фторхинолоны ингибируют не только ДНК-гиразу, но и второй фермент, ответственный за синтез ДНК, — топоизомеразу IV, выделенную у некоторых микроорганизмов, прежде всего грамположительных. Считается, что именно воздействием на этот фермент объясняется высокая антипневмококковая и антистафилококковая активность новых фторхинолонов.
Левофлоксацин обладает клинически значимым дозозависимым постантибиотическим эффектом, достоверно более длительным по сравнению с ципрофлоксацином, а также длительным (2-3 часа) субингибирующим действием.
Под действием левофлоксацина отмечено повышение функции полиморфноядерных лимфоцитов у здоровых добровольцев и ВИЧ-инфицированных пациентов. Показано его иммуномодулирующее воздействие на тонзиллярные лимфоциты у больных хроническим тонзиллитом. Полученные данные позволяют говорить не только об антибактериальной активности, но и о синергическом противовоспалительном и антиаллергическом действии левофлоксацина.
Спектр антимикробной активности
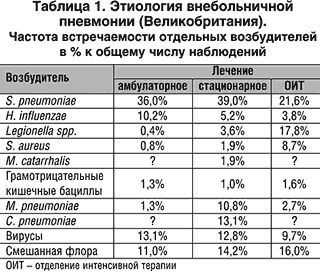
Левофлоксацин характеризуется широким антимикробным спектром, включающим грамположительные и грамотрицательные микроорганизмы, в том числе внутриклеточные возбудители (табл. 1).
При сравнении эффективности различных антибактериальных препаратов в отношении возбудителей респираторных инфекций было выявлено, что левофлоксацин в отношении противомикробной активности превосходит остальные препараты. К нему оказались чувствительны все штаммы пневмококка, в том числе пенициллинрезистентные, при сравнительно более низкой чувствительности пневмококков к препаратам сравнения: офлоксацин — 92%, ципрофлоксацин — 82%, кларитромицин — 96%, азитромицин — 94%, амоксициллин/клавуланат — 96%, цефуроксим — 80%. К левофлоксацину оказались также чувствительны все штаммы моракселлы катаралис, гемофильной палочки и метициллин чувствительного золотистого стафилококка, 95% штаммов клебсиеллы пневмонии.
Резистентность
Возможность широкого клинического использования левофлоксацина и других новых фторхинолонов заставляет задуматься об опасности развития резистентности к ним. Хромосомные мутации являются основным механизмом, обеспечивающим устойчивость микробов к фторхинолонам. При этом происходит постепенное накопление мутаций в одном или двух генах и ступенчатое снижение чувствительности. Развитие клинически значимой резистентности пневмококков к левофлоксацину наблюдается после трех мутаций, а следовательно, представляется маловероятным. Это подтверждается и экспериментальными данными: левофлоксацин вызывал спонтанные мутации в 100 раз реже, чем ципрофлоксацин, независимо от чувствительности тестируемых штаммов пневмококка к пенициллину и макролидам. Широкое использование препарата в последние годы в США и Японии не привело к росту резистентности к нему. По данным K. Yamaguchi et al., 1999, чувствительность бактерий к левофлоксацину за пять лет, т. е. с момента начала его широкого применения, не изменилась и превышает 90% как для грамотрицательных, так и для грамположительных возбудителей.
Больший риск развития антибиотикорезистентности связан не с пневмококками, а с грамотрицательными бактериями. В то же время, по некоторым данным, применение левофлоксацина в отделениях интенсивной терапии не сопровождается значимым ростом резистентности грамотрицательной кишечной флоры.
Фармакокинетика
Левофлоксацин хорошо всасывается в желудочно-кишечном тракте. Его биодоступность составляет 99% и более. Так как левофлоксацин почти не подвергается метаболизму в печени, это способствует быстрому достижению максимальной его концентрации в крови (значительно более высокой, чем у ципрофлоксацина). Так, при назначении добровольцам стандартной дозы фторхинолона значения его максимальной концентрации в крови при приеме левофлоксацина составляли 2,48 мкг/мл/70 кг, ципрофлоксацина — 1,2 мкг/мл/70 кг.
После приема разовой дозы левофлоксацина (500 мг) его максимальная концентрация в крови, равная 5,1 ± 0,8 мкг/мл, достигается через 1,3-1,6 часа, при этом бактерицидная активность крови против пневмококков сохраняется до 6,3 часа независимо от их чувствительности к пенициллинам и цефалоспоринам. Более длительное время, до 24 часов, сохраняется бактерицидное действие крови на грамотрицательные бактерии семейства Enterobacteriacae.
Период полувыведения левофлоксацина составляет 6-7,3 часа. Около 87% принятой дозы препарата выделяется с мочой в неизмененном виде в течение последующих 48 часов.
Левофлоксацин быстро проникает в ткани, при этом уровни тканевых концентраций препарата выше, чем в крови. Особенно высокие концентрации устанавливаются в тканях и жидкостях респираторного тракта: альвеолярных макрофагах, слизистой бронхов, бронхиальном секрете. Левофлоксацин также достигает высоких концентраций внутри клеток.
Длительный период полувыведения, достижение высоких тканевых и внутриклеточных концентраций, а также наличие постантибиотического действия — все это позволяет назначать левофлоксацин один раз в сутки.
Лекарственные взаимодействия
Биодоступность левофлоксацина снижается при одновременном приеме с антацидами, сукральфатом, препаратами, содержащими соли железа. Интервал между приемом этих лекарственных средств и левофлоксацина должен составлять не менее 2 часов. Других клинически значимых взаимодействий левофлоксацина выявлено не было.
Клиническая эффективность
Существует много публикаций, посвященных результатам клинических исследований эффективности применения левофлоксацина. Ниже представлены наиболее значимых из них.
В многоцентровом рандомизированном исследовании, включившем 590 пациентов, сравнивалась эффективность и безопасность двух режимов лечения: левофлоксацина в/в и/или перорально в дозе 500 мг в сутки и цефтриаксона в/в 2,0 г в сутки; и/или цефуроксима перорально 500 мг два раза в сутки в комбинации с эритромицином или доксициклином у больных с внебольничной пневмонией. Длительность терапии 7–14 дней. Клиническая эффективность составила 96% в группе левофлоксацина и 90% в группе, получавшей цефалоспорины. Эрадикация возбудителей была достигнута соответственно у 98 и 85% больных. Частота нежелательных действий в группе левофлоксацина составляла 5,8%, а в группе сравнения 8,5%.
В другом большом рандомизированном исследовании сравнивалась эффективность лечения больных с тяжелой пневмонией левофлоксацином 1000 мг в сутки и цефтриаксоном — 4 г в сутки. Первые дни левофлоксацин назначили в/в, затем перорально. Результаты лечения в обеих группах оказались сопоставимы, но в группе цефтриаксона наблюдалась достоверно более частая смена антибиотика в первые дни лечения — из-за недостаточного клинического эффекта.
Сопоставимые результаты были получены и при сравнении групп пациентов, получавших лечение левофлоксацином и коамоксиклавом.
Эффективность монотерапии левофлоксацином изучалась у более чем 1000 пациентов с внебольничной пневмонией. Клиническая и бактериологическая эффективность составляли здесь 94 и 96% соответственно.
Фармакоэкономические исследования показали, что общие затраты на лечение пациентов левофлоксацином и комбинацией цефалоспорина и макролида сопоставимы или даже несколько ниже в группе левофлоксацина.
У пациентов с обострением хронического бронхита сравнивалась эффективность лечения левофлоксацином в дозе 500 мг в сутки перорально и цефуроксимом аксетила внутрь 500 мг два раза в сутки. При этом клиническая и бактериологическая эффективность не различалась в зависимости от групп и составляла 77–97%.
Таким образом, в настоящее время можно считать доказанной высокую эффективность левофлоксацина при респираторных инфекциях нижних дыхательных путей. Результаты проведенных исследований позволили включить левофлоксацин как препарат первого ряда или альтернативный в схему лечения пациентов с внебольничной пневмонией и обострениями хронического бронхита (табл. 2).
В последние годы левофлоксацин стал более широко использоваться и при других инфекционных заболеваниях. Так, появились сообщения, касающиеся его успешного применения у больных с острыми синуситами. Левофлоксацин в 100% случаев активен против наиболее часто встречающихся бактериальных возбудителей этого заболевания; по эффективности он сопоставим с амоксициллином/клавуланатом в больших дозах и значительно превосходит цефалоспорины, котримоксазол, макролиды и доксициклин.
Среди возбудителей урологических инфекций наблюдается рост резистентности к широко используемым антибактериальным препаратам. Так, за период с 1992 по 1996 год отмечено увеличение устойчивости E. Coli и S. saprophyticus к котримоксазолу — на 8–16% и к ампициллину — на 20%. Устойчивость к ципрофлоксацину, нитрофуранам и гентамицину возрасла за этот же период на 2%. Применение левофлоксацина у пациентов с осложненными мочевыми инфекциями в дозе 250 мг в сутки оказалось эффективным у 86,7% пациентов.
Выше приводились фармакокинетические показатели высокого содержания левофлоксацина в тканях. Это наряду с антимикробным спектром препарата послужило основанием для его использования с целью профилактики инфекционных осложнений при эндоскопических методах лечения и диагностики, например при ретроградной холангиопанкреатографии и для периоперационной профилактики в ортопедии.
Применение левофлоксацина в этих ситуациях представляется перспективным и требует дальнейшего изучения.
Безопасность
Левофлоксацин считается одним из самых безопасных антибактериальных препаратов. Однако при его назначении существует ряд ограничений.
У пациентов с нарушением функции печени корригировать дозу препарата не нужно, но нарушение функции почек при снижении клиренса креатинина (менее 50 мл/мин) требует уменьшения дозы препарата. Дополнительный прием левофлоксацина после проведения гемодиализа или амбулаторного перитониального диализа не требуется.
Левофлоксацин не применяется у беременных и кормящих женщин, у детей и подростков. Препарат противопоказан пациентам, у которых в анамнезе имеются нежелательные реакции на лечение фторхинолонами.
У больных пожилого и старческого возраста при приеме левофлоксацина не выявлено повышенного риска развития нежелательных побочных реакций и не требуется коррекции доз.
Контролируемые клинические исследования показали, что побочные реакции при применении левофлоксацина возникают редко и большей частью не являются серьезными. Существует зависимость между дозой препарата и частотой развития НД: при суточной дозе 250 мг их частота не превышает 4,0–4,3%, при дозе 500 мг/ сут. — 5,3–26,9%, при дозе 1000 мг/сут. — 22–28,8%. Наиболее часто наблюдались симптомы желудочно-кишечной диспепсии — тошнота и диарея (1,1–2,8%). При внутривенном введении возможно покраснение места инъекции, иногда наблюдается развитие флебитов (1%).
Дозирование
Левофлоксацин выпускается в двух формах: для внутривенного введения и приема внутрь. Применяется по 250-500 мг один раз в сутки, при тяжелых инфекциях возможно назначение по 500 мг два раза в сутки. При внебольничной пневмонии длительность лечения составляет 10-14 дней, при обострении хронического бронхита — 5-7 дней.
Таблица 1. Спектр противомикробной активности левофлоксацина
Почему азитромицин остается препаратом выбора при внебольничных инфекциях нижних дыхательных путей
Инфекционно-воспалительные заболевания дыхательных путей занимают первое место в структуре инфекционной патологии. Пневмония является наиболее частой инфекционной причиной смерти в мире.
Инфекционно-воспалительные заболевания дыхательных путей занимают первое место в структуре инфекционной патологии. Пневмония является наиболее частой инфекционной причиной смерти в мире. В России ежегодно около 1,5 млн человек переносят пневмонию. В связи с этим остается актуальной проблема рационального выбора антибактериального средства для лечения инфекций нижних дыхательных путей. Выбор препарата для антибактериальной терапии должен основываться на его спектре действия, охватывающем выделенный или предполагаемый возбудитель, чувствительный к данному антибиотику, фармакокинетических свойствах антибактериального средства, обеспечивающих его проникновение в терапевтической концентрации в соответствующие ткани, клетки и жидкости организма, данных о безопасности антибиотика (побочных эффектах, противопоказаниях и возможном нежелательном взаимодействии с другими лекарствами), характеристиках лекарственной формы, способе введения и режиме дозирования, обеспечивающих высокий комплаенс терапии, фармакоэкономических аспектах лечения [4, 6, 8].
Инфекции нижних дыхательных путей и принципы выбора антибиотика
При неспецифических внебольничных инфекциях выбор антибактериального препарата в большинстве случаев основывается на статистических данных о наиболее частых их возбудителях, а также сведениях о подтвержденной в контролируемых клинических исследованиях эффективности тех или иных антибиотиков при инфекциях известной этиологии. Вынужденно эмпирический подход к лечению связан с отсутствием возможности микробиологического исследования в амбулаторных лечебных учреждениях, длительностью бактериологической идентификации возбудителя и определения его чувствительности к антибиотикам (3–5 дней, а в случае «атипичных» патогенов и больше), невозможностью в ряде случаев получить биологический материал для посева или бактериоскопии (например, около 30% больных пневмониями имеют непродуктивный кашель, что не позволяет исследовать мокроту), трудностями в разграничении истинных возбудителей и сапрофитов (обычно микроорганизмов ротоглотки, попадающих в исследуемый материал). Сложности выбора лекарственного средства в амбулаторных условиях определяются также отсутствием полноценного наблюдения за течением заболевания и, следовательно, своевременной коррекции лечения при его неэффективности. Антибиотики по-разному проникают в различные ткани и биологические жидкости. Лишь некоторые из них хорошо проникают в клетку (макролиды, тетрациклины, фторхинолоны, в меньшей степени — клиндамицин и сульфаниламиды). Поэтому, даже если препарат in vitro проявляет высокую активность в отношении данного возбудителя, но не достигает в месте его локализации уровня, превышающего минимальную подавляющую концентрацию (МПК) для данного микроорганизма, клинического эффекта он не окажет, хотя микробная резистентность к нему будет вырабатываться. Не менее важным аспектом антибактериальной терапии является ее безопасность, особенно для амбулаторного больного, лишенного повседневного медицинского наблюдения. В амбулаторных условиях следует отдавать предпочтение пероральному приему антибиотиков. В педиатрической практике имеют значение органолептические свойства препарата. Для повышения исполняемости пациентом врачебных назначений режим дозирования антибиотика должен быть максимально простым, т. е. предпочтительнее препараты с минимальной кратностью приема и коротким курсом лечения.
Возбудители неспецифических внебольничных инфекций нижних дыхательных путей
Острые респираторные вирусные инфекции (ОРВИ), протекающие с синдромом бронхита, в ряде случаев, чаще в детском возрасте, могут осложняться присоединением бактериальной флоры с развитием острого бронхита. Возбудителями острого бактериального бронхита в детском возрасте являются пневмококк, микоплазма или хламидия, реже гемофильная палочка, моракселла или стафилококк. Острый бактериальный бронхиолит у детей вызывают моракселла, микоплазма и возбудитель коклюша. Острый гнойный трахеобронхит у взрослых в 50% случаев вызывает гемофильная палочка, в остальных случаях пневмококк, реже моракселла (5–8% случаев) или внутриклеточные микроорганизмы (5% случаев).
Среди бактериальных возбудителей обострений хронического бронхита главную роль играют Haеmophilus influenzae (30–70% случаев), Streptococcus pneumoniae и Moraxella catarrhalis. Для курильщиков наиболее характерна ассоциация H. influenzae и M. catarrhalis. В отягощенных клинических ситуациях (возраст старше 65 лет, многолетнее течение болезни — более 10 лет, частые обострения — более 4 раз в год, сопутствующие заболевания, выраженные нарушения бронхиальной проходимости — объем форсированного выдоха за первую секунду (ОФВ1)
С. В. Лукьянов, доктор медицинских наук, профессор ФГУ «Консультативно-методический центр лицензирования» Росздравнадзора, Москва
Ошибки в антибактериальной терапии инфекций дыхательных путей в амбулаторной практике
Опубликовано в журнале:
Лечащий врач, 2003, №8 Л. И. Дворецкий, доктор медицинских наук, профессор
С. В. Яковлев, доктор медицинских наук, профессор
ММА им. И. М. Сеченова, Москва
При выборе способа антибактериальной терапии в амбулаторной практике необходимо учитывать и решать как тактические, так и стратегические задачи. К тактическим задачам антибиотикотерапии относится рациональный выбор антибактериального препарата, обладающего наибольшим терапевтическим и наименьшим токсическим воздействием.
Стратегическая задача антибиотикотерапии в амбулаторной практике может быть сформулирована как уменьшение селекции и распространения резистентных штаммов микроорганизмов в популяции.
В соответствии с этими положениями следует выделять тактические и стратегические ошибки при проведении антибактериальной терапии инфекций дыхательных путей в амбулаторной практике (см. таблицу 1).
Таблица 1. Ошибки антибактериальной терапии в амбулаторной практике.
Тактические ошибки антибактериальной терапии
1. Необоснованное назначение антибактериальных средств
Особую категорию ошибок представляет неоправданное применение антибактериальных препаратов (АП) в тех ситуациях, когда их назначение не показано.
Показанием для назначения антибактериального препарата является диагностированная или предполагаемая бактериальная инфекция.
При всех трудностях принятия решения в подобных ситуациях необходимо отдавать себе отчет в том, что антибактериальные препараты не оказывают влияния на течение вирусной инфекции и, следовательно, их назначение при ОРВИ не оправдано (см. таблицу 2). В то же время предполагаемая возможность предотвращения бактериальных осложнений вирусных инфекций с помощью назначения антибактериальных препаратов не находит себе подтверждения в клинической практике. Кроме того, очевидно, что широкое неоправданное применение антибактериальных препаратов при ОРВИ чревато формированием лекарственной устойчивости и повышением риска возникновения нежелательных реакций у пациента.
Таблица 2. Инфекционные заболевания дыхательных путей преимущественно вирусной этиологии
и не требующие антибактериальной терапии.
Часто врач назначает нистатин или другой антимикотик в случае обнаружения в полости рта или в моче грибов рода Candida. При этом он ориентируется лишь на данные микробиологического исследования и не учитывает наличие или отсутствие симптомов кандидоза, а также факторов риска развития грибковой инфекции (тяжелый иммунодефицит и др.).
Выделение грибов рода Candida из полости рта или мочевых путей пациентов в большинстве случаев служит свидетельством бессимптомной колонизации, не требующей коррегирующей противогрибковой терапии.
II. Ошибки в выборе антибактериального препарата
Пожалуй, наибольшее число ошибок, возникающих в амбулаторной практике, связано с выбором антибактериального средства. Выбор антибиотика должен производиться с учетом следующих основных критериев:
Место левофлоксацина в фармакотерапии внебольничной пневмонии
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
ММА имени И.М. Сеченова
П о существующим оценкам, в нашей стране ежегодно отмечается 1,5 млн. случаев пневмонии [1], что позволяет рассматривать это заболевание, как одно из наиболее проблемных для отечественного здравоохранения. Необходимость регулярного обращения к теме фармакотерапии внебольничной пневмонии (ВП) можно объяснить, по крайней мере, двумя причинами – изменениями спектра и резистентности возбудителей ВП и появлением в клинической практике новых антибактериальных препаратов (АБП).
В частности, в последние годы отмечается снижение чувствительности основного возбудителя ВП – S.pneumoniae к АБП, часто применявшимся в рутинной практике. Так, по данным исследования ПеГаС–1, доля пневмококка, резистентного к тетрациклину и ко–тримоксазолу, составляет соответственно 34% и 38%. Примерно 4% штаммов этого микроорганизма резистентны к макролидам (в том числе к азитромицину). Наибольшую тревогу вызывает рост устойчивости этого возбудителя к пенициллину (и одновременно снижение эффективности других b –лактамов) – 7,5% у детей и до 9% у взрослых, причем максимальный уровень резистентности к пенициллину (до 20% в некоторых стационарах) наблюдается в Москве и крупных городах [2].
С другой стороны, фармакотерапия ВП в нашей стране по–прежнему далека от оптимальной. По данным крупного (778 амбулаторных больных в 7 городах России, включая Москву и Санкт–Петербург) фармакоэпидемиологического исследования [3], врачи общей практики при лечении ВП наиболее часто применяют гентамицин (29,3%), ко–тримоксазол (22,7%), ампициллин (20,3%) и ципрофлоксацин (17,2%).
При этом наиболее перспективным препаратам для амбулаторной терапии респираторных инфекций – респираторным фторхинолонам – вообще не нашлось места в числе назначений.
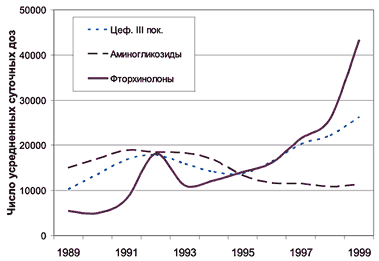
Между тем с середины 90–х годов респираторные фторхинолоны (левофлоксацин, спарфлоксацин) заняли прочное место в алгоритмах выбора АБП, построенных на принципах доказательной медицины (рекомендации Общества инфекционных болезней, США, 1998 [4]; Руководство Американского торакального общества, 2001 [5]; рекомендации Британского торакального общества, 2001 [6]). В качестве примера можно указать на значительный рост использования фторхинолонов в США (рис. 1), где с конца 90–х годов эти АБП применяются в клинической практике значительно чаще, чем цефалоспорины III поколения и аминогликозиды.
Рис. 1. Тенденции в применении АБП в США (1989-99 гг.) [7]
Рис. 2. Динамика резистентности S.pneumoniae к фторхинолонам (данные Cross-Canada Surveillance Study)
Но наряду с этим приходиться констатировать, что стоимость респираторных фторхинолонов существенно выше стоимости АБП, применяемых в рутинной практике, кроме того, сохраняется запрет на использование препаратов этой группы для лечения детей и беременных.
Из представленных на отечественном рынке фторхинолонов III поколения наиболее удачным соотношением между стоимостью лечения и его эффективностью обладает левофлоксацин (Таваник) зарегистрированы формы для в/в введения и для приема внутрь. Это самый распространенный препарат среди фторхинолонов III поколения. Настоящий обзор ставит своей целью показать место этого АБП в современной фармакотерапии внебольничной пневмонии.
Левофлоксацин практически полностью всасывается в кишечнике (биодоступность при приеме внутрь 99%). Период его полувыведения – 6–8 часов, что позволяет применять левофлоксацин 1 раз в день (суточная доза – 500 мг). Равновесная концентрация в плазме при приеме 1 раз в сутки устанавливается через 48 часов после начала лечения. Препарат хорошо проникает в ткани (объем распределения – 89–112 л), после его однократного приема концентрация в ткани легкого в 2–5 раз превышает концентрацию в крови [9]. В жидкости на поверхности эпителия нижних дыхательных путей левофлоксацин накапливается в концентрации в 12 раз большей, чем минимальная ингибирующая концентрация (МИК) для S.pneumoniae (см. рис. 3).
Рис. 3. Отношение концентрации фторхинолонов в жидкости на поверхности эпителия бронхов к величине МИК для S.pneumoniae [9]
В целом фармакокинетические параметры левофлоксацина не уступают аналогичным показателям других фторхинолонов III–IV поколения – гатифлоксацина и моксифлоксацина.
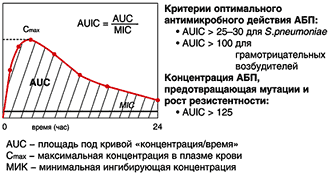
Для оценки фармакодинамики и эффективности фторхинолонов решающее значение имеет отношение величины площади под фармакокинетической кривой (AUC) к величине минимальной ингибирующей концентрации МИК90% возбудителя (рис. 4) [10]. Эффекта от применения препаратов следует ожидать только в том случае, когда величина AUC/МИК90%
Рис. 4. Соотношение фармакокинетических (Сmax, AUC24) и фармакодинамических (МИК90%) параметров, определяющих эффективность фторхинолонов [10]
Следует отметить, что левофлоксацин эффективен в отношении большинства возбудителей респираторной инфекции, хотя в отношении S.pneumoniae его прогнозируемая эффективность меньше, чем у фторхинолонов IV поколения.
Кроме того, благодаря высокой концентрации в крови левофлоксацин демонстрирует очень высокую эффективность у больных с бактериемией. Спектр антимикробного действия левофлоксацина представлен в таблице 2.
Клинические исследования левофлоксацина
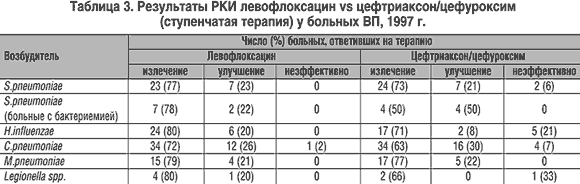
В крупном многоцентровом рандомизированном клиническом исследовании (РКИ) [12] у 590 больных ВП оценивалась эффективность в/в введения и перорального приема левофлоксацина по сравнению с цефалоспоринами III поколения (цефтриаксон ВВ и цефуроксим внутрь). Эрадикация возбудителей при применении левофлоксацина была достигнута в 98% случаев (при использовании цефалоспоринов – 85%). Исследуемые препараты не отличались по эффективности в отношении пневмококка, однако левофлоксацин оказался более эффективным у больных с H.influenzae и атипичными возбудителями (табл. 3).
В крупном многоцентровом рандомизированном клиническом исследовании (РКИ) [12] у 590 больных ВП оценивалась эффективность в/в введения и перорального приема левофлоксацина по сравнению с цефалоспоринами III поколения (цефтриаксон ВВ и цефуроксим внутрь). Эрадикация возбудителей при применении левофлоксацина была достигнута в 98% случаев (при использовании цефалоспоринов – 85%). Исследуемые препараты не отличались по эффективности в отношении пневмококка, однако левофлоксацин оказался более эффективным у больных с и атипичными возбудителями (табл. 3).
В другом исследовании у госпитализированных больных с ВП (умеренное и тяжелое течение пневмонии) [13] левофлоксацин (500 мг в/в 2 раза в день) и цефтриаксон (4,0 г ВВ 1 раз в день) продемонстрировали одинаковую микробиологическую эффективность (эрадикация возбудителей в 83% при применении обоих АБП).
От современных макролидов (кларитромицин) левофлоксацин статистически значимо не отличался как по клинической, так и по микробиологической эффективности [15].
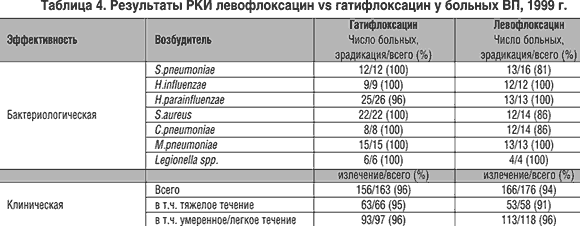
По результатам одного из РКИ [16] левофлоксацин и гатифлоксацин обладают одинаковой эффективностью при лечении ВП легкой и средней тяжести, однако при терапии ВП тяжелого течения гатифлоксацин был несколько более эффективным (табл. 4).
В целом мета–анализ 5 крупных РКИ (1067 больных ВП) показал, что эффективность левофлоксацина при пневмонии составляет 83–100% (для препаратов сравнения – 90–95%) [17].
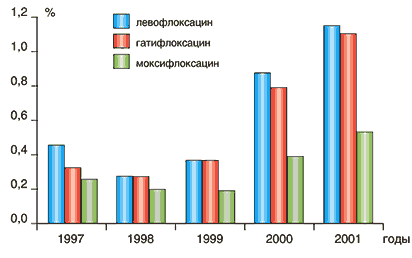
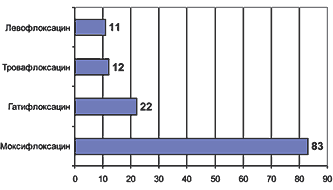
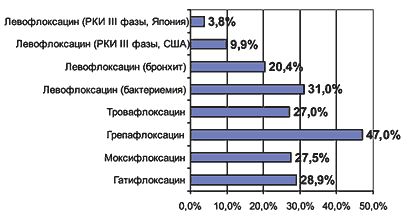
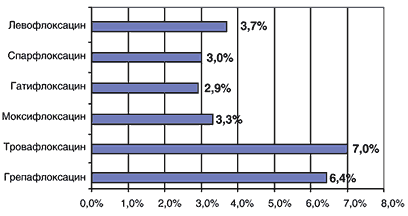
Основной нежелательной лекарственной реакцией (НЛР) левофлоксацина является его проаритмогенное действие, проявляющееся удлинением интервала QT на ЭКГ (в среднем, по данным РКИ, на 5 мс). Однако в этом отношении левофлоксацин представляется более безопасным, чем спарфлоксацин (аналогичная величина 13–15 мс) или эритромицин (8–15 мс). По общей частоте НЛР и частоте отмены препарата вследствие НЛР (рис. 5,6) левофлоксацин является одним из наиболее безопасных фторхинолонов [18,19].
Рис. 5. Частота НЛР при приеме фторхинолонов (%) [18,19]
Рис. 6. Необходимость отмены фторхинолонов из-за развития НЛР (%) [18,19]
Зарубежные рекомендации по применению левофлоксацина
Респираторные хинолоны рассматриваются целым рядом авторов в качестве препаратов выбора для лечения пневмонии, вызванной пенициллинрезистентными штаммами пневмококка (ПРП) [20–23]. Администрация пищевых продуктов и лекарственных средств США (FDA) одобрила левофлоксацин в качестве средства для терапии респираторных инфекций, вызванных ПРП, при этом учитывались суммарные данные 8–ми РКИ, в которых приняли участие более 3900 больных [24]. Из этого большого количества больных ПРП был возбудителем пневмонии в 18 случаях, а эффективность левофлоксацина удалось оценить только у 15 больных. Во всех этих случаях левофлоксацин оказался клинически эффективным.
Респираторные хинолоны рассматриваются целым рядом авторов в качестве препаратов выбора для лечения пневмонии, вызванной пенициллинрезистентными штаммами пневмококка (ПРП) [20–23]. Администрация пищевых продуктов и лекарственных средств США (FDA) одобрила левофлоксацин в качестве средства для терапии респираторных инфекций, вызванных ПРП, при этом учитывались суммарные данные 8–ми РКИ, в которых приняли участие более 3900 больных [24]. Из этого большого количества больных ПРП был возбудителем пневмонии в 18 случаях, а эффективность левофлоксацина удалось оценить только у 15 больных. Во всех этих случаях левофлоксацин оказался клинически эффективным.
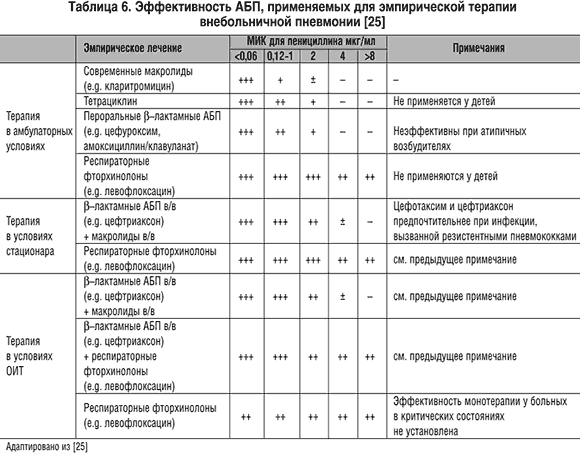
Наиболее широкие показания к применению левофлоксацина и препарата IV поколения – моксифлоксацина существуют в США [25], где доля пенициллинустойчивых штаммов пневмококка составляет от 17,9% до 33,8% для различных штатов (2001 г.). Согласно этим рекомендациям (см. табл. 5) левофлоксацин является препаратом второго ряда для больных пневмонией легкого течения, не требующих госпитализации, и госпитализированных пациентов без тяжелых сопутствующих заболеваний. В остальных случаях левофлоксацин назначается в качестве препарата первой линии для эмпирической терапии, при этом прослеживается тенденция к его использованию в комбинации с цефтриаксоном4, что обеспечивает большую эффективность при терапии ВП тяжелого течения (см. табл. 6).
Специалисты из Великобритании, в которой уровень резистентности пневмококка до настоящего времени остается наиболее низким в Западной Европе (всего 6,7%; 2001 г.), отличаются более сдержанным подходом к назначению левофлоксацина [6]. В рекомендациях Британского торакального общества левофлоксацину5 отводится роль препарата второго ряда для лечения ВП в условиях стационара (при лечении ВП тяжелого течения его рекомендуется назначать в комбинации с пенициллином).
Исходя из вышесказанного, применение левофлоксацина в нашей стране оправдано ввиду его высокой эффективности и может эффективно использоваться при:
А) лечении ВП в амбулаторных условиях (прием левофлоксацина внутрь в виде монотерапии) –
– лечение b –лактамными антибиотиками в течение последних 3–х мес.
– иммуносупрессивные состояния, включая терапию глюкокортикостероидами
– тяжелые сочетанные заболевания [5].
Б) лечении ВП в стационаре –
При лечении ВП в стационаре левофлоксацин следует назначать в/в, рациональным представляется ступенчатый подход к лечению [8]: переход к пероральному назначению препарата после клинического улучшения состояния больного и микробиологической эрадикации возбудителя [6].
Комбинированное применение левофлоксацина с другими АБП:
1. Чучалин А.Г., Цой А.Н., Архипов В.В. с соавт. Пневмония с точки зрения доказательной медицины, М., 2000, с. 111.
2. Страчунский Л.С., Богданович Т.М. Состояние антибиотикорезистентности в России. В кн.: Антибактериальная терапия. Практическое руководство. Под редакцией Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова; Москва, 2000, с. 7–11.
3. Козлов С.Н., Рачина С.А., Домникова Н.П. с соавт., Фармакоэпидемиологический анализ лечения внебольничной пневмонии в амбулаторных условиях. Клиническая микробиология и антимикробная химиотерапия, 2000; Том. 2(3): с. 74–81.
4. Bartlett, JG, Breiman, RF, Mandell, LA, File, TM, Jr. Community–acquired pneumonia in adults: Guidelines for management. Guidelines from the Infectious Disease Society of America. Clin Infect Dis 1998; 26:811.
5. Guidelines for the Management of Adults with Community–acquired Pneumonia. Diagnosis, Assessment of Severity, Antimicrobial Therapy, and Prevention, Am J Respir Crit Care Med, 2001; Vol 163: 1730–1754
6. BTS Guidelines for the Management of CAP in adult, Thorax, 2001; 56 (sapi. 4).
1. Hooper D.C. Macrolides, Fluoroquinolones, and Aminoglycosides. Лекция, прочитанная в Massachusetts General Hospital 10 июля 2002.
8. Синопальников А.И., Дуганов В.К. Левофлоксацин: ступенчатая терапия внебольничной пневмонии у взрослых. РМЖ, 2001; том 9(15): с. 650–655.
9. Wise R, Honeybourne D: Pharmacokinetics and pharmacodynamics of fluoroquinolones in the respiratory tract. Eur Resp J, 1999; 14:221–229
10. Schentag J. and Tillotson G.S. Chest, 1997; 112(6 Suppl): 314–319.
11. Preston SL, Drusano GL, Berman AL, et al. Levofloxacin population pharmacokinetics and creation of a demographic model for prediction of individual drug clearance in patients with serious community–acquired infection. Antimicrob Agents Chemother 1998;42:1098–104
12. File TM et al. A multicenter, randomized study comparing the efficacy and safety of intravenous and/or oral levofloxacin versus ceftriaxone with community–acquired pneumonia 1997;41:1965–1972.
13. Norrby RS et al. A comparative study of levofloxacin and ceftriaxone in the treatment of hospitalized patients with pneumonia 1998;30:397–404.
14. Frank E, Liu J, Kinasewitz G, Moran GJ et. al. A multicenter, open–label, randomized comparison of levofloxacin and azithromycin plus ceftriaxone in hospitalized adults with moderate to severe community–acquired pneumonia. Clin Ther 2002 Aug;24(8):1292–308
15. Gotfried MH, Dattani D, Riffer E et. al. A controlled, double–blind, multicenter study comparing clarithromycin extended–release tablets and levofloxacin tablets in the treatment of community–acquired pneumonia. Clin Ther 2002 May;24(5):736–51
16. Sullivan JG et al. J Resp Dis 20(11 suppl):S49 (1999)
17. Bru JP. Update on the role of levofloxacin in the management of acute community–acquired pneumonia. Presse Med 2002 Jun 15;31(21 Pt 2):S19–22
18. Ball P, Mandell L, Niki Y, et al: Comparative tolerability of the newer fluoroquinolone antibacterials. Drug Saf 21:407–421, 1999
19. Breen J, Skuba K, Grasela D: Safety and tolerability of gatifloxacin, an advanced third–generation, 8–methoxy fluoroquinolone. J Respir Dis 20:S70–S76, 1999 (suppl 11).
20. Bartlett, JG, Breiman, RF, Mandell, LA, File, TM, Jr. Community–acquired pneumonia in adults: Guidelines for management. Guidelines from the Infectious Disease Society of America. Clin Infect Dis 1998; 26:811.
21. George, J, Morrissey, I. The bactericidal activity of levofloxacin compared with ofloxacin, D–ofloxacin, ciprofloxacin, sparfloxacin and cefotaxime against Streptococcus pneumoniae. J Antimicrob Chemother 1997; 39:719.
22. Klugman, KP, Gootz, TD. In–vitro and in–vivo activity of trovafloxacin against Streptococcus pneumoniae. J Antimicrob Chemother 1997; 39 Suppl B:51.
23. Hoogkamp–Korstanje, JA. In–vitro activities of ciprofloxacin, levofloxacin, lomefloxacin, ofloxacin, pefloxacin, sparfloxacin and trovafloxacin against gram–positive and gram–negative pathogens from respiratory tract infections. J Antimicrob Chemother 1997; 40:427.
24. From the Food and Drug Administration. First drug for penicillin–resistant community–acquired pneumonia. JAMA 2000; 283:1679.
25. Community–Acquired Pneumonia (CAP) Year 2002. Antibiotic Selection and Management Update. Evaluation, Risk Stratification, and Current Antimicrobial Treatment Guidelines for Hospital–Based Management of CAP: Outcome–Effective Strategies Based on New NCCLS Breakpoints and Recent Clinical Studies – The ASCAP Panel Consensus Report, 2002, CLINICAL UPDATE; MARCH 1, 2002