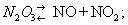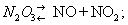Что такое окислы азота
Азота окислы
Полезное
Смотреть что такое «Азота окислы» в других словарях:
Окислы азота — Смесь различных окислов азота, кроме закиси NO2, образовавшихся в цилиндре дизеля в процессе сгорания Источник: ГОСТ 24585 81: Дизел … Словарь-справочник терминов нормативно-технической документации
ОКИСЛЫ — ОКИСЛЫ, соединения элементов с кислородом. Кислород соединяется со всеми элементами кроме благородных газов. Недавно открытая юкись фтора заполняет существовавший в отношении фтора пробел. В зависимости от степени окисления и валентности элемента … Большая медицинская энциклопедия
Окислы азота (NOх) — 5. Окислы азота (NOх) Смесь окиси и двуокиси азота, содержащихся в пробе газа Примечание. В расчетах условно предполагается, что окись азота находится в виде двуокиси азота Источник … Словарь-справочник терминов нормативно-технической документации
Окислы азота — С кислородом азот образует ряд соединений N2O5 азотный ангидрид [О над азотной кислоте см. Крепкая водка.], N2O4 или NO2 азотноватый ангидрид или двуокись азота, N2O3 азотистый ангидрид, NO окись азота, N2O закись азота. Определения Фавра,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Окислы азота — Оксиды азота соединения азота с кислородом. Содержание 1 Список оксидов 2 N2O 3 NO 4 N2O3(III) 5 NО2, N2O4 … Википедия
Окислы — Оксид (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам… … Википедия
Окислы азота и азотная кислота — 4.6. Окислы азота и азотная кислота оказывают в основном вредное влияние на активную массу отрицательных электродов, окисляя свинец в окись. Окись свинца, в свою очередь, вступая в реакцию с оставшейся неиспользованной кислотой, образует… … Словарь-справочник терминов нормативно-технической документации
Окислы — О. называются соединения простых тел с кислородом. Если придерживаться деления простых тел на две группы, на металлы и металлоиды (см.), то вообще в характере их О. можно заметить довольно ясную разницу. Тогда как типические представители первой… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Закись азота — веселящий газ, один из окислов азота (см. Азота окислы); в медицине применяют в смеси с кислородом как средство для ингаляционного Наркоза при хирургических операциях, родах, иногда при инфаркте миокарда. Назван веселящим газом английским … Большая советская энциклопедия
Закись азота — химический состав см. Окислы азота. В медицине З. азота получила название веселящего газа: вдыхаемая в смеси с атмосферным воздухом или кислородом при обыкновенной температуре и давлении она вызывает особое состояние опьянения, уничтожающего… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Окислы азота
Оксиды азота — соединения азота с кислородом.
Содержание
Список оксидов
Азот образует несколько соединений с кислородом:
Оксид азота N2O — бесцветный газ со слабым запахом, растворим в воде. Не взаимодействует с водой, растворами кислот и щелочей. При нагревании разлагается на азот и кислород. При высоких концентрациях N2O возбуждает нервную систему («веселящий газ»). В медицине N2O применяют как слабое средство для наркоза.
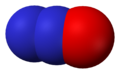
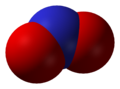
Оксид азота NO — бесветный газ, незначительно растворим в воде. Не взаимодействует с водой, растворами кислот и щелочей. Оксид азота (II) — очень реакционноспособное соединение, может вступать в реакции присоединения с рядом солей (нитрозосоли), с галогенами (напр., нитрозилхлорид NOCl), органическими соединениями. При обычной температуре NO соединяется с кислородом с образованием NO2. Оксид NO получают каталитическим окислением при производстве азотной кислоты.
N2O3(III)
Оксид N2O3 (азотистый ангидрид) неустойчив при обычных условиях, взаимодействует с водой, образуя азотистую кислоту HNO2.
NО2, N2O4
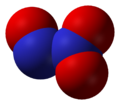
Оксид азота NО2 — бурый газ, токсичен, тяжелее воздуха, легко сжижается. При комнатной температуре NО2 находится в смеси с его бесцветным димером N2O4, приблизительно 1:1. Взаимодействует с водой:
Сильный окислитель. Многие вещества (уголь, сера, фосфор, органические соединения) могут гореть в NО2. Этот оксид окисляет SО2 до SO3, на этой реакции основан нитрозный метод получения серной кислоты. Раздражает дыхательные пути, при больших концентрациях появляется отёк легких.
N2O5(V)
Оксид N2O5 (азотный ангидрид) — бесцветное кристаллическое вещество, легко разлагается на NО2 и О2. Сильный окислитель. В воде легко растворяется с образованием азотной кислоты HNO3.
Воздействие на организм
Применение
Оксиды азота зарегистрированы в качестве пищевой добавки E918.
См.также
Полезное
Смотреть что такое «Окислы азота» в других словарях:
Окислы азота — Смесь различных окислов азота, кроме закиси NO2, образовавшихся в цилиндре дизеля в процессе сгорания Источник: ГОСТ 24585 81: Дизел … Словарь-справочник терминов нормативно-технической документации
Окислы азота — С кислородом азот образует ряд соединений N2O5 азотный ангидрид [О над азотной кислоте см. Крепкая водка.], N2O4 или NO2 азотноватый ангидрид или двуокись азота, N2O3 азотистый ангидрид, NO окись азота, N2O закись азота. Определения Фавра,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Окислы азота (NOх) — 5. Окислы азота (NOх) Смесь окиси и двуокиси азота, содержащихся в пробе газа Примечание. В расчетах условно предполагается, что окись азота находится в виде двуокиси азота Источник … Словарь-справочник терминов нормативно-технической документации
Окислы азота и азотная кислота — 4.6. Окислы азота и азотная кислота оказывают в основном вредное влияние на активную массу отрицательных электродов, окисляя свинец в окись. Окись свинца, в свою очередь, вступая в реакцию с оставшейся неиспользованной кислотой, образует… … Словарь-справочник терминов нормативно-технической документации
ОКИСЛЫ — ОКИСЛЫ, соединения элементов с кислородом. Кислород соединяется со всеми элементами кроме благородных газов. Недавно открытая юкись фтора заполняет существовавший в отношении фтора пробел. В зависимости от степени окисления и валентности элемента … Большая медицинская энциклопедия
Азота окислы — соединения азота с кислородом. Известны N2O, NO, N2O3, NO2 (и его димер N2O4), N2O5; есть сведения о существовании NO3, не выделенного в свободном состоянии. При высокой температуре в пламени вольтовой дуги, а в природе при электроразряде … Большая советская энциклопедия
Окислы — Оксид (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам… … Википедия
Окислы — О. называются соединения простых тел с кислородом. Если придерживаться деления простых тел на две группы, на металлы и металлоиды (см.), то вообще в характере их О. можно заметить довольно ясную разницу. Тогда как типические представители первой… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Закись азота — химический состав см. Окислы азота. В медицине З. азота получила название веселящего газа: вдыхаемая в смеси с атмосферным воздухом или кислородом при обыкновенной температуре и давлении она вызывает особое состояние опьянения, уничтожающего… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Закись азота — веселящий газ, один из окислов азота (см. Азота окислы); в медицине применяют в смеси с кислородом как средство для ингаляционного Наркоза при хирургических операциях, родах, иногда при инфаркте миокарда. Назван веселящим газом английским … Большая советская энциклопедия
Азота окислы
Аз о та о кислы, соединения азота с кислородом. Известны N2O, NO, N2O3, NO2 (и его димер N2O4), N2O5; есть сведения о существовании NO3, не выделенного в свободном состоянии. При высокой температуре в пламени вольтовой дуги, а в природе — при электроразряде из смеси азота с кислородом образуется окись азота NO, которая при охлаждении переходит в NO2. Другие азота окислы получают косвенным путём. N2O5 — твёрдое вещество; остальные окислы при обычных условиях газообразны.
Азотистый ангидрид (трёхокись азота) N2O3 — в обычных условиях неустойчивое соединение. Разлагается уже при 0°С:
Около 3,5°С кипит с разложением, при 25°C содержит только 10% недиссоциированного N2O3. При низкой температуре может быть получен в виде тёмно-голубой жидкости, при сильном охлаждении — светло-голубой массы с tпл —102°С. С водой образует азотистую кислоту: N2O3 + H2O = 2HNO2, со щелочами — соли (см. Нитриты). N2O3 получают по реакции: N2O4+ 2NO = 2N2O3; практического применения не находит.
Азотный ангидрид (пятиокись азота) N2O5 — бесцветные очень летучие кристаллы. Крайне неустойчив и взрывоопасен. Взаимодействует с водой, давая азотную кислоту: N2O5 +Н2O = 2HNO3, со щелочами образует соли — нитраты. В лаборатории получают по реакции: 2HNO3 + P2O5 = N2O5+ 2HPO3. Практического применения не находит. Все азота окислы физиологически активны.
Окислы азота
ОКИСЛЫ АЗОТА ЧТО ЭТО

Закись азота N2O. Закись азота получается при нагревании нитрата аммония:
При этой реакции один из атомов азота, входящих в состав NH4NO3, теряет электроны, а другой — приобретает их, причем оба атома азота становятся положительно одновалентными.
Закись азота что такое
Закись азота представляет собой бесцветный, не имеющий запаха газ, сгущающийся в жидкость при 0° под давлением 30 ат. Она довольно хорошо растворима в воде: при 0° один объем воды растворяет 1,3, а при 25° — 0,6 объема N2O. При растворении закись азота никакого соединения с водой не образует.
Закись азота — эндотермическое соединение, легко разлагающееся при нагревании на азот и кислород:
поэтому она хорошо поддерживает горение. Тлеющая лучинка, опущенная в закись азота, вспыхивает в ней, как в чистом кислороде; фосфор, сера и другие вещества также энергично сгорают в закиси азота, освобождая азот.
Закись азота для чего
Вдыхание небольших количеств закиси азота приводит к притуплению болевой чувствительности, вследствие чего этот газ иногда применяют в смеси с кислородом для наркоза при легких операциях. Большие количества закиси азота возбуждающе действуют на нервную систему; поэтому раньше ее называли «веселящим газом».
Азот оксид

Образование окиси азота при электрическом разряде может быть иллюстрировано следующим опытом. В большую колбу (рис.) через боковые горла вставляют на пробках две толстые медные проволоки и соединяют их с полюсами большой индукционной катушки. При пропускании через катушку тока между концами проволок образуется непрерывная искра, а над ней появляется желтоватое пламя «горящего» в кислороде азота.
Реакция образования окиси азота из азота и кислорода обратима и сопровождается поглощением большого количества тепла:
При низкой температуре равновесие этой реакции практически полностью сдвинуто влево, т. е, количество образующейся окиси азота ничтожно мало. С повышением температуры равновесие начинает смещаться вправо, и о так медленно, что даже при 1000° в смеси газов содержится всего лишь около 1% окиси азота. При понижении температуры окись азота снова разлагается на азот и кислород.
Но если очень быстро охладить газовую смесь, то равновесие не успевает сразу сместиться, а потом уже не смещается вследствие крайне малой скорости реакции при низкой температуре, и таким образом, в смеси остается почти то же количество NO, которое образовалось при высокой температуре. В лаборатории окись азота получают обычно взаимодействием разбавленной азотной кислоты с медью:
или в ионной форме
3Cu + 2NO3‘ + 8H • = 3Cu •• + 2NO + 4H2O
Газ no или окись азота представляет собой бесцветный газ, очень трудно сжижаемый. Жидкая окись азота кипит при —151,8° и затвердевает при —163,7°
В воде она растворима лишь незначительно один объем воды растворяет при 0 ° всего 0,07 объема NO газа.
По химическим свойствам окись азота относится к числу безразличных окислов, так как не образует никакой кислоты.
Окись азота труднее других окислов азота отдает свой кислород. Поэтому в ней могут гореть лишь такие вещества, которые особенно энергично соединяются с кислородом, как, например, фосфор. Но зажженная свеча, лучинка, сера гаснут при внесении их в окись азота.
Наиболее характерным свойством окиси азота является ее способность легко, без всякого нагревания, соединяться с кислородом с образованием бурой двуокиси азота:
Если, например, открыть цилиндр, наполненный окисью азота, то у отверстия его тотчас же появляется бурое облако двуокиси азота.
Двуокись азота
Изменение окраски двуокиси азота при повышении температуры сопровождается и изменением плотности ее пара. При низкой температуре плотность пара приблизительно отвечает удвоенной формуле N2O4. С повышением температуры плотность пара уменьшается и при 140 ° в точности соответствует формуле NО2— Отсюда следует, что бесцветные кристаллы, существующие при —10 ° и ниже, состоят, вероятно, целиком из молекул N2О4 и могут быть названы четырехокисью азота.
По мере нагревания бесцветная четырехокись азота постепенно диссоциирует с образованием молекул темно-бурой двуокиси азота N02; полная диссоциация происходит при 140°. Поэтому при температурах от —10° до + 140° всегда имеется смесь молекул NO2 и N2О4, находящихся в равновесии друг с другом:
Выше 140° начинается диссоциация NО2 на NO и кислород.
Двуокись азота очень энергичный окислитель. Многие вещества могут гореть в двуокиси азота, отнимая от нее кислород. Сернистый газ окисляется ею в серный ангидрид, на чем основан нитрозный метод получения серной кислоты.
Пары двуокиси азота довольно ядовиты. Вдыхание их вызывает сильное раздражение дыхательных путей и может привести к серьезному отравлению.
При растворении в воде двуокись или, вернее, четырехокись азота вступает в реакцию с водой, образуя азотную и азотистую кислоты:
Но азотистая кислота очень неустойчива и быстро разлагается на азотную кислоту, окись азота и воду:
Поэтому практически взаимодействие двуокиси (четырех окиси) азота с водой, особенно с теплой, идет по уравнению
которое легко может быть получено сложением двух предыдущих уравнений, если предварительно первое из них умножить на 3.
В присутствии воздуха образующаяся окись азота немедленно окисляется в двуокись азота, так что в этом случае NO2 полностью переходит в азотную кислоту. Эта реакция имеет важное техническое значение и используется в современных способах получения азотной кислоты.
Если растворять двуокись (четырехокись) азота в щелочах, то образуется смесь солей азотной и азотистой кислот:
Приведенные выше реакции взаимодействия четырехокиси азота с водой и щелочами показывают, что в молекуле этого вещества один атом азота имеет валентность +5, а другой — валентность +3. Поэтому четырехокись азота часто называют смешанным ангидридом азотистой и азотной кислот и изображают ее структурную формулу следующим образом:
Если мы подсчитаем общее число валентных электронов у всех атомов в молекулах N O и NO2, то найдем, что оно равно соответственно 11 (5 + 6) и 17 (5 + 2•6), т. е. выражается нечетными числами. Окись и двуокись азота относятся к ограниченному числу молекул с нечетным числом электронов. Такие молекулы ведут себя в химическом отношении, как свободные атомы, тоже имеющие неспаренные электроны. Молекулы с неспаренными электронами называются свободными радикалами.
Азотистый ангидрид N2 O 3
Представляет собой темно-синюю жидкость, кипящую при +4° и разлагающуюся при этом на окись и двуокись азота. Смесь равных объемов окиси и двуокиси азота при охлаждении вновь образует азотистый ангидрид:
Азотистому ангидриду соответствует азотистая кислота.
Азотный ангидрид N2O5 — твердое кристаллическое вещество, плавящееся при 30°. Он может быть получен действием фосфорного ангидрида на азотную кислоту:
Азотный ангидрид является очень сильным окислителем. Многие органические вещества при соприкосновении с ним воспламеняются. В воде азотный ангидрид легко растворяется с образованием азотной кислоты.
Вы читаете, статья на тему Окислы азота
Похожие страницы:
Понравилась статья поделись ей
Окислы азота
Смесь различных окислов азота, кроме закиси NO2, образовавшихся в цилиндре дизеля в процессе сгорания
Смотри также родственные термины:
5. Окислы азота (NOх)
Смесь окиси и двуокиси азота, содержащихся в пробе газа
Примечание. В расчетах условно предполагается, что окись азота находится в виде двуокиси азота
4.6. Окислы азота и азотная кислота оказывают в основном вредное влияние на активную массу отрицательных электродов, окисляя свинец в окись. Окись свинца, в свою очередь, вступая в реакцию с оставшейся неиспользованной кислотой, образует азотнокислую соль свинца и воду. Азотнокислая соль свинца при реагировании с серной кислотой превращается в сульфат свинца. При этом выделяется свободная азотная кислота и далее процесс повторяется, в результате чего растет количество сульфата на отрицательных электродах Воздействие азотистых соединений на положительные электроды менее заметно и приводит в основном к корродированию их основы, снижая механическую прочность электродов.
Во время каждого заряда часть азотной кислоты удаляется из электролита вместе с газами в виде двуокиси азота. Поэтому с течением времени ее количество в электролите уменьшается. Лечение аккумуляторов, электролит которых загрязнен примесями азотной кислоты, проводят аналогично описанному выше способу выведения из электролита примеси железа.
Полезное
Смотреть что такое «Окислы азота» в других словарях:
Окислы азота — С кислородом азот образует ряд соединений N2O5 азотный ангидрид [О над азотной кислоте см. Крепкая водка.], N2O4 или NO2 азотноватый ангидрид или двуокись азота, N2O3 азотистый ангидрид, NO окись азота, N2O закись азота. Определения Фавра,… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Окислы азота — Оксиды азота соединения азота с кислородом. Содержание 1 Список оксидов 2 N2O 3 NO 4 N2O3(III) 5 NО2, N2O4 … Википедия
Окислы азота (NOх) — 5. Окислы азота (NOх) Смесь окиси и двуокиси азота, содержащихся в пробе газа Примечание. В расчетах условно предполагается, что окись азота находится в виде двуокиси азота Источник … Словарь-справочник терминов нормативно-технической документации
Окислы азота и азотная кислота — 4.6. Окислы азота и азотная кислота оказывают в основном вредное влияние на активную массу отрицательных электродов, окисляя свинец в окись. Окись свинца, в свою очередь, вступая в реакцию с оставшейся неиспользованной кислотой, образует… … Словарь-справочник терминов нормативно-технической документации
ОКИСЛЫ — ОКИСЛЫ, соединения элементов с кислородом. Кислород соединяется со всеми элементами кроме благородных газов. Недавно открытая юкись фтора заполняет существовавший в отношении фтора пробел. В зависимости от степени окисления и валентности элемента … Большая медицинская энциклопедия
Азота окислы — соединения азота с кислородом. Известны N2O, NO, N2O3, NO2 (и его димер N2O4), N2O5; есть сведения о существовании NO3, не выделенного в свободном состоянии. При высокой температуре в пламени вольтовой дуги, а в природе при электроразряде … Большая советская энциклопедия
Окислы — Оксид (окисел, окись) соединение химического элемента с кислородом, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам… … Википедия
Окислы — О. называются соединения простых тел с кислородом. Если придерживаться деления простых тел на две группы, на металлы и металлоиды (см.), то вообще в характере их О. можно заметить довольно ясную разницу. Тогда как типические представители первой… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Закись азота — химический состав см. Окислы азота. В медицине З. азота получила название веселящего газа: вдыхаемая в смеси с атмосферным воздухом или кислородом при обыкновенной температуре и давлении она вызывает особое состояние опьянения, уничтожающего… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Закись азота — веселящий газ, один из окислов азота (см. Азота окислы); в медицине применяют в смеси с кислородом как средство для ингаляционного Наркоза при хирургических операциях, родах, иногда при инфаркте миокарда. Назван веселящим газом английским … Большая советская энциклопедия