Электропроводность что это в химии
Электропроводность растворов электролитов



Коллоквиум IV
ЭЛЕКТРОХИМИЯ
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Электропроводность растворов электролитов
Электролиты – вещества, растворы или расплавы которых обладают ионной проводимостью. По сравнению с металлами (сплавами металлов), проявляющими электронную проводимость и являющимися проводниками первого рода, электролиты относят к проводникам второго рода. Типичные проводники второго рода – это растворы кислот и оснований, расплавы и растворы солей. Так как все биологические жидкости и ткани организма обладают ионной проводимостью, то они относятся к растворам электролитов.
Важным свойством растворов электролитов является электрическая проводимость (электропроводность), которая характеризует их способность проводить электрический ток. Она является величиной, обратной электрическому сопротивлению. В свою очередь, сопротивление проводника любого вида R (согласно закону Ома) пропорционально его длине (l) и обратно пропорционально площади сечения (S):
 | (4.1) |
где ρ – удельное сопротивление, равное R при единичных длине и площади сечения проводника, Ом · м.
 | (4.2) |
Для характеристики электропроводности растворов электролитов чаще используют молярную электропроводность (λ, «ламбда»), т. е. электропроводность раствора, содержащего 1 моль электролита, помещенного между параллельными электродами, расположенными на расстоянии 1 м. «Рабочая» площадь электродов определяется объемом раствора. Молярная электропроводность связана с удельной электропроводностью следующим соотношением:
 | (4.3) |
гдеС – молярная концентрация раствора, моль/л; V – разведение (разбавление) раствора, т. е. объем раствора, в котором растворен один моль электролита, м 3 /моль.
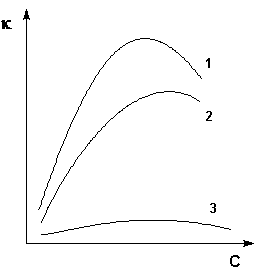
Электропроводность растворов зависит от ряда факторов: природы растворителя, вязкости и температуры среды, радиуса и концентрации ионов в растворе. На кривых зависимости удельной электропроводности от концентрации (рис. 4.1) обычно наблюдается максимум.
Рис. 4.1. Зависимость удельной электропроводности от концентрации
для некоторых электролитов
С увеличением концентрации раствора удельная электропроводность сначала растет за счет увеличения числа ионов, достигая максимального значения. При дальнейшем увеличении концентрации сильных электролитов межионное взаимодействие возрастает настолько сильно, что приводит к снижению скорости движения ионов и уменьшению величины удельной электропроводности раствора. В растворе слабых электролитов скорость движения ионов мало зависит от концентрации, однако с ее увеличением уменьшается степень диссоциации, что также приводит к снижению величины удельной электропроводности.
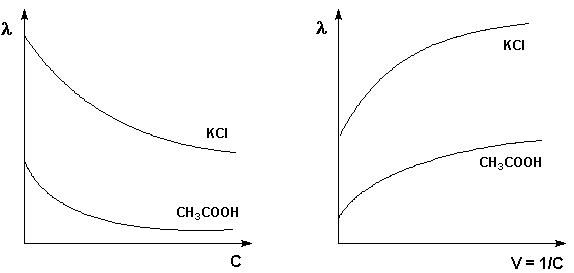
Молярная (эквивалентная) электропроводность растворов электролитов при разбавлении раствора (уменьшении концентрации) увеличивается (рис. 4.2), достигая при бесконечном разбавлении максимального постоянного значения.
Рис. 4.2. Зависимость молярной электропроводности от разбавления
для некоторых электролитов
Это значение является определенным для каждого электролита и называется эквивалентной электропроводностью при бесконечном разбавлении (обозначается 
 | (4.4) |
гдеА – константа (при данной температуре) для данного электролита и растворителя.
Электропроводность электролитов связана со скоростями движения ионов в растворе. В бесконечно разбавленном растворе достигается полная диссоциация молекул и взаимодействие между ионами отсутствует. Каждый из ионов движется независимо от других, и молярная (эквивалентная) электропроводность в таком случае может быть представлена как сумма электропроводностей ионов. Та часть электропроводности, которая приходится на ионы одного вида, называется подвижностью (l) иона.
Согласно закону Кольрауша о независимости движения ионов, величина l¥ равна сумме подвижностей катиона(l+¥)и аниона(l–¥):
 | (4.5) |
Физический смысл закона Кольрауша заключается в том, что в растворе электролита ионы переносят электрический ток независимо друг от друга.
Подвижности ионов связаны с абсолютными скоростями движения ионов (U):
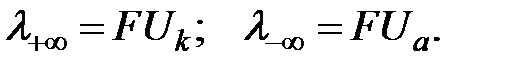 | (4.6) |
Предельные подвижности ионов водорода и гидроксид-ионов в водных растворах в несколько раз превышают подвижности других ионов. Это явление объясняется особым эстафетным механизмом их движения, согласно которому в кислой среде осуществляется перенос протона от иона гидроксония к соседней, соответствующим образом ориентированной молекуле воды:
 |
Аналогический перенос протона от молекулы воды к иону гидроксида происходит в щелочной среде:
 |
В растворах слабых электролитов молярная электропроводность при данном разбавлении ( 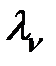
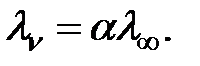 | (4.7) |
Степень диссоциации слабого электролита можно рассчитать по уравнению Аррениуса:
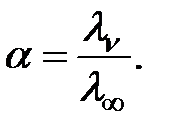 | (4.8) |
Значение 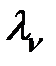

Кроме того, для слабых электролитов выполняется закон разведения Оствальда, который для бинарного электролита записывается следующим образом:
 | (4.9) |
Подставляя значение a в уравнение (4.9), получают еще одну из форм закона разведения Оствальда для расчета константы диссоциации:
ЭЛЕКТРОПРОВОДНОСТЬ МЕТАЛЛОВ, ЖИДКОСТЕЙ И ГАЗОВ
В зависимости от величины электропроводности вещества можно условно разделить на три группы: проводники, диэлектрики и полупроводники. Однако, провести четкие границы между группами невозможно.
Полупроводники имеют проводящие свойства средние между проводниками и диэлектриками. К полупроводникам относятся, например, германий, кремний, селен и другие искусственные соединения. [3]
На электропроводность вещества или тела влияет температура вещества. Однако, зависимость от температуры различная у разных веществ. У металлов данная зависимость определяется уменьшением времени свободного пробега электронов с ростом температуры. При увеличении температуры происходит возрастание тепловых колебаний кристаллической решетки, на которой рассеиваются электроны и соответственно электропроводность уменьшается. Для полупроводников зависимость иная. При повышении температуры электропроводность увеличивается, так как увеличивается число электронов проводимости и положительных носителей заряда. Диэлектрики также имеют увеличенную электропроводность, но при очень высоком электрическом напряжении. [2]
Металлы имеют свойство проводить ток. Это обусловлено тем, что электромагнитное поле воздействует на проводниковый металл, в следствие чего электрон ускоряется настолько, что теряет связь с атомом.
Плотность тока, проходящая через проводник будет равна общему заряду всех электронов, проходящих за одну секунду через единицу площади поперечного сечения проводника.
Плотность тока выражается формулой:
— значение направления плотности тока;
— значение направления напряженности электрического поля.
Электропроводность некоторых металлов представлена в таблице 1.
Таблица 1 – «Электропроводность металлов»
Электропроводность что это в химии
10. Электропроводность растворов электролитов
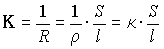
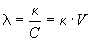
Эквивалентная электропроводность 

В разбавленных растворах сильных электролитов выполняется эмпирический закон Кольрауша (закон квадратного корня):
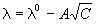
В растворах слабых электролитов 


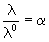
Кроме того, выполняется закон разведения Оствальда, который для бинарного электролита записывается следующим образом:
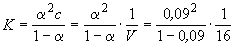

Согласно закону Кольрауша о независимой миграции ионов, эквивалентная электропроводность раствора при бесконечном разведении равна сумме предельных подвижностей катионов и анионов:



Доля тока, переносимая данным ионом, называется числом переноса ti иона:
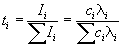
причем по определению 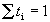
Согласно закону Стокса, предельная подвижность 
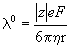

Из этого уравнения следует правило Вальдена-Писаржевского, согласно которому для любого иона или электролита:
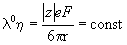









10-6. Какую долю общего тока переносит ион Li + в водном растворе LiBr при 25 o C? (ответ)
10-8. Рассчитать скорость движения иона Rb + в водном растворе при 25 o C, если разность потенциалов 35 В приложена к электродам, находящимся на расстоянии 0.8 см друг от друга. (ответ)
10-9. Рассчитать скорость движения иона Na + в водном растворе при 25 o C, если разность потенциалов 10 В приложена к электродам, находящимся на расстоянии 1 см друг от друга. Сколько времени понадобится иону, чтобы пройти расстояние от одного электрода до другого?(ответ)
10-13. Оценить предельную подвижность иона K + в формамиде и метилацетате, если вязкость формамида в 3.7 раз больше, а вязкость метилацетата в 2.6 раз меньше, чем вязкость воды. (ответ)


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
СОДЕРЖАНИЕ
Единицы
СИ единицей проводимости является S / м и, если иное квалификацию, он не относится к 25 ° C. Чаще встречается традиционная единица измерения мкСм / см.
Преобразование проводимости в общее количество растворенных твердых веществ зависит от химического состава образца и может варьироваться от 0,54 до 0,96. Как правило, преобразование выполняется, предполагая, что твердым веществом является хлорид натрия, т.е. 1 мкСм / см в этом случае эквивалентно примерно 0,64 мг NaCl на кг воды.
Измерение
На рынке имеется широкий выбор приборов. Чаще всего используются два типа электродных датчиков: электродные датчики и индукционные датчики. Электродные датчики со статической конструкцией подходят для низкой и средней проводимости и существуют в различных типах, с 2 или 4 электродами, где электроды могут быть расположены напротив друг друга, плоские или в цилиндре. Электродные ячейки с гибкой конструкцией, в которой расстояние между двумя противоположно расположенными электродами может варьироваться, обеспечивают высокую точность и также могут использоваться для измерения высокопроводящих сред. Индуктивные датчики подходят для жестких химических условий, но требуют большего объема пробы, чем электродные датчики. Датчики проводимости обычно калибруются растворами KCl с известной проводимостью. Электролитическая проводимость сильно зависит от температуры, но многие коммерческие системы предлагают автоматическую температурную коррекцию. Таблицы эталонных проводимостей доступны для многих распространенных решений.
Определения
Сопротивление R пропорционально расстоянию l между электродами и обратно пропорционально площади поперечного сечения образца A ( обозначено буквой S на рисунке выше). Записывая ρ (rho) для удельного сопротивления (или удельного сопротивления ),
Удельная проводимость (проводимость) κ (каппа) обратно пропорциональна удельному сопротивлению.
Теория
Сильные электролиты
Сильные электролиты предположили диссоциируют полностью в растворе. Электропроводность раствора сильного электролита при низкой концентрации подчиняется закону Кольрауша.
Однако по мере увеличения концентрации проводимость больше не увеличивается пропорционально. Более того, Кольрауш также обнаружил, что предельная проводимость электролита;
В следующей таблице приведены значения предельной молярной проводимости для некоторых выбранных ионов.
Интерпретация этих результатов была основана на теории Дебая и Хюккеля, что привело к теории Дебая-Хюккеля-Онзагера:
Слабые электролиты
Различные растворители демонстрируют одинаковую диссоциацию, если отношение относительных диэлектрических проницаемостей равно отношению кубических корней концентраций электролитов (правило Вальдена).
Более высокие концентрации
Существование так называемого минимума проводимости в растворителях с относительной диэлектрической проницаемостью ниже 60 оказалось спорным вопросом с точки зрения интерпретации. Фуосс и Краус предположили, что это вызвано образованием ионных триплетов, и это предположение недавно получило некоторую поддержку.
Системы смешанных растворителей
Проводимость в зависимости от температуры
Обычно проводимость раствора увеличивается с повышением температуры, так как подвижность ионов увеличивается. Для сравнения эталонные значения приведены при согласованной температуре, обычно 298 K (≈ 25 ° C или 77 ° F), хотя иногда используется 20 ° C (68 ° F). Так называемые «компенсированные» измерения выполняются при удобной температуре, но сообщаемое значение является расчетным значением ожидаемого значения проводимости раствора, как если бы оно было измерено при эталонной температуре. Базовая компенсация обычно выполняется, предполагая, что линейное увеличение проводимости в зависимости от температуры обычно составляет 2% на Кельвин. Это значение широко применимо для большинства солей при комнатной температуре. Определить точный температурный коэффициент для конкретного раствора просто, и приборы, как правило, могут применять производный коэффициент (т.е. отличный от 2%).
Изотопный эффект растворителя
Изменение проводимости из-за изотопного эффекта для дейтерированных электролитов является значительным.
Приложения
Несмотря на сложность теоретической интерпретации, измеренная проводимость является хорошим индикатором присутствия или отсутствия проводящих ионов в растворе, и измерения широко используются во многих отраслях промышленности. Например, измерения электропроводности используются для контроля качества воды в коммунальном водоснабжении, больницах, котельной и других отраслях промышленности, которые зависят от качества воды, например, в пивоварении. Этот тип измерения не зависит от ионов; иногда его можно использовать для определения общего количества растворенных твердых веществ (TDS или TDS), если известны состав раствора и его поведение проводимости. Измерения проводимости, проводимые для определения чистоты воды, не будут реагировать на непроводящие загрязнения (многие органические соединения попадают в эту категорию), поэтому в зависимости от области применения могут потребоваться дополнительные испытания на чистоту.
Иногда измерения проводимости связаны с другими методами, чтобы повысить чувствительность обнаружения определенных типов ионов. Например, в технологии котловой воды продувка котла постоянно контролируется на предмет «катионной проводимости», то есть проводимости воды после того, как она прошла через катионообменную смолу. Это чувствительный метод контроля анионных примесей в котловой воде в присутствии избытка катионов (в составе подщелачивающего агента, обычно используемого для обработки воды). Чувствительность этого метода зависит от высокой подвижности H + по сравнению с подвижностью других катионов или анионов. Помимо катионной проводимости, существуют аналитические инструменты, предназначенные для измерения проводимости по дегазации, где проводимость измеряется после удаления растворенного диоксида углерода из образца путем повторного кипячения или динамической дегазации.
Электропроводность что это в химии
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
3.4 ЭЛЕКТРОПРОВОДНОСТЬ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
3.4.1 Удельная электропроводность растворов электролитов
Электрический ток есть упорядоченное перемещение заряженных частиц. Растворы электролитов обладают ионной проводимостью (являются т.н. проводниками второго рода), т.е. электропроводность растворов электролитов обусловлена перемещением ионов в электрическом поле (в отличие от электронной проводимости проводников первого рода).
Всякий проводник, по которому течет ток, представляет для него определенное сопротивление R, которое, согласно закону Ома, прямо пропорционально длине проводника l и обратно пропорционально площади сечения S; коэффициентом пропорциональности является удельное сопротивление материала ρ – сопротивление проводника, имеющего длину 1 см и сечение 1 см 2 :
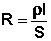
Величина удельной электропроводности электролита зависит от ряда факторов: природы электролита, температуры, концентрации раствора. Удельная электропроводность растворов электролитов (в отличие от электропроводности проводников первого рода) с увеличением температуры возрастает, что вызвано увеличением скорости движения ионов за счет понижения вязкости раствора и уменьшения сольватированности ионов. Зависимость удельной электропроводности от концентрации раствора представлена на рис. 3.9.
Рис. 3.9 Зависимость удельной электропроводности электролитов от концентрации
(1 – H2SO4, 2 – KOH, 3 – CH3COOH)
Как видно из рисунка, с увеличением концентрации удельная электропроводность растворов сначала возрастает, достигая некоторого максимального значения, затем начинает уменьшаться. Эта зависимость очень чётко выражена для сильных электролитов и значительно хуже для слабых. Наличие максимума на кривых объясняется тем, что в разбавленных растворах сильных электролитов скорость движения ионов мало зависит от концентрации, и κ сначала растет почти прямо пропорционально числу ионов; с ростом концентрации усиливается взаимодействие ионов, что уменьшает скорость их движения. Для слабых электролитов наличие максимума на кривой обусловлено тем, что с ростом концентрации уменьшается степень диссоциации, и при достижении определенной концентрации число ионов в растворе начинает увеличиваться медленнее, чем концентрация. Для учета влияния на электрическую проводимость растворов электролитов их концентрации и взаимодействия между ионами введено понятие молярной электропроводности раствора.
3.4.2 Молярная электропроводность растворов электролитов
Молярная электропроводность раствора λ есть величина, обратная сопротивлению раствора, содержащего 1 моль растворенного вещества и помещенного между электродами, расположенными на расстоянии 1 см друг от друга. С удельной электропроводностью κ и молярной концентрацией раствора С молярная электропроводность связана следующим соотношением:
Молярная электропроводность как сильных, так и слабых электролитов увеличивается с уменьшением концентрации (т.е. увеличением разведения раствора V = 1/С), достигая некоторого предельного значения λ o, называемого молярной электропроводностью при бесконечном разведении (рис. 3.10 – 3.11).
Рис. 3.10 Зависимость молярной Рис. 3.11 Зависимость молярной
электропроводности от концентрации. электропроводности от разведения
Для слабого электролита такая зависимость молярной электропроводности от концентрации обусловлена в основном увеличением степени диссоциации с разбавлением раствора. В случае сильного электролита с уменьшением концентрации ослабляется взаимодействие ионов между собой, что увеличивает скорость их движения и, следовательно, молярную электропроводность раствора. Последнюю связывает с абсолютными скоростями движения катионов и анионов U+ и U– уравнение Аррениуса (III.35):
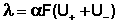
Ф. Кольрауш показал, что в молярную электропроводность бесконечно разбавленных растворов электролитов каждый из ионов вносит свой независимый вклад, и λ o является суммой молярных электропроводностей катиона и аниона λ + и λ – (т.н. подвижностей ионов), и сформулировал закон независимости движения ионов :
Молярная электропроводность при бесконечном разведении равна сумме электролитических подвижностей катиона и аниона данного электролита.
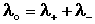
Подставив в это выражение уравнение Аррениуса (III.35) и приняв, что при бесконечном разведении степень диссоциации α равна единице, получим:
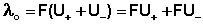
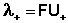
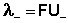
Электролитическая подвижность является важнейшей характеристикой иона, отражающей его участие в электропроводности раствора.