Меконий в околоплодных водах это что
Меконий новорождённых. Почему он попадает в околоплодные воды
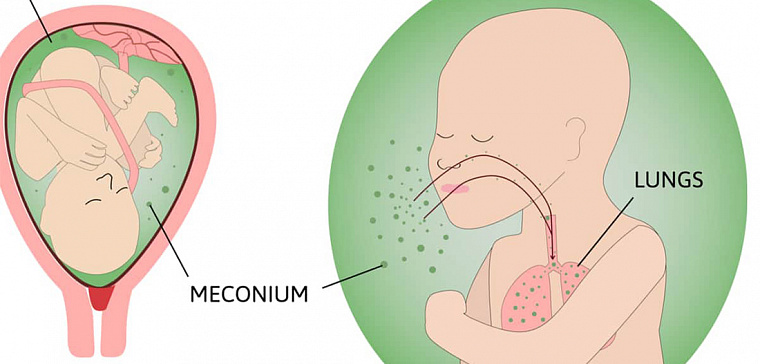
З доровые околоплодные воды выглядят как вода – чистая, прозрачная и без запаха. Зелень в водах появляется из-за мекония – первородного кала малыша. Околоплодные воды не всегда имеют окрашивание, иногда они и не зелёные, и не прозрачные, а молочного цвета.
В первые дни после родов молодых мам может испугать цвет и консистенция содержимого подгузника их малышей.
Меконий – первородный кал, состоящий из желчи, околоплодных вод, волос, слизи, жира, оранжевого пигмента – билирубина. И при всём неприглядном описании этот кал почти стерилен, не имеет неприятного запаха.
За пару дней после рождения кишечник новорождённого полностью высвобождается, и стул становится желтоватым с кислым запахом.
Грудное молоко имеет лёгкий послабляющий эффект, и меконий выходит быстро, если малыш сразу после рождения попробовал молозиво и рано начал питаться маминым молоком.
Заметим, что первородный кал липкий, его нужно будет смывать водой с мылом, возможно, детским маслом, оттирать с некоторым усилием.
Меконий обязательно должен отойти в первые сутки после рождения. В противном случае можно заподозрить какую-либо патологию ЖКТ, аномалию проходимости или недоразвитие волокон кишечника. Существует синдром мекониевой пробки, характерный в т.ч. для детей матерей с сахарным диабетом.
Через пару суток после рождения при этом состоянии младенец становится беспокойным, срыгивает, плохо спит и ест, не какает, у него вздувается живот. При отсутствии должного лечения развивается интоксикация. Нужна срочная медицинская помощь.
Меконий в утробе копится понемногу, по капле, его мало, и он не требует выхода до рождения. Но если всё-таки, по какой-то причине, первородный кал выходит в околоплодные воды, это очень ухудшает картину вынашивания и родов, состояние здоровья ребёнка.
Воды обычно загрязняются незадолго до родов или в родах.
Почему ребёнок может «испачкать» околоплодные воды?
Если в начале родов околоплодные воды чистые, перинатальная смертность низкая. Если загрязнены, вероятность около 6%. Также увеличивается заболеваемость новорождённых.
Это происходит из-за стрессовых факторов: повышения давления у матери, гипоксии плода, болезней беременной, обвития пуповины и пр. Чаще опорожняются в воды крупные малыши, а не маленькие. Масса плода, у которого развивается подобная ситуация, обычно не менее 3500 кг.
Роженицы с загрязнёнными околоплодными водами рожают чуть дольше. И у них роды чаще приводят к оперативному родоразрешению, использованию акушерских щипцов, вакууму плода.
Чем более загрязнены воды, тем опасней ситуация для здоровья и даже жизни плода. Иногда можно выявить эту патологию по УЗИ, КТГ и необычному поведению ребёнка – излишне спокойному или, напротив, активному.
Если воды вышли, и они выглядят не очень здорово, может быть принято решение об оперативных родах, чтобы ускорить появление малыша на свет. Новорождённому, наглотавшемуся загрязнёнными водами, требуется искусственная вентиляция лёгких, реанимация. При нормальном ходе событий через пару дней малыш задышит самостоятельно и воссоединиться с матерью. Однако возможны некоторые задержки роста и развития из-за слабого аппетита.
Причины обструкции лёгких в процессе естественных родов из-за мекония точно не определены. Даже при хорошем состоянии роженицы это иногда случается – в среднем в 10% случаев головного предлежания.
«Чаще аспирационный синдром диагностируется сразу после рождения у переношенных малышей или детей с задержкой роста. Раньше 34 недели беременности такого не случается вовсе…Акт случайной дефекации плода, вероятно, происходит из-за растянутости кишечника или действия некоторых лекарств. Окрашивание околоплодных вод меконием может говорить о том, что состояние плода по биохимии и мониторному наблюдению угрожающее».
Меконий в водах становится причиной плохого состояния малыша или указывает на другие нарушения здоровья. Получается, он может быть или следствием, или причиной гипоксии. Спазмы сосудов усиливают перистальтику кишечника, сдавливание пуповины ведёт к пассажу мекония, а судорожные дыхательные движения плода из-за развивающейся гипоксии приводят к перемещению мекония в трахею новорождённого. Дыхательные пути закупориваются, и в течение 48 часов развивается пневмония.
При обвитии пуповины отхождение мекония в родах случается в более чем 70% случаев.
Есть связь между количеством мекония в околоплодных водах и оценкой новорождённого по шкале Апгар. Чем хуже ситуация с меконием, тем ниже Апгар. Возможны исследования pH вод или крови, и, если показатели ниже 7,20, рекомендовано оперативное родоразрешение. В ходе родов обычно следят за состоянием плода мониторно.
Чтобы предотвратить тяжёлые патологии дыхания у новорождённых, важно аккуратно вести роды, предполагая возможные осложнения и сразу после родов убрать из верхних дыхательных путей все загрязнения.
Синдром аспирации мекония
Синдром аспирации мекония – состояние острой дыхательной недостаточности вследствие внутриутробного попадания в легкие ребенка мекониальных масс с закупоркой просвета бронхов. Характерен синюшный оттенок кожи с рождения, тяжелое шумное дыхание с западением уступчивых мест груди. Состояние расценивается как тяжелое. Синдром аспирации мекония диагностируется на основании внешних признаков дыхательной недостаточности, физикального осмотра и рентгенографической картины. Лечение комплексное, направлено на механическое очищение бронхиального дерева, усиленную оксигенацию и борьбу с инфекционными осложнениями.
Общие сведения
Синдром аспирации мекония – поражение легких новорожденного с высокой вероятностью летального исхода. Смертность достигает 10%, связана с массивной аспирацией мекониальных масс и развитием септического состояния. Частицы первородного кала определяются в амниотической жидкости у 5-20% рожениц, однако заболевание возникает не всегда. Синдром аспирации мекония встречается с частотой около 2-4%. Обычно развивается у доношенных и переношенных детей, у недоношенных встречается реже в связи с особенностями нервной системы, практически исключающими пассаж мекония в околоплодные воды. Является одной из важнейших проблем современной педиатрии в связи с многофакторностью развития и трудностями терапии. В частности, нередко необходимо длительное нахождение ребенка на ИВЛ, что может служить дополнительной причиной развития резистентных к лечению пневмоний.
Причины синдрома аспирации мекония
Хотя этиология состояния продолжает изучаться, большинство исследователей склоняются к гипоксической природе синдрома аспирации мекония. Недостаток кислорода, который возник внутриутробно или в процессе родов, рефлекторно повышает тонус парасимпатической нервной системы. Одновременно происходит централизация кровоснабжения, то есть перераспределение крови с преимущественной циркуляцией в жизненно важных органах (сердце, легкие, мозг) в ущерб всем остальным органам и системам, в том числе кишечнику. Эти два фактора в сумме приводят к гипоксии сосудов брыжейки и рефлекторному расслаблению гладкой мускулатуры кишечника. Как следствие, происходит пассаж первородного кала в околоплодные воды с дальнейшим попаданием в легкие.
Существует большое количество возможных причин гипоксии. Чаще всего дефицит поступления кислорода связан с патологией плаценты, поскольку именно плацентарный кровоток является источником кислорода во внутриутробном периоде развития. Как правило, речь идет о хронической фетоплацентарной недостаточности, обусловленной соматическими заболеваниями матери (в частности, сахарным диабетом и артериальной гипертензией), патологией сосудов плаценты и т. д. Второй вариант – это патологии пуповины или механическое сдавление дыхательных путей (обвитие), что также запускает описанные выше механизмы, приводящие к появлению мекония в околоплодных водах. Определенную роль играет большой вес плода и малое количество амниотической жидкости.
Симптомы и диагностика синдрома аспирации мекония
Синдром аспирации мекония может развиваться с первых минут жизни или спустя несколько часов и даже дней после периода мнимого благополучия. Во многом это зависит от того, как долго малыш испытывал гипоксию, находясь в утробе матери. При раннем появлении симптомов ребенок начинает испытывать трудности с дыханием сразу после рождения. Малыш тяжело и шумно дышит, заметно западение надключичных ямок, межреберных промежутков и других уступчивых мест грудной клетки. Внешне ребенок цианотичный, беспокойный, в тяжелых случаях нервная система, наоборот, угнетена, и пациент выглядит заторможенным. При отсроченном начале синдрома аспирации мекония наблюдаются те же симптомы, но время их возникновения приходится на более поздний период.
Первичная диагностика возможна еще в процессе планового обследования во время беременности. Кардиотокография плода отчетливо показывает затруднение дыхания малыша, в подобных случаях необходимо дальнейшее обследование и поиск причин гипоксии, в частности – анализ амниотической жидкости для выявления в ней частиц мекония. Возможно решение вопроса о досрочном родоразрешении. В процессе интранатальной диагностики синдрома аспирации мекония обращает на себя внимание зеленоватый цвет околоплодных вод, иногда частицы мекония удается визуализировать. Также часто наблюдается зеленоватый цвет ногтей, кожи и пуповины малыша, что, как правило, свидетельствует в пользу длительной внутриутробной гипоксии и тяжелого течения синдрома аспирации мекония.
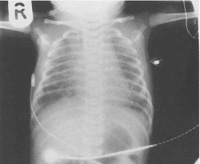
Аускультативно педиатр прослушивает разнокалиберные хрипы, при перкуссии легких участки приглушения чередуются с участками с коробочным звуком. Данные физикального осмотра подтверждаются рентгенографически. На снимке определяются участки ателектаза (спадания альвеол) и эмфиземы (патологического расширения дистальных отделов легких). Такая картина является следствием механической закупорки частицами мекония просвета мелких бронхов, а также вторичного воспалительного процесса, обусловленного токсичностью мекониальных масс. В тяжелых случаях на рентгенограмме обнаруживается так называемая «снежная буря», когда почти вся поверхность альвеол спадается, и остается множество эмфизематозно расширенных участков, неспособных обеспечить циркуляцию воздуха.
Лечение синдрома аспирации мекония
Если синдром аспирации мекония диагностируется еще до родов, то уже в процессе родоразрешения, когда рождается головка, необходимо произвести отсасывание специальным катетером Де Ли. Одна только эта манипуляция, выполненная как можно раньше, позволяет частично освободить верхние дыхательные пути и значительно улучшить оксигенацию. После рождения пациентам с синдромом аспирации мекония проводится лаваж (введение физиологического раствора в трахею с последующим отсасыванием до чистого отделяемого). При наличии выраженной дыхательной недостаточности показано подключение новорожденного к системе ИВЛ.
Важно учитывать, что к моменту подключения ИВЛ легкие должны быть очищены, поскольку в противном случае возможно продвижение оставшихся частиц мекония в дистальные отделы с последующим усугублением дыхательной недостаточности. С целью более быстрого расправления участков ателектаза назначается сурфактант, иногда – оксид азота. Обязательно применение антибиотиков, поскольку частым осложнением синдрома аспирации мекония является аспирационная пневмония. В наиболее тяжелых случаях выполняется экстракорпоральная мембранная оксигенация. Все манипуляции проводятся в отделении реанимации.
Прогноз и профилактика синдрома аспирации мекония
Основным фактором, провоцирующим развитие синдрома аспирации мекония, является внутриутробная гипоксия, поэтому все профилактические мероприятия проводятся в период беременности. Необходима своевременная диагностика и лечение фетоплацентарной недостаточности и соматических заболеваний матери. Стоит избегать перенашивания, которое также повышает риск синдрома аспирации мекония. Прогноз заболевания неблагоприятный. Летальность составляет 10%, выжившие дети в дальнейшем часто имеют хронические легочные патологии. Возможно отставание в развитии вследствие длительной гипоксии.
Меконий в околоплодных водах это что
При окрашивании околоплодных вод меконием и отсутствии других признаков внутриутробного страдания плода родах (изменения, по данным КТГ и КОС отсутствуют) роды ведут активно-выжидательно под тщательным кар-диомониторным контролем за состоянием плода и сократительной активностью матки, проводят ультразвуковой контроль дыхательной активности плода.
Л.Лампе (1979) с целью наблюдения и исследования околоплодных вод в родах рекомендуют в начале родовой деятельности через шейку матки ввести полиэтиленовую трубку диаметром 3 мм, длиной около 80 см, за предлежащую часть плода.
Роды ведут под тщательным обезболиванием с примененном спазмолитических средств. Предпочтительным методом обезболивания является эпидуральная анестезия.
При выявлении слабости родовой деятельности возможно применение окситоцина и простагландина. При наличии нерегулярных или регулярных эпизодических дыхательных движений целесообразно внутримыигечное введение роженице реланиума в дозе 10 мг (Тищенко Е.П., 2000). В случае выявления «густых» вод зеленого цвета и отсутствии дыхательной активности у плода, с целью профилактики аспирации мекония, возможно проведение амниоинфузии в родах с использованием изотонического раствора хлорида натрия (Моисеев В.П., Петраш В.В., Абрамчепко В.В., 1989; Тищенко Е.П., 2000; Strong T.J. et al„ 1991).
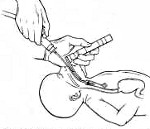
После рождения головки производится тщательное отсасывание содержимого носоглотки ребенка. При асфиксии и наличии «густого» мекония осуществляют эндотрахеалыюе отсасывание содержимого под контролем ларингоскопа; при необходимости проводят реанимационные мероприятия.
После родов необходимо продолжить постоянное наблюдение за ребенком и быть готовым к оказанию ургентной помощи.
Амниоскопия в настоящее время не нашла широкого применения в акушерской практике, хотя она является единственным и относительно простым методом диагностики наличия мекония в околоплодных водах во время беременности. В случае нарастания тяжести гипоксии плода может наблюдаться появление патологической дыхательной активности (особенно в родах), что способствует развитию синдрома аспирации мекония. При обнаружении мекония в амнио-тической жидкости показано использование других методов оценки состояния плода (КТГ, УЗИ, метод Допплера). В зависимости от состояния плода, срока беременности, готовности женского организма к родам выбирают адекватный метод родоразрешения.
Синдром аспирации мекония у новорожденных
Общая информация
Краткое описание
Российская ассоциация специалистов перинатальной медицины (РАСПМ)
Год утверждения: 2017 (пересмотр каждые 3 года)
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Этиология и патогенез
Эпидемиология
Околоплодные воды могут быть окрашены меконием в 8-20% всех родов [1, 2, 8, 9]. Причем после полных 42 недель частота достигает 23-52% [10, 11]. От 2 до 9% новорожденных, у которых воды были окрашены меконием, в последствие отмечается клиническая картина САМ [2, 12, 13]. Около трети новорожденных с САМ требуют интубации трахеи и механической вентиляции легких [13]. Летальность при САМ в связи с тяжелыми повреждениями паренхимы легких и развитием легочной гипертензии может превышать 20%. Другие осложнения, включая СУВ, встречаются у 10-30% детей с САМ [14].
Диагностика
Диагностика
— курение, наркомания (особенно, кокаин) [2].
Комментарии: Необходимо проводить дифференциальный диагноз с врожденной пневмонией.
Дифференциальный диагноз
— Транзиторным тахипноэ новорождённых и другими состояниями, сопровождающимися развитием дыхательной недостаточности в раннем неонатальном периоде.
Лечение
Рекомендуется дифференцированный подход к оказанию помощи в родильном зале новорожденным с околоплодными водами, содержащими меконий [26]. Акушеры должны заранее предупредить врачей-неонатологов, если околоплодные воды окрашены меконием и имеются признаки дистресса плода. Санация ротоглотки после рождения головки плода не снижает вероятности развития респираторного дистресс-синдрома или клинически выраженного синдрома мекониальной аспирации, включая подгруппы, где имело место наличие густого мекония, отмечались признаки дистресса у плода или родоразрешение выполнялось абдоминальным путем [19].
Комментарии: В случае отсутствия лаважа желудка в родильном зале при наличии мекония в околоплодных водах не зарегистрировано вторичных осложнений, связанных с регургитацией и/или аспирацией мекониального желудочного содержимого [29]. В то же время лаваж желудка рассматривается как потенциально опасная манипуляция, поскольку введение рото- или назогастрального зонда в родильном зале нередко сопровождается развитием апноэ и/или брадикардией [30].
Меконий в околоплодных водах это что
Целый ряд заболеваний и состояний новорожденных требует специализированной помощи. Многие из них можно диагностировать заранее, еще во внутриутробном периоде, и подготовиться к их лечению.
I. Примесь мекония в околоплодных водах. Меконий — это содержимое кишечника плода, первородный кал. Он имеет вязкую консистенцию и зеленый цвет, попадает в околоплодные воды вследствие внутриутробного отхождения. Примесь мекония в околоплодных водах наблюдается примерно в 10% всех родов, а при переношенной беременности — в 30—40%.
1. Легкое окрашивание меконием. Воды бледно-зеленого цвета, не содержат комочков мекония. Легкое окрашивание околоплодных вод меконием, как правило, не приводит к осложнениям у новорожденного и не требует лечения.
Б. Патогенез. Меконий состоит из слущенного эпителия кишечника, секрета желез ЖКТ и содержимого околоплодных вод, проглоченных плодом, — пушковых волос, чешуек эпидермиса и сыровидной смазки. Пока не установлено, всегда ли внутриутробное отхождение мекония обусловлено гипоксией или нет [1, 2]. При наличии других симптомов внутриутробной гипоксии окрашивание меконием околоплодных вод считают достоверным признаком этой патологии. При внутриутробной гипоксии у плода возникают глубокие судорожные вдохи, во время которых меконий вместе с околоплодными водами может попадать в легкие. В связи с этим при обнаружении окрашенных меконием околоплодных вод сразу после рождения производят тщательную санацию дыхательных путей. В противном случае развивается пневмонит, обструкция дыхательных путей с увеличением остаточного объема легких (эффект воздушной ловушки) и стойкая легочная гипертензия. Это состояние требует интенсивного лечения, включающего экстракорпоральную мембранную оксигенацию.
1. В течение пренатального и интранатального периодов состояние плода контролируют при помощи обычных методов. В зависимости от результатов обследования решают вопрос о сроке и методе родоразрешения.
а. При густом окрашивании меконием околоплодных вод для профилактики осложнений интраамниально вводят 1 л физиологического раствора. Это снижает риск аспирации мекония, а также необходимость кесарева сечения [3].
2. Ранний неонатальный период. Если воды густо окрашены меконием, у новорожденного развилась асфиксия или содержимое носо- и ротоглотки удалено не полностью, для удаления мекония из дыхательных путей проводят интубацию трахеи. Исследования показали, что после удаления мекония из глотки в 9% случаев его обнаруживают в трахее новорожденного [4]. В связи с этим интубацию трахеи проводят даже в том случае, когда ротоглотка полностью очищена от мекония и хорошо видна голосовая щель.
1) Новорожденного кладут на обогреваемый столик.
2) С помощью ларингоскопа с клинком размера 0 или 1 вводят эндотрахеальную трубку наибольшего подходящего диаметра. Для доношенных обычно используют трубки диаметром 3,5 или 4,0 мм. Чтобы улучшить обзор во время интубации трахеи, отсасывают содержимое гортанной части глотки катетером большого диаметра.
в. Интубация трахеи не обязательна, если мекония в околоплодных водах немного или он обнаружен только в задних водах, дыхание новорожденного нормальное, кожные покровы розовые, движения активные. При этом риск асфиксии и травмы во время интубации трахеи превышает возможную пользу от этой процедуры. Однако единого мнения относительно того, когда интубацию трахеи можно не проводить, пока нет [2, 5]. Большинство авторов считают, что интубация трахеи и санация дыхательных путей абсолютно показаны только при густом окрашивании околоплодных вод меконием.
II. Пневмоторакс — это скопление воздуха в плевральной полости. Пневмоторакс может привести к спадению легкого, развитию дыхательной недостаточности, а также к смещению органов средостения в сторону здорового легкого (при напряженном пневмотораксе). Во многих случаях пневмоторакс клинически не проявляется.
А. Распространенность среди детей, родившихся в срок, не превышает 1—2%. Заболевания органов дыхания заметно повышают риск пневмоторакса. Так, при преходящем тахипноэ пневмоторакс наблюдается у 10%, при болезни гиалиновых мембран — у 5—20%, а при аспирации мекония — у 20—50% новорожденных.
В. Клинические проявления, как правило, внезапны. Ухудшается состояние, возникает цианоз, реже — брадикардия и артериальная гипотония. При физикальном исследовании, хотя и не всегда, обнаруживают смещение верхушечного толчка. На стороне поражения ослаблено голосовое дрожание, хуже проводится дыхание, усилен перкуторный звук. В легких случаях пневмоторакс у новорожденного протекает бессимптомно. При подозрении на пневмоторакс проводят диафаноскопию. Если сквозь пораженную половину грудной клетки на значительном протяжении виден свет, для подтверждения диагноза назначают рентгеноскопию грудной клетки.
Г. Факторы риска и осложнения
2. При пневмотораксе у новорожденного могут возникнуть пневмомедиастинум, пневмоперикард, подкожная эмфизема и даже пневмоперитонеум.
1. В отсутствие клинических проявлений ограничиваются наблюдением. Воздух в плевральной полости обычно рассасывается самостоятельно.
2. При нарушениях дыхания и кровообращения незамедлительно проводят плевральную пункцию — иглой или сосудистым катетером (Angiocath). Затем устанавливают дренаж, подсоединенный к системе с односторонним клапаном.
3. Дренирование плевральной полости — наилучший метод лечения пневмоторакса при развитии нарушений дыхания и кровообращения. Дренажную трубку 10—12 F из поливинилхлорида устанавливают в четвертом межреберье по передней подмышечной линии, направляя ее внутренний конец кпереди.
Е. Прогноз зависит от тяжести сопутствующих заболеваний легких. При неосложненном пневмотораксе он, как правило, благоприятный. У недоношенных пневмоторакс может осложняться кровоизлиянием в желудочки мозга.
А. Распространенность. Грыжа Бохдалека встречается у 1 из 2500—4000 новорожденных. В 90% случаев грыжа левосторонняя. У мальчиков заболевание встречается в 2 раза чаще, чем у девочек.
Б. Патогенез. Грыжа Бохдалека развивается в результате несрастания плевроперитонеальных складок, образующих купол диафрагмы на 8—10-й неделе внутриутробного развития. Через образовавшийся щелевидный дефект диафрагмы (в области треугольника Бохдалека) органы брюшной полости перемещаются в грудную и сдавливают легкие. Развивается гипоплазия одного или обоих легких.
В. Клиническая картина. У новорожденного единственным проявлением заболевания могут быть дыхательные нарушения. Также могут наблюдаться ладьевидный живот, ослабление дыхания на стороне грыжи и смещение сердечного толчка вправо.
Г. Лечение. Немедленно интубируют трахею и начинают вентиляцию при помощи дыхательного мешка. Вентиляция через маску противопоказана, поскольку может осложниться вздутием кишечника и еще большим сдавлением легких. Ребенка немедленно переводят в отделение реанимации новорожденных.
Д. Прогноз неблагоприятный. Летальность достигает 30—50%. Причина смерти — дыхательная недостаточность. При тяжелой дыхательной недостаточности может потребоваться экстракорпоральная мембранная оксигенация. Разрабатываются методы внутриутробной хирургической коррекции порока.
IV. Пороки развития ЖКТ
А. Грыжа пупочного канатика формируется в результате недоразвития пупочного кольца и вышележащей части передней брюшной стенки. Если ширина грыжевых ворот не превышает 4 см, говорят о пупочной грыже. Дефект 4 см и более называют грыжей пупочного канатика.
1. Распространенность пупочной грыжи и грыжи пупочного канатика составляет 1 на 6000—10 000 новорожденных.
2. Патогенез. В норме передняя брюшная стенка плода остается незамкнутой до 10-й недели внутриутробного развития. Если в дальнейшем смыкания краев передней брюшной стенки не происходит и дефект сохраняется, образуется мешковидное выпячивание брюшины, содержащее внутренние органы, обычно петли кишечника.
3. Клиническая картина. В основании пуповины у новорожденного обнаруживают мешковидное расширение — грыжевой мешок. Сквозь прозрачные оболочки видны петли кишечника. Во время родов грыжевой мешок может разорваться.
5. Лечение. Ребенка немедленно переносят на обогреваемый столик и проводят основные реанимационные мероприятия. Грыжевой мешок закрывают стерильной марлей, смоченной теплым физиологическим раствором. Для защиты грыжевого мешка и для предотвращения потерь тепла и жидкости ребенка помещают в стерильный «конверт». Новорожденного срочно переводят в специализированное отделение для хирургического лечения.
6. Прогноз. В отсутствие других пороков развития благоприятный исход наблюдается более чем в 70% случаев. Если грыжа пупочного канатика сочетается с тяжелыми пороками сердца, погибают 80% детей.
Б. Незаращение передней брюшной стенки представляет собой открытый дефект, без грыжевого мешка. Выпавшие внутренние органы не покрыты ни брюшиной, ни пуповинными оболочками. Дефект обычно расположен правее пупка.
1. Распространенность составляет 1 на 20 000 новорожденных.
2. Патогенез точно не установлен. Вероятно, в основе заболевания лежит грыжа пупочного канатика, осложнившаяся разрывом грыжевого мешка, или дефект пупочно-брыжеечной артерии.
3. Клиническая картина. Размеры дефекта передней брюшной стенки бывают разными. Однако даже при небольшом дефекте может наблюдаться эвентрация значительной части органов брюшной полости, что повышает риск сдавления сосудов брыжеек.
4. Другие пороки развития. У 15—20% незаращение передней брюшной стенки сочетается с атрезией кишечника. 50% детей с незаращением передней брюшной стенки рождаются недоношенными.
5. Лечение. Лечение такое же, как при грыже пупочного канатика, однако операцию проводят в экстренном порядке.
6. Прогноз. Летальность достигает 10—30%. Как правило, в течение длительного времени требуется парентеральное питание.
В. Атрезия кишечника — это отсутствие просвета кишечной трубки на каком-либо из ее участков.
1. Распространенность атрезии кишечника составляет 1 на 1500 новорожденных.
2. Патогенез включает нарушение формирования просвета кишечной трубки либо недостаточное кровоснабжение ее участка в период органогенеза.
3. Клиническая картина. При атрезии верхних отделов ЖКТ плода (двенадцатиперстной или тощей кишки) беременность нередко сопровождается многоводием. Околоплодные воды окрашены желчью. При УЗИ плода обнаруживают вздутие желудка, а при атрезии тощей кишки — вздутие двенадцатиперстной кишки. У новорожденного наблюдается вздутие верхних отделов живота.
4. Другие пороки развития. Атрезия двенадцатиперстной кишки может сочетаться с синдромом Дауна (в 30% случаев), кольцевидной поджелудочной железой (в 20% случаев) и другими пороками развития. В связи с многоводием часто наблюдаются преждевременные роды.
5. Лечение. Через назогастральный зонд проводят непрерывную аспирацию содержимого желудка. Начинают инфузионную терапию. Новорожденного переводят в специализированное отделение для хирургического лечения порока. Исключают незавершенный поворот кишечника и заворот тонкой кишки, поскольку эти заболевания требуют экстренного хирургического вмешательства.
Г. Трахеопищеводный свищ и атрезия пищевода. В 95% случаев трахеопищеводный свищ сочетается с атрезией пищевода. Свищ обычно формируется между дистальным отделом пищевода и трахеей.
1. Распространенность составляет 1 на 3000—5000 новорожденных.
2. Патогенез. Дефект формируется в результате неполного деления первичной кишки, дающей начало пищеводу и трахее на 5-й неделе внутриутробного развития.
3. Клиническая картина. В трети случаев наблюдается многоводие. При попытке кормления у новорожденного возникают срыгивание и кашель. Атрезию пищевода у новорожденного следует заподозрить при неудачных попытках ввести назогастральный зонд. Для подтверждения диагноза, не извлекая зонда, проводят рентгенографию грудной клетки.
4. Другие пороки развития. В 30—40% случаев трахеопищеводный свищ и атрезия пищевода сочетаются с другими пороками развития, обычно синдромами VATER и VACTERL.
5. Лечение. Основная задача — предотвратить заброс содержимого пищевода в дыхательные пути. Головной конец кровати приподнимают и налаживают непрерывную аспирацию содержимого из верхнего отдела пищевода через зонд, используя малое разрежение. Новорожденного переводят в специализированное отделение для хирургического лечения порока.
6. Прогноз зависит от наличия сопутствующей патологии (заболеваний легких, множественных пороков развития и недоношенности). В отсутствие этих заболеваний благоприятный исход наблюдается в более чем 95% случаев. После восстановления проходимости пищевода возможны нарушения глотания и желудочно-пищеводный рефлюкс.
V. Пороки развития дыхательных путей
А. Стеноз и атрезия хоан. Хоаны — это отверстия, соединяющие полость носа с носоглоткой. При полном отсутствии хоан говорят об их атрезии, при значительном сужении — о стенозе.
1. Распространенность составляет 1 на 2500—10 000 новорожденных.
2. Патогенез. Нарушается формирование сообщения между полостью носа и глоткой. При интенсивной санации полости носа стеноз хоан часто усугубляется.
3. Клиническая картина. В связи с тем что новорожденные дышат преимущественно носом, при стенозе и атрезии хоан у них возникают цианоз и апноэ (особенно при крике). Диагноз подтверждается, если ребенку не удается ввести катетер через нос.
4. Другие пороки развития. В 50% случаев атрезия хоан сочетается с черепно-лицевыми аномалиями (синдромы Тричера Коллинза и Апера) и синдромом CHARGE (по первым буквам следующих слов: C oloboma — колобома, H eart defects — пороки сердца, A tresia choanae — атрезия хоан, R etarded growth and development — задержка физического и психомоторного развития, G enital anomalies — пороки развития половых органов и E ar anomaly-deafness — пороки развития уха и глухота).
5. Лечение. Основная задача — обеспечить проходимость дыхательных путей. При использовании ротового воздуховода за ребенком необходимо постоянное наблюдение. Более безопасна интубация трахеи. При развитии отека на фоне стеноза хоан местно назначают вазопрессорные средства.
6. Прогноз в отсутствие других пороков развития благоприятный.
Б. Пороки развития языка и нижней челюсти могут осложниться обструкцией дыхательных путей.
а. Синдром Робена. Встречается у 1 из 2000 новорожденных. Диагностический признак — микрогнатия (недоразвитие нижней челюсти). В 60% случаев наблюдается расщелина неба.
б. Синдром Беквита—Видемана. Диагностические признаки включают макроглоссию, макросомию и грыжу пупочного канатика.
2. Лечение. У новорожденного может возникнуть обструкция дыхательных путей. Попытки вентиляции при помощи дыхательного мешка через маску малоэффективны. Для облегчения самостоятельного дыхания ребенка кладут на бок. Можно использовать ротовой воздуховод (важно правильно подобрать размер). Поскольку интубация трахеи обычно затруднена, в экстренных случаях производят коникотомию.
А. Этиология. Наиболее частая причина — маловодие. Обычно оно обусловлено длительным подтеканием околоплодных вод либо недостаточным их образованием. Нормальный объем околоплодных вод — необходимое условие развития легких плода. К другим причинам гипоплазии легких у плода относятся грыжа Бохдалека, длительное скопление большого количества жидкости в плевральной полости, ахондроплазия и нервно-мышечные заболевания. В некоторых случаях причину гипоплазии легких установить не удается. До родов диагноз поставить сложно.
В. Прогноз, как правило, неблагоприятный. Если гипоплазия легких сочетается с агенезией почек, ребенок нежизнеспособен.
VII. Заболевания сердца. За врожденные пороки сердца у плода иногда принимают функциональные нарушения, не требующие лечения. Тем не менее при подозрении на порок сердца у плода беременную обязательно консультируют у детского кардиолога.
А. Врожденные цианотические пороки сердца. Цианоз при рождении наблюдается не всегда. При цианозе в отсутствие других проявлений гипоксии ингаляция кислорода и ИВЛ не требуются.
1. Распространенность составляет 1 на 15 000 родов.
4. Другие пороки развития. У 40% детей с нарушениями внутрисердечной проводимости обнаруживают врожденные пороки сердца. Матери большинства остальных детей страдают коллагенозами (чаще СКВ ).
6. Прогноз в отсутствие пороков сердца благоприятный.
VIII. Пороки развития ЦНС
А. Миеломенингоцеле — грыжевое выпячивание спинного мозга с его оболочками через расщелину позвоночника. Имеет вид кистозного образования и располагается на спине по задней срединной линии.
1. Распространенность имеет географические особенности, составляя в среднем 1 на 1000 новорожденных.
2. Патогенез. Заболевание развивается вследствие незаращения нервной трубки на 3—4-й неделе внутриутробного развития.
3. Клиническая картина. Дефект чаще всего локализуется в пояснично-крестцовой области. Возможен разрыв грыжевого мешка.
5. Лечение. Ребенка кладут на живот или на бок. Грыжевой мешок закрывают марлей, смоченной в теплом физиологическом растворе, обеспечивают тщательный уход за ребенком. Новорожденного переводят в специализированное отделение для хирургического лечения порока. Проводят профилактическую антимикробную терапию.
IX. Водянка плода проявляется у новорожденного анасаркой и скоплением жидкости в полостях тела.
А. Распространенность составляет 1 на 1000—14 000 родов.
Б. Этиология. Считается, что выход избыточного количества жидкости из сосудистого русла обусловлен тяжелой анемией и повышенной проницаемостью капилляров.
1. Иммунная водянка плода. Основная причина — тяжелая гемолитическая болезнь. В настоящее время благодаря использованию анти- Rh 0(D)-иммуноглобулина эта форма заболевания встречается редко.
2. Неиммунная водянка плода обусловлена врожденными заболеваниями сердца (пороки, наджелудочковая тахикардия), хромосомными аномалиями (синдром Тернера, трисомии), инфекциями (парвовирусная или цитомегаловирусная инфекция, сифилис и др.) и хориоангиомой. Во многих случаях причину водянки установить не удается.
Г. Клиническая картина. Характерны выраженные отеки. Быстро развивается дыхательная недостаточность.
Д. Лечение. Заранее, еще до рождения ребенка, готовят оборудование для проведения СЛР в полном объеме, включая интубацию трахеи. Если указанные меры неэффективны, проводят плевральную пункцию, лапаро- или перикардиоцентез [6]. Для этого используют венозные катетеры большого диаметра (16 или 18 G). В плевральную полость катетер вводят в четвертом межреберье по передней подмышечной линии. В брюшную полость во избежание ранения печени или селезенки катетер вводят по боковой поверхности живота. Иглу удаляют и большим шприцем (25—50 мл), подсоединенным через кран, удаляют жидкость. В экстренных ситуациях может потребоваться дополнительный персонал. Перикардиоцентез должен проводить опытный врач.
Е. Прогноз неблагоприятный. Выживают не более 20—33% новорожденных.
X. Пороки развития, несовместимые с жизнью
А. Подготовка к родам. Если у плода выявлен порок развития, несовместимый с жизнью, об этом сразу же сообщают будущим родителям. Необходимо объяснить им суть заболевания и причины его несовместимости с жизнью. В течение родов очень важно внимательное и предупредительное отношение медперсонала к роженице. Ей объясняют план ведения родов, сообщают о том, подтвердился ли диагноз, подробно отвечают на любые вопросы.
Б. После родов ребенка вытирают насухо, завертывают в теплое одеяло и дают подержать матери и другим членам семьи (если они не отказываются). Целесообразно показать и объяснить значение видимых пороков развития, сравнивая их с результатами пренатальной диагностики. По просьбе семьи допускается присутствие священника и организация крещения ребенка, а также присутствие других людей, которые могут оказать поддержку, — психолога, близкого друга. Для подтверждения диагноза и выявления других пороков развития ребенка тщательно обследуют. Проводят цитогенетическое исследование. Для проведения аутопсии необходимо получить письменное согласие родителей.
В. Через несколько недель или месяцев после родов целесообразно повторно встретиться с родителями. В спокойной обстановке следует ответить на все интересующие их вопросы. Это поможет им быстрее смириться с утратой. Если проводилась аутопсия, родителей знакомят с ее результатами.
XI. Глубокая недоношенность и граница жизнеспособности. Вопрос о границе жизнеспособности, ее критериях и показаниях к реанимационным мероприятиям окончательно не решен. Разногласия касаются того, следует ли принимать во внимание качество будущей жизни ребенка, возможность его инвалидизации, а также мнение родителей. Выживаемость недоношенных за последние десять лет существенно возросла. Исследования Alien с соавт. [7] позволили сделать следующие выводы.
А. При гестационном возрасте 25 нед реанимационные мероприятия, безусловно, показаны, поскольку выживаемость новорожденных достигает 79%. При этом у 69% выживших при УЗИ не выявляют органических изменений головного мозга.
Б. При гестационном возрасте 22 нед реанимационные мероприятия не проводят, поскольку не описан ни один случай выживания новорожденного.
В. При гестационном возрасте 23—24 нед прогноз труден. Из родившихся на сроке 23 нед выживает 15%, причем у большинства выживших новорожденных при УЗИ головного мозга отмечается выраженная патология. Из родившихся на сроке 24 нед выживают 56%, причем только у 21% из них отсутствует выраженная патология головного мозга.
Тактику ведения последней группы недоношенных планируют в зависимости от доступных методов выхаживания. Учитывают местное законодательство. Родителям объясняют, что ребенок глубоко недоношен и не сможет выжить без реанимационных мероприятий. При преждевременных родах как можно скорее определяют степень зрелости ребенка (особенно в случаях, когда срок беременности точно не известен) и, если ребенок жизнеспособен, начинают реанимационные мероприятия. Если жизнеспособность ребенка сомнительна, большинство авторов советуют начинать реанимационные мероприятия, предупредив родителей, что при диагностике нежизнеспособности ребенка интенсивную терапию придется прекратить.
XII. Многоплодная беременность чаще заканчивается преждевременными родами и чаще требует кесарева сечения. У новорожденных повышен риск асфиксии. Реанимационные мероприятия проводят по обычному плану. При этом для каждого ребенка необходимы отдельная реанимационная бригада, обогреваемый столик и другое оборудование.
XIII. Недиагностированные тяжелые пороки развития. При обнаружении у новорожденного тяжелых пороков развития помимо специального лечения и ухода за ребенком необходимо заботливое и сочувственное отношение со стороны медперсонала к семье. Вначале родителям коротко объясняют суть заболевания и отвечают на их вопросы. Разрешают посмотреть на ребенка и, если позволяет его состояние, подержать на руках. Для дальнейшего обследования и лечения ребенка переводят в специализированное отделение. Поскольку из-за неожиданности родители вряд ли смогут усвоить всю информацию с первого раза, может потребоваться дополнительная беседа. Родители ребенка обычно очень мучительно привыкают к своему новому положению. Кроме того, у них, особенно у матери, часто возникает чувство вины. Женщину убеждают, что она не должна чувствовать себя причастной к заболеванию ребенка. Исключение составляют ситуации, когда причины заболевания хорошо известны, например при фетальном алкогольном синдроме. В таких случаях следует тактично сообщить родителям правду. В дальнейшем семьям требуется соответствующее наблюдение и консультирование. Большую помощь могут оказать службы социальной поддержки.
1. Katz V. L., Bowes W. A., Jr. Meconium aspiration syndrome: Reflections on a murky subject. Am. J. Obstet. Gynecol. 166:171, 1992.
2. Wiswell T. H. E., Bent R. C. Meconium staining and the meconium aspiration syndrome: Unresolved issues. Pediatr. Clin. North Am. 40:955, 1993.
3. Macri C. J. et al. Prophylactic amnioinfusion improves outcome of pregnancy complicated by thick meconium and oligohydramnios. Am. J. Obstet. Gynecol. 167:117, 1992.
4. Gregory G. A. et al. Meconium aspiration in infants—A prospective study. J. Pediatr. 85:848, 1970.
5. Linder N. et al. Need for endotracheal intubation and suction in meconium-stained neonates. J. Pediatr. 112:613, 1988.
6. Carton D., McGillivray B. C., Schrieber M. D. Nonimmune hydrops fetalis: A multidisciplinary approach. Clin. Perinatol. 16:839, 1989.
7. Alien M. C., Donohue P. K., Dusman A. E. The limit of viability—neonatal outcome of infants born at 22 to 25 weeks gestation. N. Engl. J. Med. 329:1597, 1993.
8. American Academy of Pediatrics and The American College of Obstetricians and Gynecologists. Guidelines for Perinatal Care. Chicago, IL, 1992.
9. Fanaroff M., Martin R. J. Neonatal-Perinatal Medicine: Diseases of the Fetus and Newborn. St. Louis: Mosby-Year Book, 1992.
10. Fletcher M. A., MacDonald M. G. Atlas of Procedures in Neonatology. Philadelphia: Lippincott, 1993.
11. Jones K. L. Smith’s Recognizable Patterns of Human Malformations. Philadelphia: Saunders, 1988.
12. Taeusch H. W., Ballard R. A., Avery M. E. Schaeffer and Avery’s Diseases of the Newborn. Philadelphia: Saunders, 1991.