Что означает коронавирус sars cov 2 ген е
Новые ущербы от инфекции SARS-CoV-2 за пределами дыхательной системы
Автор
Редакторы
Статья на конкурс «Био/Мол/Текст»: Все мы помним, как с начала декабря 2019 года в китайском городе Ухань был выявлен ряд случаев пневмонии, связанных с коронавирусной инфекцией COVID-19 c серьезными симптомами, такими как респираторные проблемы (кашель, одышка, поражение легких) и лихорадка. Но вы когда-нибудь задумывались о том, что же происходит с остальными органами нашего тела? Так давайте разберём, как крошечный вирус может поражать не только дыхательную систему, но и вызвать повреждение других систем человеческого организма.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Школьная» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Партнеры номинации — медико-биологическая школа «Вита» и «Новая школа».
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Введение
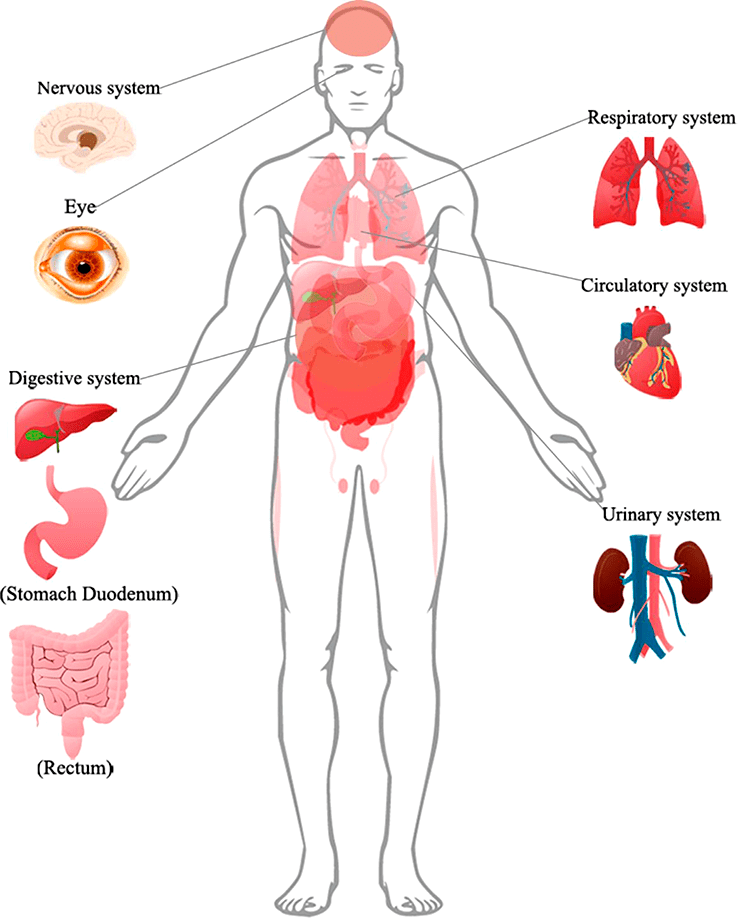
Согласно исследованиям немецких ученых, SARS-CoV-2 проникает внутрь организма с помощью клеточного рецептора — ангиотензинпревращающего фермента 2 (АПФ2; ACE2 — англ.), который специфически синтезируется в определенных органах и тканях. Соответственно, ACE2 играет важную роль в регуляции сердечно-сосудистой, кишечной, почечной и репродуктивной функций [1]. Попав в систему кровообращения, коронавирус, вероятнее всего, распространяется через кровоток [2]. Следуя этим данным, мы можем понять, как SARS-CoV-2 заражает не только дыхательную систему, но и представляет потенциальную угрозу для пищеварительной и мочеполовой систем, ЦНС и системы кровообращения.
Рисунок 1. Поражения органов, подтвержденные клиническими признаками или биопсией, у пациентов с COVID-19
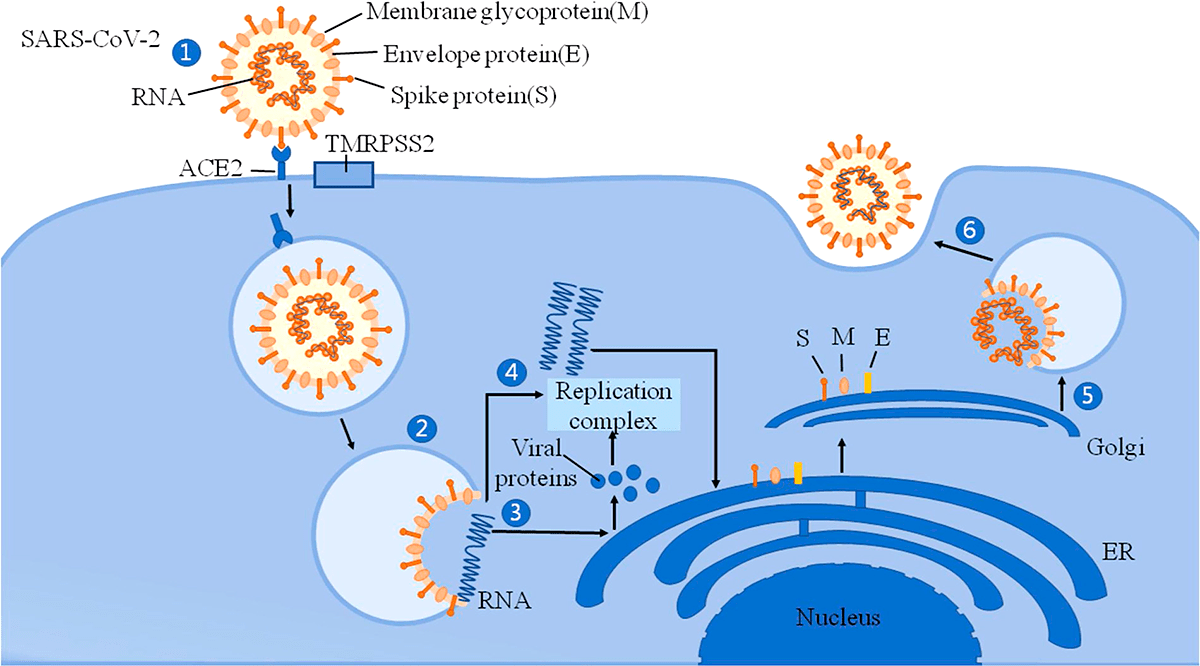
Рисунок 2. Механизм вторжения SARS-CoV-2 в клетку
SARS-CoV-2 и пищеварительная система
Помимо главного рецептора ACE2, SARS-CoV-2 использует трансмембранную сериновую протеазу 2 (TMRPSS2), фермент, который также экспонируется на эпителиальных клетках тонкой кишки. Он способствует проникновению вируса в клетки [3]. Активность SARS-CoV-2 может вызывать модификации ACE2 в кишечнике, которые повышают восприимчивость к воспалению кишечника и диарее. ACE2 оказывает значительное влияние на состав кишечной микробиоты [4]. Первичные воспалительные стимулы вызывают высвобождение в систему кровообращения микробных продуктов и цитокинов, которые могут вызвать микробный дисбиоз и воспалительную реакцию.
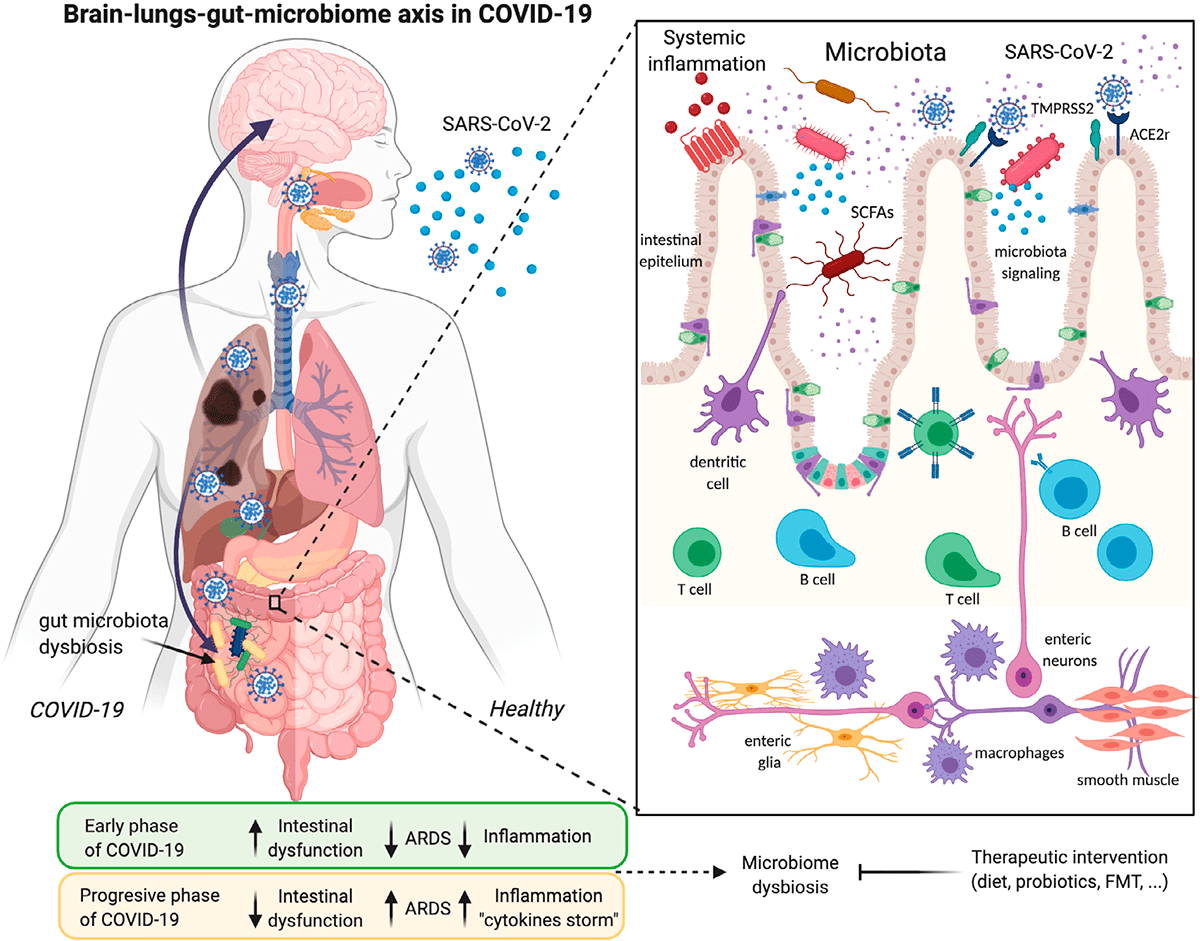
Изменения микробиоты кишечника могут быть связаны с изменениями в иммунной системе и предрасположенностью к более серьезным последствиям COVID-19. Наш микробиом меняется с возрастом: в первые несколько лет жизни микробиота малоразнообразна и нестабильна [5], [6]; во взрослом возрасте стабильна и разнообразна, а к пожилому возрасту разнообразие микробиоты уменьшается, а дисбиоз увеличивается, что связывают с когнитивным дефицитом, депрессией и воспалением [7]. Сниженное разнообразие микробиоты — еще один фактор риска заражения COVID-19 для пожилых людей.
Рисунок 3. Инфекция SARS-CoV-2 и ее связи с осью легких—кишечника—мозга и дисбиозом микробиома
Изменение кишечной флоры также связано с ожирением, еще одним фактором риска для тяжелого течения COVID-19 [8], [9]. Жировая ткань может служить резервуаром для распространения SARS-CoV-2 и активации системного иммунитета [10]. Коронавирусная инфекция вызывает изменения в кишечной бактериальной флоре, которые могут повлиять на ось «кишечник—мозг». Таким образом, кишечная флора играет решающую роль в регуляции неврологических функций, таких как депрессия или тревога [11].
Следовательно, режим питания играет значительную роль во время заражения вирусом SARS-CoV-2. Из-за вирусной инфекции иногда начинается дисбиоз, который может быть скомпенсирован компонентами диеты и пробиотиками [12]. Несколько исследований показывают, что оптимальный иммунный ответ зависит от правильного питания [13], [14]. Недоедание может поставить под угрозу иммунитет, тем самым влияя на уязвимость ответа на COVID-19. Потребление достаточного количества белка имеет решающее значение для выработки антител, поддержания ворсинчатой морфологии кишечника и уровня кишечного иммуноглобулина, что улучшает кишечный барьер [15–17]. Таким образом, высококачественные белки являются важным компонентом противовоспалительной диеты, которая включает омега-3 жирные кислоты, витамины С и Е, фитохимические вещества, которые широко присутствуют в продуктах растительного происхождения (фруктах, овощах, орехах, злаках и т.д.) [18–21]. Правильная диета укрепляет иммунную систему и способствует защите организма от тяжелого течения COVID-19.
SARS-CoV-2 и центральная нервная система (ЦНС)
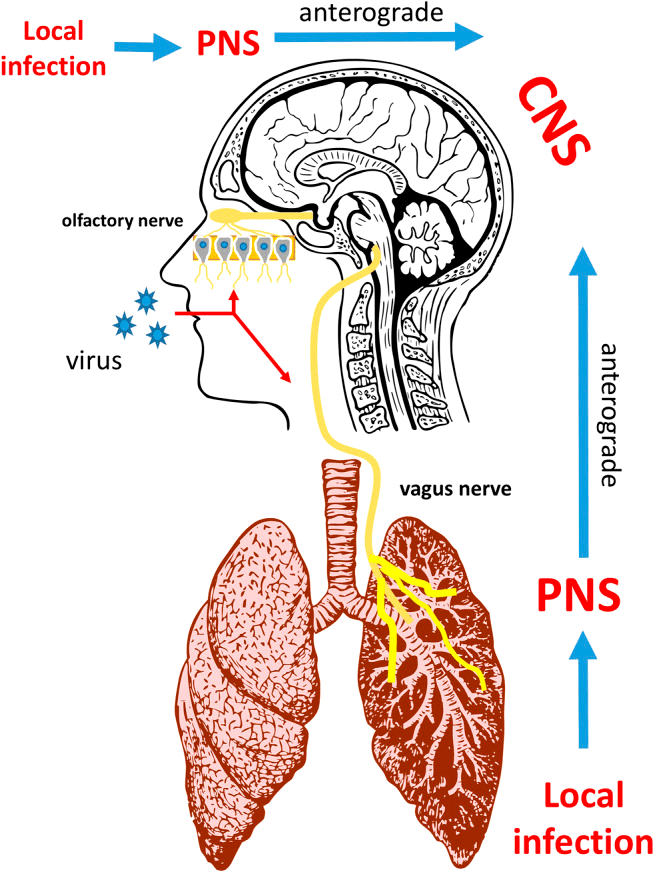
Кроме пищеварительной системы, коронавирусная инфекция (COVID-19) также затрагивает центральную и периферическую нервную систему. Неврологические проявления могут возникать по разным причинам, включая прямое вирусное поражение центральной нервной системы (ЦНС) и иммунноопосредованные процессы. Примеры заболеваний ЦНС при COVID-19 могут включать энцефалит (воспаление головного мозга), менингит и инсульт. В периферической нервной системе COVID-19 ассоциируется с дисфункцией обоняния и вкуса, повреждением мышц и синдромом Гийена—Барре, при котором иммунная система человека поражает собственные периферические нервы.
Рисунок 4. Коронавирусная инфекция и нервная система
Ученые Университета Гонконга отметили, что механизмы инфекции SARS-CoV-2 могут быть аналогичны механизмам инфекции SARS-CoV из-за 79,5% сходства последовательностей РНК этих двух коронавирусов [22]. Однако SARS-CoV-2 обладает более мощной способностью к распространению, чем SARS-CoV и MERS-CoV. Причина в том, что SARS-CoV-2 и ACE2 обладают более сильной связывающей способностью [23]. S-белок (спайк-белок) на поверхности коронавируса связывается с ACE2 и прикрепляется к поверхности клетки; затем сериновая протеаза (TMPRSS2) активирует S-белок, что помогает вирусу проникать в нейрон [1]. Так как клетки кровеносных сосудов экспонируют ACE2 в большом количестве, SARS-CoV-2 может атаковать эндотелиальные клетки в кровеносных сосудах головного мозга через этот рецептор и нарушить гематоэнцефалический барьер (ГЭБ — барьер между кровеносной системой и центральной нервной системой). Нарушенный ГЭБ может способствовать вторжению вируса в ткани мозга и нейроны и привести к серьезным неврологическим осложнениям [24].
SARS-CoV-2 и система кровообращения
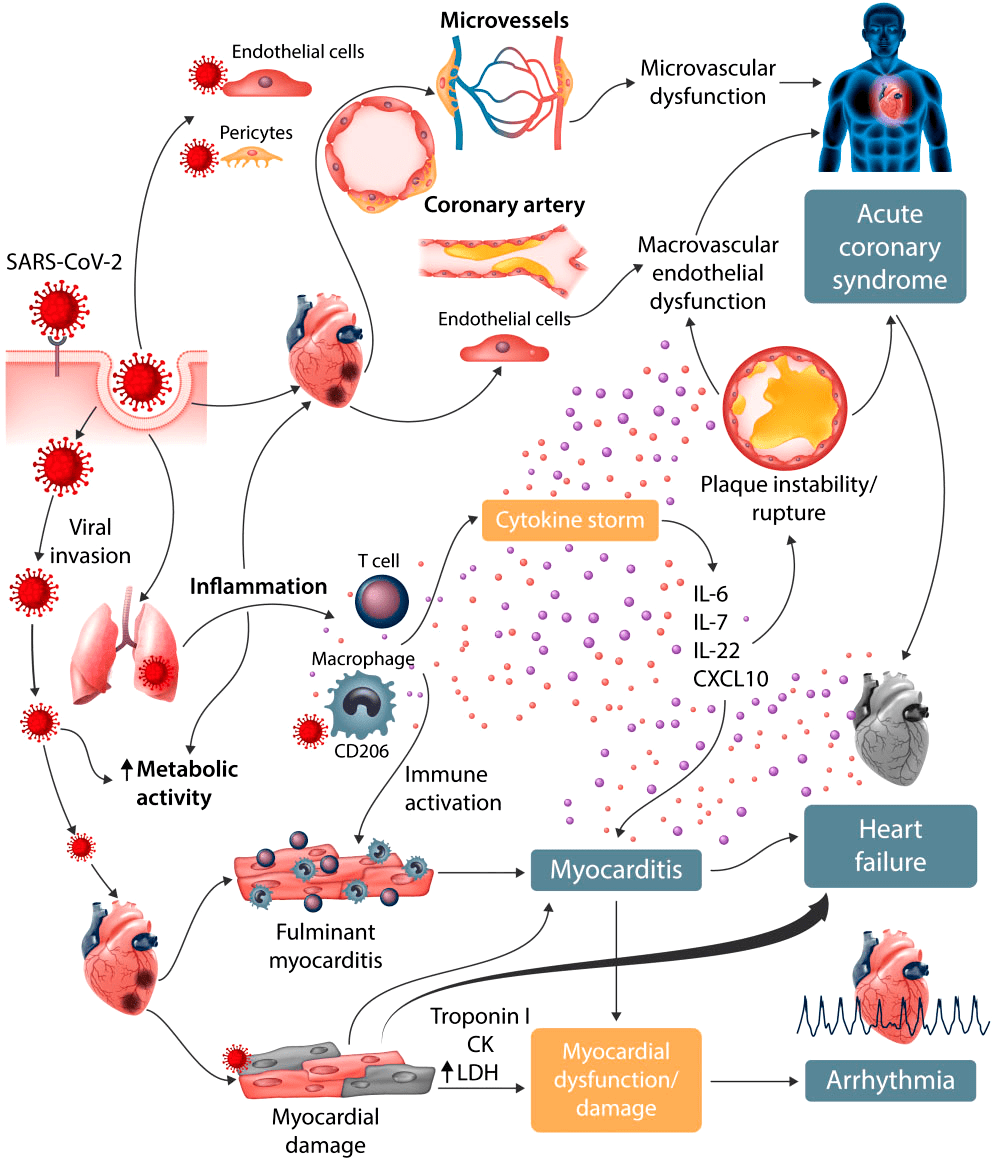
Помимо дыхательных путей, SARS-CoV-2 поражает сердечно-сосудистую систему. Это приводит к высвобождению высокочувствительных сердечных тропонинов (hs-cTnl) — белков, содержащихся в сердце и скелетных мышцах человека. В процессе заражения мембраносвязанный белок ACE2 может расщепляться трансмембранным дезинтегрином ADAM17, высвобождая ACE2 в кровоток. Таким образом, вирус циркулирует в крови зараженного организма. Воспаление сосудистой системы и миокарда может привести к миокардиту, сердечной недостаточности и быстрому ухудшению состояния больного [25].
Рисунок 5. Сердечно-сосудистое поражение при COVID-19
SARS-CoV-2 и мочеполовая система
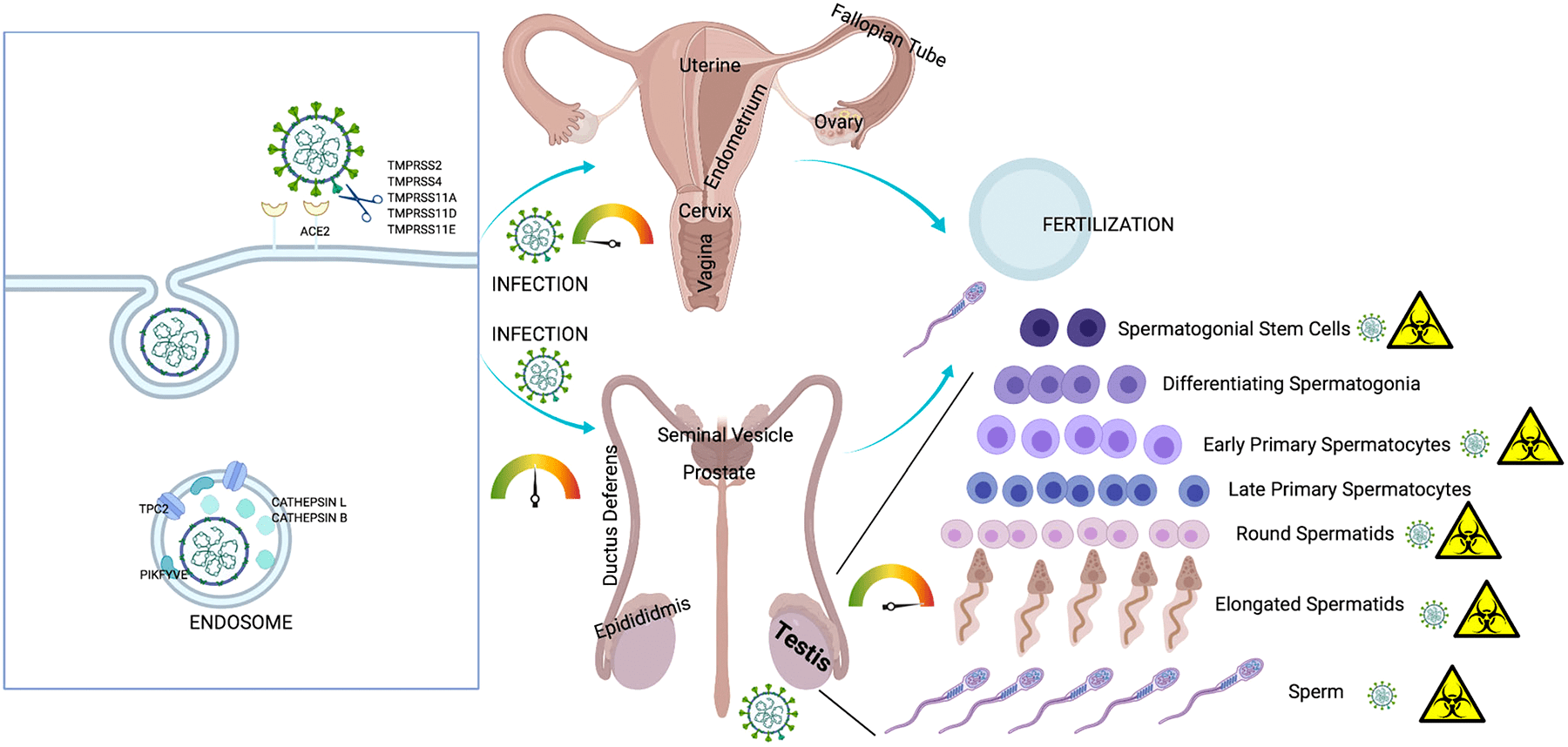
Инфекция репродуктивной системы требует большего внимания, потому что она не только влияет на нынешнее поколение, но также может распространяться на потомство через поврежденные гаметы. На сегодняшний день несколько исследований подтвердили влияние SARS-CoV-2 как на мужскую, так и на женскую репродуктивную систему [26], [27]. В настоящее время хорошо известен факт, что мужчины более восприимчивы к инфекции SARS-CoV-2 и у них выше уровень смертности, чем у женщин. Это объясняется тем, что клетки семенного протока и сперматогонии синтезируют много ACE2 [28–30].
По мнению ученых, SARS-CoV-2 нарушает репродуктивные функции мужчин через несколько механизмов, таких как воспалительные реакции, окислительный стресс и апоптоз [31–33]. Инфекция SARS-CoV-2 приводит к перепроизводству активных форм кислорода, которые могут усиливать внутриклеточные сигнальные пути (NF-κB-TLR). Это приводит к высвобождению цитокинов, что еще больше усиливает воспалительный ответ. К примеру, орхит, вызванный инфекцией SARS-CoV-2, может привести к окислительному стрессу в тканях яичка. Окислительный стресс может вызвать внутриклеточное окислительное повреждение сперматозоидов, что приводит к ухудшению их качества и мужскому бесплодию.
Рисунок 6. Инфекция SARS-CoV-2 и репродуктивная система
Рецепторы ACE2 были также обнаружены в женских яичниках [34], [35]. Можно предположить, что SARS-CoV-2 поражает ткань яичников и клетки гранулезы и таким образом ухудшает функцию яичников и жизнеспособность ооцитов, что может привести к бесплодию или невынашиванию [33]. Недавно ученые (Виванти и др.) сообщили о трансплацентарной передаче вируса от матери, инфицированной COVID-19, новорожденному. Мать была инфицирована в последнем триместре беременности, и гены SARS-CoV-2 были обнаружены в ткани плаценты. Согласно этому отчету, трансплацентарная передача может привести к воспалению плаценты [36]. Однако стоит отметить, что плацента имеет плацентарный барьер, который не смешивает кровь матери и плода, тем самым защищая плод от всех видов материнской инфекции. Невосприимчивые клетки плаценты обладают противовирусными свойствами, которые дополнительно предотвращают проникновение SARS-CoV-2 в клетки ребенка [37].
Вывод
Прочитав эту статью, мы с вами узнали, как вирус поражает не только дыхательную систему, но и другие системы человека. Это осложняет потенциальные клинические проявления и затрудняет лечение случаев COVID-19. Однако биомедицинские исследования могут помочь нам больше узнать о способностях нового коронавируса и о том, как с ним бороться, чтобы определить важные ориентиры для дальнейших исследований, диагностики и лечения. Также стоит всегда помнить, что соблюдая правильную диету и карантинные меры, мы снижаем риски заражения и ухудшения состояния здоровья во время COVID-19. Ведь вирус не всегда может вызвать вышеуказанные осложнения, если мы будем правильно заботиться о своем здоровье.
Кратко о коронавирусе SARS-COV-2 и его мутациях
В последнее время в некоторых странах мира зафиксированы случаи повторного заражения (реинфекции) возбудителем новой коронавирусной инфекции под названием COVID-19.
Также установлено, что если человек заболевает снова, то это, скорее всего, связано со встречей с другим вариантом той же инфекции. Кроме того, известно, что в этом случае заболевание может протекать в тяжелой форме.
ЧТО ТАКОЕ ШТАММ КОРОНАВИРУСА SARS-COV-2?
Геном SARS-CoV-2 представляет собой длинную последовательность РНК, состоящую почти из 30 000 символов (нуклеотидов), которые работают в строгой последовательности. Этот порядок может измениться: если каждая новая копия вируса собрана в одном из этих соединений, может произойти ошибка — замена одного нуклеотида другим — и в результате код всей цепи немного изменится. В каждом новом» хозяине» геном вируса изменяется незначительно.
Эти изменения могут быть очень незначительными, но они позволяют установить связь между инфицированными людьми или следовать по пути, который выбрал вирус. Под словом «племя» ученые подразумевают генетически иную ветвь вируса, которая отличается от своего «отца» одной или несколькими мутациями. Разница может составлять лишь долю процента от общего генома, но каждая новая последовательность РНК может вызвать новую ветвь вируса, то есть новый штамм.
Скорость, с которой происходят генетические изменения, варьируется от вируса к вирусу, и SARS-CoV-2 мутирует относительно медленно. Большинство геномов этого вируса отличаются друг от друга небольшим количеством точечных заменителей, а число отличий от исходного варианта не превышает 30-почти 30 тысяч нуклеотидов.
КАКИЕ ШТАММЫ КОРОНАВИРУСА СУЩЕСТВУЮТ?
Основных штаммов нового коронавируса семь, они начинались с букв GR, G, GH, O, S, L и V. С индексом L — вирус был обнаружен в декабре 2019 года в Ухане, Китай. Но теперь он постепенно исчезает.
Остальные штаммы неравномерно распределены по всему миру: на каждом континенте, как правило, наиболее распространены не более двух основных вариаций.
ЧТО НУЖНО ЗНАТЬ О СТРУКТУРЕ И ДЕЙСТВИИ КОРОНАВИРУСА SARS-COV-2?
Последний импортируется не из Китая, а из других азиатских стран. Эти два штамма были обнаружены в 99% образцов, протестированных в России. На рисунке схематически показано, как проявляет себя коронавирус в отношении человека.
КАК РАЗВИВАЛСЯ КОРОНАВИРУС SARS-COV-2 В РОССИИ?
Общее число мутаций, обнаруженных в секвенированных геномах вируса SARS-CoV-2, составляет многие тысячи, но лишь немногие из них были зарегистрированы и стабильно наследуются.
Сейчас таких единичных мутаций насчитывается около 22, они произошли в январе-марте этого года. Позднее новые племена перестали широко распространяться, т. е. до начала эпидемии в России в геноме вируса стабильно регистрировались три основные группы мутаций, которые, согласно исследованию Роспотребнадзора, формировали «три ветви эволюционного развития».
К концу марта 2020 года развитие этих трех основных направлений и циркулирующих штаммов с мутациями в генах orf1b (P314L) и S (D614G) замедлилось. Эти две мутации были основными долгосрочными изменениями в геноме вируса SARS-CoV-2, подчеркивается в исследовании.
Роспотребнадзор считает, что мутация в гене S связана со снижением патогенности (способности вызывать заболевания, попадающие в организм). Агентство отмечает, что это также связано с улучшением лечения пациентов во время пандемии. Влияние мутации в гене orf1b (P314L) до сих пор плохо изучено.
Вирусы постоянно мутируют, но коронавирусы мутируют гораздо медленнее, чем другие РНК-вирусы. Несмотря на активную циркуляцию по всему миру, SARS-CoV-2 изменился менее чем на 0,1% по сравнению с вирусом, первоначально выделенным в Китае 11 месяцев назад.
Основные изменения были выявлены в первые месяцы размножения, и распространенные в настоящее время варианты вируса аналогичны тем, которые были выделены весной. Штамм S (D614G) в настоящее время является предметом пристального внимания ученых.
Впервые он был обнаружен в Индонезии в августе 2020 года; в то время сообщалось, что этот штамм был в 10 раз более заразным, чем исходный штамм вируса. Некоторые исследования, проведенные в Forerunner (т. е. не рецензируемые и не опубликованные в научных публикациях), заключают, что эта мутация действительно может иметь более высокую инфекционную способность и более высокую вирусную нагрузку при заражении этой разновидностью. Но окончательных решений нет. Вирус быстро замещает S (Спайк) вирион в поверхностном белке, что повышает переносимость (свойство инфекционных заболеваний, венерических организмов — здоровых), но не клиническое течение заболевания, так как другие различия в штаммах вируса минимальны.
Первые варианты вируса двух мутаций, распространенные в России, были обнаружены в конце января 2020 года в Китае, а затем и в Австралии. В феврале 2020 года эти варианты были обнаружены в большинстве западноевропейских стран, Саудовской Аравии, США, Канаде, Мексике, Бразилии, Марокко и Сенегале. Детальное сравнение геномов вирусов в России и за рубежом показывает, что в стране циркулируют штаммы, завезенные из Западной Европы. Они были отправлены в марте и апреле 2020 года.
Коронавирус очень мало мутировал за эти девять месяцев и не изменился в местах, ответственных за проявления эпидемического процесса, за его, скажем так, агрессивность и ожесточенность. Минздрав России считает, что вирус обладает низкой способностью к мутациям — он накапливает всего около двух точечных изменений в месяц, то есть за год может произойти около 24 мутаций. Распространение основных вариантов вируса, циркулирующих в России, в целом аналогично распространению в Европе.
Есть некоторые различия, но у нас нет оснований полагать, что эти различия каким-то образом изменяют клиническое течение или эпидемиологию COVID-19 в России по сравнению с европейскими странами. Роспотребнадзор сообщил, что ежемесячно ученые ФБУН ГНЦ совместно с РИЦ «Вектор» полностью расшифровывают более 150 геномов нового коронавируса. Полученные ими данные будут использованы для анализа актуальности используемых диагностических тест-систем, выявления завозных случаев заболевания и оценки региональных особенностей генетического разнообразия SARS-CoV-2.
Сейчас геномы вирусов секвенируются и собирают данные в различных лабораториях по всему миру, в том числе в российском центре имени Чумакова. Ученые, по ее словам, будут коррелировать геномы вирусов с клинической картиной пациентов, от которых они изолированы, что прольет свет на важность наиболее распространенных мутаций. Она признает, что изучение влияния каждой конкретной мутации на клиническую картину КОВИДА-19 сложно.
Ученые должны изучить важность каждой конкретной мутации для структуры мутировавших белков и определить роль этих мутаций в развитии клинических симптомов и повреждении легких в экспериментах на животных. В настоящее время разрабатываются, анонсируются и регистрируются всё новые вакцины против SARS-CoV-2.
ДОЛЖНЫ ЛИ МЫ БОЯТЬСЯ МУТАЦИЙ?
Важен также вопрос о различном воздействии инфицированных, например, могут ли некоторые штаммы быть более заразными, чем другие. Из заявлений Роспотребнадзора следует, что мутации вируса не так уж плохи. Однако в научной литературе уже сообщалось о нескольких случаях повторной коронавирусной инфекции. Для повторного выявления инфекции ученые каждый раз проверяют генетический состав возбудителя и убеждаются, что штамм вируса отличается от первого, чем вызывает заболевания, — иначе нельзя с уверенностью сказать, что это вторичная инфекция, а не длительный первичный случай. Голландское информационное агентство BNO подсчитывает все повторяющиеся заболевания, когда-либо записанные, и сопровождает их ссылкой на источник.
По данным агентства, во всем мире известно 24 случая повторных инфекций, один из которых был смертельным. 89-летний пациент из Нидерландов скончался от рака. Повторные случаи заражения также произошли в Гонконге, Бельгии, США и Эквадоре. Каждый день в России почти 20 тысяч случаев, некоторые из которых связаны с вирусами, издавна циркулирующими в стране, частично с импортными вариантами, связанными с инфекциями в других странах, часто очень далекими.
Поэтому, конечно, можно импортировать, а затем изолировать вариант вируса, который ранее не был обнаружен в России, как это было недавно в Норвегии. Однако это не означает немедленного изменения эпидемиологической ситуации с Ковид-19.
В октябре 2020 года The Lancet опубликовала исследование, в котором были описаны два случая повторной коронавирусной инфекции. У пациента из американского штата Невада болезнь была более тяжелой после очередной инфекции. 25- летний мужчина должен был попасть в больницу из-за недостатка кислорода, и компьютерная томография показала, что у него вирусная пневмония.
Ученые обнаружили, что он был заражен другим штаммом, генетически отличным от предыдущего возбудителя. Таким образом, более раннее воздействие SARS-CoV-2 не может гарантировать полный иммунитет. Все люди, независимо от того, был ли ранее диагностирован коронавирус или нет, должны принимать те же меры предосторожности.
БУДУТ ЛИ ВАКЦИНЫ ЭФФЕКТИВНЫМИ, ЕСЛИ ВИРУС МУТИРУЕТ?
До сих пор ученые считают, что вакцины, разработанные во всем мире для борьбы с первыми штаммами нового коронавирус, будут столь же эффективны против новых мутаций. Ученые пояснили, что большинство вакцин, разработанных во всем мире, были смоделированы оригинальным штаммом d-вируса, который чаще встречается в последовательностях, опубликованных в начале пандемии.
С тех пор вирус мутировал в штамм G, вариации которого в настоящее время доминируют в мире. Исследователи были обеспокоены тем, что эта мутация негативно повлияет на эффективность разработанных вакцин. Несмотря на мутацию d614g в белке, эксперименты и моделирование подтвердили, что вакцины остаются эффективными.
Наиболее распространенный штамм G, вероятно, не требует частого выбора новых вакцин, в отличие от гриппа, который требует разработки вакцин против циркулирующих штаммов каждый год. Поскольку различия в штаммах, циркулирующих в России, минимальные, они, вероятно, существенно не влияют на структуру вирусных белков.
Таким образом, созданные и применяемые вакцины от COVID-19, не нужно воспроизводить каждый год.
Составили: канд. мед. наук, доцент Гуменюк С.А., врач-оториноларинголог Байчорова О.Х. , 2021 год
Генетические варианты SARS-CoV-2: что они означают?
В ходе пандемии, вызванной коронавирусом тяжелого острого респираторного синдрома 2 (SARS-CoV-2), клинические и научные сообщества и системы общественного здравоохранения были вынуждены реагировать на новые генетические варианты вируса. Каждый новый вариант вызвал шквал внимания со стороны средств массовой информации, различные реакции научного сообщества и призывы правительств либо «сохранять спокойствие», либо принять немедленные контрмеры. Хотя многие ученые первоначально скептически относились к значимости мутации D614G, появление нового «британского варианта» — линии B.1.1.7 — вызвало широкую озабоченность. Чтобы понять, какие именно варианты вызывают обеспокоенность и почему, необходимо разобраться в эволюции вируса и геномной эпидемиологии SARS-CoV-2.
Дорогие коллеги, компания BestDoctor ищет среди наших подписчиков людей на позиции врача-консультанта, врача-куратора и врача-терапевта для онлайн-консультаций.
Мутации, варианты и распространение
Мутации возникают как естественный побочный продукт репликации вирусов [1]. Частота мутаций у РНК-вирусов обычно выше, чем у ДНК-вирусов. Однако у коронавирусов происходит меньше мутаций, чем у большинства других РНК-вирусов, потому что они кодируют фермент, который исправляет некоторые ошибки, возникающие во время репликации. Как правило, судьба вновь возникшей мутации определяется естественным отбором. Частота тех мутаций, которые дают вирусу конкурентное преимущество в отношении репликации, распространения или ухода от иммунитета, будет увеличиваться, а те, которые снижают приспособленность вируса, склонны отбраковываться из популяции циркулирующих вирусов. Однако частота мутаций также может увеличиваться и уменьшаться в результате случайных событий. Например, «эффект основателя» возникает, когда в ходе распространения ограниченное число отдельных вирусов создает новую популяцию. Мутации, присутствующие в геномах этих вирусов-предков, будут доминировать в популяции независимо от их влияния на приспособленность. Такое же взаимодействие естественного отбора и случайных событий формирует эволюцию вируса внутри хозяев, в различных сообществах и странах.
Хотя термины «мутация», «вариант» и «штамм» при описании эпидемиологии SARS-CoV-2 часто используются как взаимозаменяемые, важно понимать различия между ними. Термин «мутация» относится к фактическому изменению последовательности (ДНК или белка): D614G обозначает замену аспарагиновой кислоты на глицин в положении 614 гликопротеина шиповидных отростков (S-белка). Геномы, последовательности которых различаются, часто называют вариантами. Этот термин несколько менее точен, поскольку два варианта вируса могут отличаться одной или несколькими мутациями. Строго говоря, вариант — это штамм, обладающий явно отличающимся фенотипом (например, различиями в антигенности, трансмиссивности или вирулентности).
Оценка нового варианта SARS-CoV-2 должна включать в себя ответы на следующие вопросы: достиг ли вариант доминирующего положения в результате естественного отбора или случайных событий? Если имеющиеся данные свидетельствуют о естественном отборе, то какие мутации подверглись отбору? Каково адаптивное преимущество этих мутаций? Какое влияние эти мутации оказывают на трансмиссивность и распространение, антигенность или вирулентность?
Мутация D614G S-белка
Мутация D614G гликопротеина шиповидных отростков (S-белка) SARS-CoV-2 была впервые обнаружена на значительном уровне в начале марта 2020 года и в течение следующего месяца достигла глобального доминирования [2]. По-видимому, изначально мутация возникла независимо и одновременно распространилась по нескольким географическим регионам. Эта очевидная конвергентная эволюция наводит на мысль о естественном отборе и адаптивном преимуществе D614G. Однако при последующих секвенированиях мутация D614G была выявлена в вирусах, которые были распространены в нескольких китайских провинциях в конце января. Это свидетельствует в пользу того, что глобальное распространение этой мутации могло быть результатом случайных событий с «эффектом основателя», когда вирусы, несущие 614G, просто инициировали большинство ранних случаев передачи в нескольких местах.
Такая правдоподобная нулевая гипотеза заставила многих в эволюционном сообществе усомниться, что мутация D614G была адаптивной, несмотря на данные, полученные in vitro, которые показывают ее влияние на связывание с рецепторами. Недавний популяционно-генетический и филодинамический анализ более 25 000 последовательностей из Великобритании показал, что вирусы, несущие 614G, по-видимому, действительно распространяются быстрее и дают начало более крупным филогенетическим кластерам, чем вирусы, несущие 614D [3]. Величина эффекта в данном анализе была умеренной, и различные модели не всегда достигали статистической значимости. Совсем недавно дополнительное исследование на животных показало, что вирусы, несущие 614G, передаются более эффективно [4, 5].
Мутация N453Y S-белка и норки
Тревожные вспышки SARS-CoV-2 начали происходить на норковых фермах в Нидерландах и Дании в конце весны и начале лета 2020 года [6]. Геномные и эпидемиологические исследования ранней вспышки в Нидерландах показали передачу вируса от человека к норке, от норки к норке и от норки к человеку [7]. В начале ноября 2020 года датские власти сообщили о 214 случаях заболевания человека коронавирусной инфекцией (COVID-19), связанных с норковыми фермами. Многие последовательности SARS-CoV-2 в Нидерландах и Дании несли мутацию Y453F в рецептор-связывающем домене S-белка, которая может усиливать его способность связываться с АПФ2 (ангиотензинпревращающим ферментом 2) у норок. У одиннадцати человек, заразившихся во время датской вспышки, обнаружен вариант вируса под названием «кластер 5», несущий в гене S-белка три дополнительные мутации (del69_70, I692V и M1229I). Первоначальное исследование девяти образцов сыворотки выздоравливающих людей показало умеренное и статистически значимое снижение нейтрализующей активности антител против вирусов из кластера 5 (в среднем в 3,58 раза; диапазон 0–13,5). Очевидная адаптация SARS-CoV-2 к норке, тем не менее, вызывает беспокойство, поскольку продолжающаяся эволюция вируса в организме животных-носителей потенциально может привести к повторным передачам нового SARS-CoV-2 от норки к человеку и другим млекопитающим. По этой причине многие страны активизировали усилия по эпиднадзору и в некоторых случаях осуществили крупномасштабные выбраковки (то есть выборочный забой) норок на фермах.
Линия B.1.1.7 и мутация N501Y
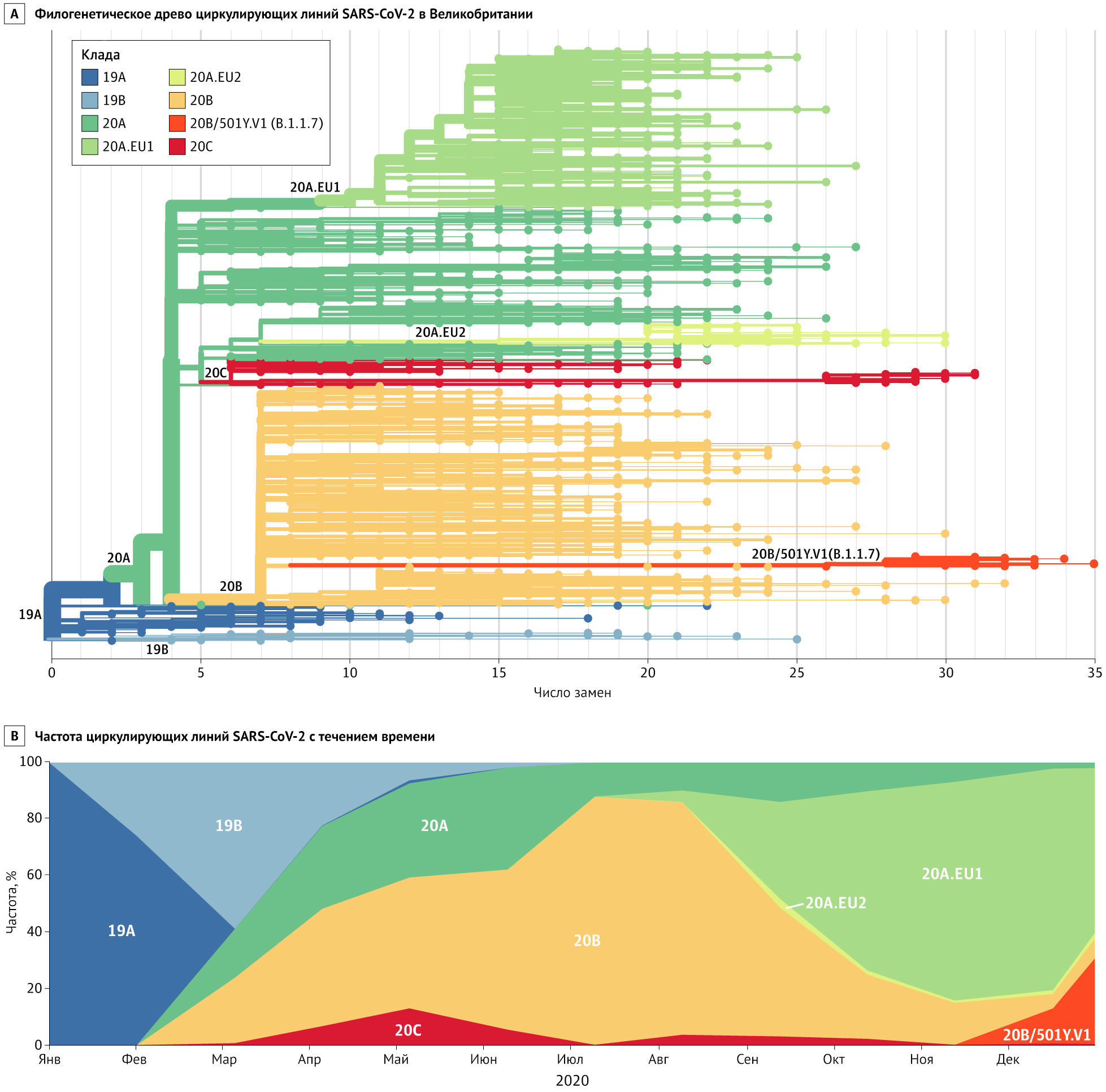
Линия B.1.1.7 (также называемая 501Y.V1) представляет собой филогенетический кластер, который быстро распространяется на юго-востоке Англии [8] (Рисунок). До его обнаружения в начале сентября эта линия накопила 17 специфических мутаций, что свидетельствует о значительной предшествующей эволюции, возможно, в хронически инфицированном хозяине. По состоянию на 28 декабря 2020 года на этот вариант приходилось примерно 28 % случаев заражения SARS-CoV-2 в Англии, и популяционно-генетические модели позволяют предположить, что данная линия распространяется на 56 % быстрее других. В отличие от D614G, для которой, вероятно, могли быть выгодными ранние случайные события, линия B.1.1.7 распространилась, когда SARS-CoV-2 выявлялся уже повсеместно, и, по-видимому, достигла доминирующего положения, превзойдя существующую популяцию циркулирующих вариантов. Это убедительно говорит о естественном отборе вируса с большей трансмиссивностью на популяционном уровне. В то время как меры общественного здравоохранения, такие как маски, соблюдение дистанции и ограничение больших скоплений людей, должны оставаться эффективными, но борьба с более трансмиссивным («более заразным») вариантом, вероятно, потребует более строгого применения и повсеместного принятия этих мер.
Восемь мутаций линии B.1.1.7 затрагивают гликопротеин шиповидных отростков (S-белок), в числе которых N501Y в рецептор-связывающем домене, делеция 69_70 и P681H в сайте расщепления фурином. Все эти мутации могут влиять на связывание АПФ2 и репликацию вируса. Предполагается, что варианты с заменой 501Y в S-белке обладают более высоким сродством к АПФ2 человека. Другой вариант, также с мутацией N501Y, быстро распространяется в Южной Африке. Влияние этих мутаций на антигенность в настоящее время не ясно.
Иммуногенность и эффективность вакцины
Наблюдение за вариантами SARS-CoV-2 в основном сосредоточено на мутациях в гликопротеине шиповидных отростков (S-белке), который опосредует прикрепление к клеткам и является основной мишенью нейтрализующих антител. Существует большой интерес к тому, способствуют ли мутации в S-белке ускользанию от антител хозяина и могут ли они потенциально поставить под угрозу эффективность вакцин, поскольку в современных вакцинах именно S-белок является основным вирусным антигеном. На данном этапе строгий отбор вариантов на уровне популяции, вероятно, не обусловлен антителами хозяина, поскольку на данный момент нет достаточного количества иммунных индивидов для систематического продвижения эволюции вируса в каком-либо определенном направлении. Напротив, если у варианта в S-белке есть одна или несколько мутаций, повышающих трансмиссивность, он может быстро превзойти и вытеснить другие циркулирующие варианты. Поскольку современные вакцины вызывают иммунный ответ на весь S-белок, все еще есть надежда на эффективную защиту, несмотря на некоторые изменения в антигенных участках у различных вариантов SARS-CoV-2.
Разделение причины и следствия важно при оценке данных по нейтрализации антителами вариантов S-белка. Независимо от причины отбора мутации, разумно ожидать, что многие мутации в S-белке могут повлиять на нейтрализацию антителами. Поэтому важно учитывать как уровень изменения нейтрализации, так и количество проанализированных образцов сыворотки. Другая проблема заключается в том, что вирусные гликопротеины подвержены эволюционным компромиссам. Иногда мутация, усиливающая одно свойство вируса, например, связывание с рецептором, может ослабить другое свойство, такое как избегание антител хозяина. Действительно, недавние данные указывают на то, что это может иметь место в случае D614G [10]. Возможно, что мутации в S-белке, которые «полезны» для вируса прямо сейчас, также могут сделать его менее приспособленным к преодолению популяционного иммунитета в будущем. Определение этой динамики и ее потенциального влияния на эффективность вакцин потребует широкомасштабного мониторинга эволюции SARS-CoV-2 и иммунитета хозяина в течение длительного времени.